- Ваш ответ
- решение вопроса
- Похожие вопросы
- Диссоциация кислот, оснований, амфотерных гидроксидов и солей в водных растворах
- Напишите уравнения диссоциации гидроксида цинка по типу основания и по типу кислоты. Какой из указанных ниже факторов (нагревание, повышение или понижение рН) усилит диссоциацию в каждом случае?
- Описание и исходные данные задания, 50% решения + фотография:
- 🎬 Видео
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Ваш ответ
Видео:Опыты по химии. Амфотерность гидроксида цинкаСкачать

решение вопроса
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Электролитическая диссоциация / Диссоциация основанийСкачать

Диссоциация кислот, оснований, амфотерных гидроксидов и солей в водных растворах
Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н + . Составим уравнение электролитической диссоциации сильных кислот: а) одноосновной азотной кислоты HNО3 и б) двухосновной серной кислоты H2SO4:
Число ступеней диссоциации зависит от основности слабой кислоты Нх(Ас), где х — основность кислоты.
Пример: Составим уравнения электролитической диссоциации слабой двухосновной угольной кислоты Н2СО3.
Первая ступень диссоциации (отщепление одного иона водорода Н + ):
Константа диссоциации по первой ступени:
Вторая ступень диссоциации (отщепление иона водорода Н + от сложного иона НСО3 — ):
Растворы кислот имеют некоторые общие свойства, которые, согласно теории электролитической диссоциации, объясняются присутствием в их растворах гидратированных ионов водорода Н + (Н3О + ).
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН — .
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН:
Сильное двухкислотное основание Ca(OH)2 диссоциирует так:
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у, где у — кислотность основания.
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Fe(OH)2.
Первая ступень диссоциации (отщепляется один гидроксид-ион ОН — ):
Вторая ступень диссоциации (отщепляется гидроксид-ион ОН — от сложного катиона FeOH + ):
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН — .
Каждая ступень диссоциации слабых многоосновных кислот и слабых многокислотных оснований характеризуется определенной константой диссоциации: K1, K2, K3, причем K1 > K2 > K3. Это объясняется тем, что энергия, которая необходима для отрыва иона Н + или ОН — от нейтральной молекулы кислоты или основания, минимальна. При диссоциации по следующей ступени энергия увеличивается, потому что отрыв ионов происходит от противоположно заряженных частиц.
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями. Теория электролитической диссоциации объясняет двойственные свойства амфотерных гидроксидов.
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н + и гидроксид-анионы ОН — , т. е. диссоциируют по типу кислоты и по типу основания.
К амфотерным гидроксидам относятся Ве(ОН)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и другие. Амфотерным электролитом является также вода Н2O.
В амфотерных гидроксидах диссоциация по типу кислот и по типу оснований происходит потому, что прочность химических связей между атомами металла и кислорода (Ме—О) и между атомами кислорода и водорода (О—Н) почти одинаковая. Поэтому в водном растворе эти связи разрываются одновременно, и амфотерные гидроксиды при диссоциации образуют катионы Н + и анионы ОН — .
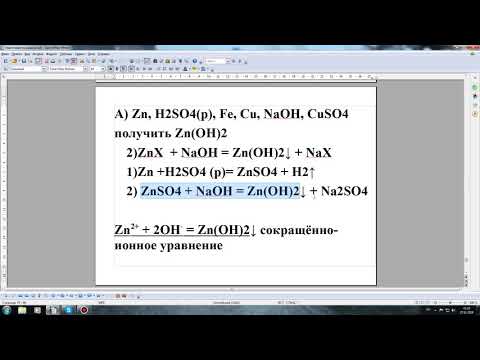
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета ее ступенчатого характера:
Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Составим уравнения электролитической диссоциации нормальных солей: а) карбоната калия K2CO3, б) сульфата алюминия Al2(SO4)3:
Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Составим уравнения электролитической диссоциации кислой соли гидрокарбоната натрия NaHCО3.
Сложный анион НСО3 — (гидрокарбонат-ион) частично диссоциирует по уравнению:
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы состоящие из атомов металла и гидроксогрупп ОН — .
Составим уравнение электролитической диссоциации основной соли Fe(OH)2Cl — дигидроксохлорида железа (III):
Сложный катион частично диссоциирует по уравнениям:
Для обеих ступеней диссоциации Fe(OH)2 + .
Видео:Гидролиз солей. 9 класс.Скачать

Напишите уравнения диссоциации гидроксида цинка по типу основания и по типу кислоты. Какой из указанных ниже факторов (нагревание, повышение или понижение рН) усилит диссоциацию в каждом случае?






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Напишите уравнения диссоциации гидроксида цинка по типу основания и по типу кислоты. Ка кой из указанных ниже факторов (нагревание, повышение или понижение рН) усилит диссоциацию в каждом случае?
Решение :
Амфотерные гидроксиды, диссоциируют по основному типу:
Zn ( OH )2 ↔ ZnOH + + OH –
ZnOH + ↔ Zn 2+ + OH –
| Если вам нужно решить химию, тогда нажмите ➔ заказать контрольную работу по химии. |
| Похожие готовые решения: |
- Напишите в молекулярной и ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: а) Pb(NO3)2 + Н2О; б) NiCl2 + H2S; в) K2CO3 + HCl.
- Рассчитать фактор эквивалентности и молярную массу эквивалента реагирующих веществ в реакций нейтрализации Ва(ОН)2 серной кислотой в следующих реакциях: HBrO3 + H2S = HBr + H2SO4 HNO3 + Mg = Mg(NO3)2
- Рассчитайте массовую долю 1,25 н. раствора фосфорной кислоты, если плотность раствора составляет 1,05 г/мл.
- При 20 °С осмотическое давление водного раствора неэлектролита равно 4,38∙105 Па. Чему будет равно осмотическое давление, если раствор разбавить в 3 раза, а температуру повысить до 40 °С?
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
🎬 Видео
Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Получим гидроксиды в 2 стадии (закрепление материала)Скачать
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Электролитическая диссоциацияСкачать

Химические свойства веществ часть 2Скачать

ГИДРОЛИЗ СОЛЕЙ 2Скачать

Электролиз. 10 класс.Скачать

♨️Как один ИЛ всё изменил... Чаплыга: Украину сбросили на ЕС. Лубинец против ТЦК. Поддон МОБИЛИЗАЦИИСкачать

Амфотерность. Амфотерные оксиды и гидроксидыСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

9 класс. Химия. Амфотерные оксиды и гидроксидыСкачать

Реакция нейтрализацииСкачать

Классификация гидроксидов. Основания. Неорганическая химия.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

лекция 10 электролитическая диссоциация 2Скачать


















