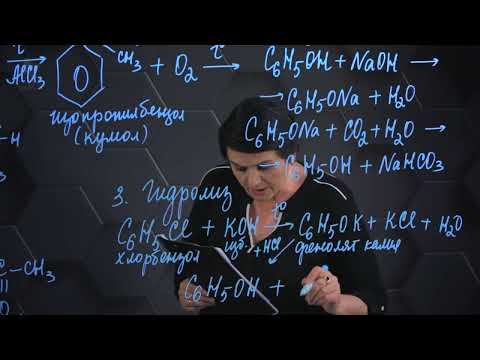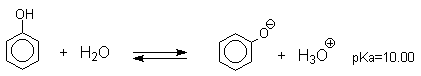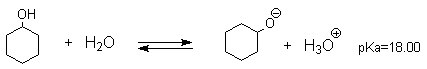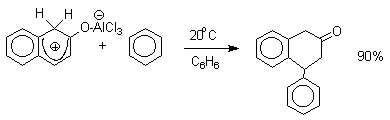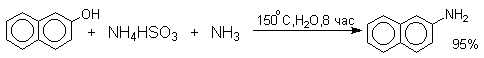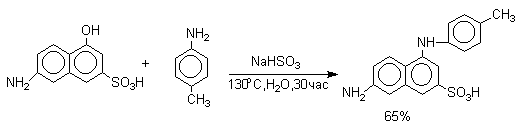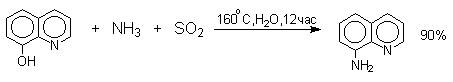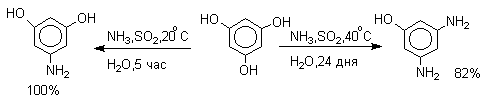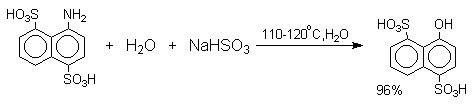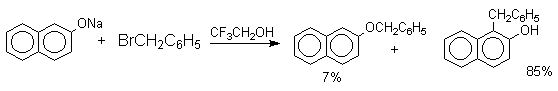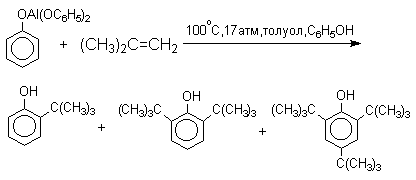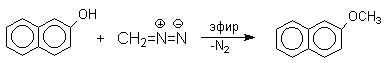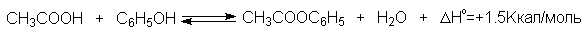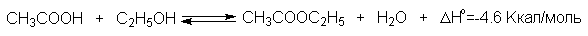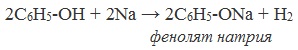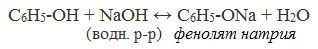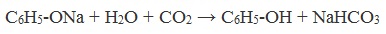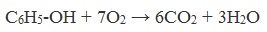Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
- Классификация фенолов
- По числу гидроксильных групп:
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
- 1. Взаимодействие хлорбензола с щелочами
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- Уравнение диссоциации фенола в воде
- Уравнение диссоциации фенола в воде
- I. Реакции с участием гидроксильной группы
- II . Реакции, с участием бензольного кольца
- III. Реакция окисления
- IV. Качественная реакция! — обнаружение фенола
- 🎥 Видео
Видео:9.3. Фенол: Химические свойстваСкачать

Классификация фенолов
Видео:Взаимодействие фенола с бромной водойСкачать

По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Строение фенолов
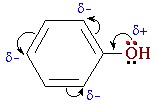
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Видео:Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – ПростоСкачать

Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
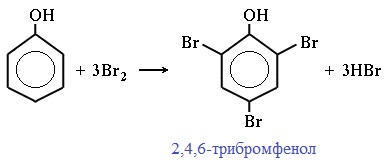
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
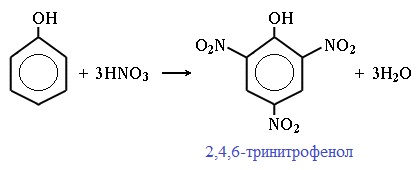
2.2. Нитрование
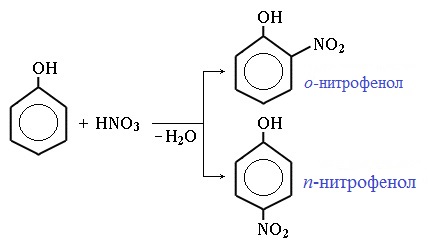
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
Видео:Механизм электролитической диссоциации. 9 класс.Скачать

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

4. Взаимодействие с хлоридом железа (III)
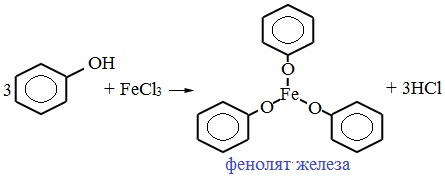
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

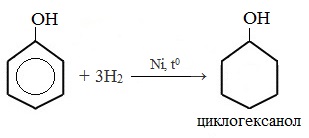
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Видео:Фенолы. 1 часть. 10 класс.Скачать

Получение фенолов
Видео:Химия 9 класс (Урок№5 - Сущность процесса электролитической диссоциации.)Скачать

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
Видео:Фенолы. 2 часть. 10 класс.Скачать

2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
Видео:ФенолыСкачать

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Видео:Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Уравнение диссоциации фенола в воде
3. Свойства фенолов
3.1. Кислотные свойства фенолов
Несмотря на то, что фенолы по строению подобны спиртам, они являются намного более сильными кислотами, чем спирты. Для сравнения приведем величины рКа в воде при 25 о С для фенола (10,00), для циклогексанола (18,00). Из этих данных следует, что фенолы на восемь и более порядков по кислотности превосходят спирты.
Диссоциация спиртов и фенолов представляет собой обратимый процесс, для которого положение равновесия количественно характеризуется величиной разности свободных энергий G о продуктов и исходных веществ. Для определения влияния строения субстрата на положение кислотно-основного равновесия необходимо оценить разницу энергий между кислотой ROH и сопряженным основанием RO- . Если структурные факторы стабилизируют сопряженное основание RO- в большей степени, чем кислоту ROH, константа диссоциации возрастает и рКа, соответственно уменьшается. Напротив, если структурные факторы стабилизируют кислоту в большей степени, чем сопряженное основание, кислотность уменьшается, т.е. рКа возрастает. Фенол и циклогексанол содержат шестичленное кольцо и поэтому структурно похожи, но фенол в 10 8 раз более сильная ОН-кислота по сравнению с циклогексанолом. Это различие объясняется большим +М эффектом О- в феноксид-ионе. В алкоголят-ионе циклогексанола отрицательный заряд локализован только на атоме кислорода и это предопределяет меньшую стабильность алкоголят-иона по сравнению с феноксид-ионом. Феноксид-ион относится к типичным амбидентным ионам, т.к. его отрицательный заряд делокализован между кислородом и атомами углерода в орто- и пара- положениях бензольного кольца. Поэтому для феноксид-ионов, как амбидентных нуклеофилов, должны быть характерны реакции не только с участием атома кислорода, но и с участием атома углерода в орто- и пара-положениях в бензольном кольце. Влияние заместителя в бензольном кольце на кислотность фенолов согласуется с представлениями об их электронных эффектах. Электронодонорные заместители понижают, а электроноакцепторные — усиливают кислотные свойства фенолов. В таблицах 1 и 1а приведены данные по кислотности некоторых фенолов в воде при 25 о С.
Таблица 1.
Величины рКа орто-, мета- и пара-замещенных фенолов в воде при 25 о С
| Заместитель | орто | мета | пара |
| H | 10.00 | 10.00 | 10.00 |
| CH3 | 10.29 | 10.09 | 10.26 |
| C(CH3)3 | 10.62 | 10.12 | 10.23 |
| C6H5 | 10.01 | 9.64 | 9.55 |
| OCH3 | 9.98 | 9.65 | 10.21 |
| COOC2H5 | 9.92 | 9.10 | 8.34 |
| F | 8.73 | 9.29 | 9.89 |
| Cl | 8.56 | 9.12 | 9.41 |
| Br | 8.45 | 9.03 | 9.37 |
| I | 8.51 | 9.03 | 9.33 |
| HCO | 8.37 | 8.98 | 7.61 |
| CN | 6.86 | 8.61 | 7.97 |
| NO2 | 7.23 | 8.36 | 7.15 |
Таблица 1а
Величины рКа некоторых полизамещенных фенолов и нафтолов
| пентахлорфенол | 5.26 |
| пентафторфенол | 5.5 |
| 1-нафтол | 9.39 |
| 2-нафтол | 9.63 |
| 2,4-динитрофенол | 4.07 |
| 2,4,6-тринитрофенол | 0.42 |
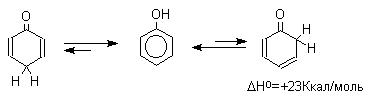
3.2. Таутомерия фенолов
Естественно, что между амбидентными феноксид и енолят-ионами существует определенная аналогия. Фенол также является аналогом енола и между ним и его кето-формами (2,4- и 2,5-циклогексадиенами) должны существовать отношения, подобные тем, которые наблюдаются для равновесия кето- и енольной форм кетонов.
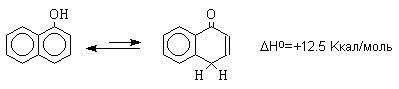
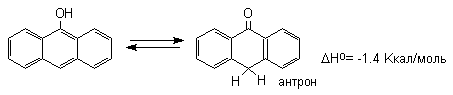
Для самого фенола энтальпия этого равновесия составляет величину порядка +23 Ккал/моль, что соответствует логарифму константы равновесия в уравнении Гиббса порядка 9,5 2,5, т.е. равновесие целиком смещено в сторону фенольной формы. Таким образом, соотношение двух таутомерных форм здесь полностью обратно тому, которое наблюдается для кетонов, где преобладает кето-форма. Это различие не удивительно, если принять во внимание ароматическую стабилизацию бензольного кольца фенола. Для других одно- и двухатомных фенолов бензольного ряда также не удается наблюдать прототропную таутомерию. Для полициклических конденсированных ароматических соединений различие в термодинамической устойчивости фенольной и диеноновой форм резко уменьшается, и для 1-нафтола фенольная форма на 12,5 Ккал/моль стабильнее диенона, тогда как для 9-гидроксиантрацена кетоформа антрона уже оказывается термодинамически более стабильной формой.
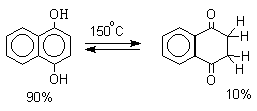
Для 9-гидроксиантрацена известны обе формы, причем в неполярных растворителях (петролейный эфир, бензол, ССl4) равновесие сдвинуто в сторону антрона (К 20 =400 в бензоле). Устойчивость таутомерных кето-форм возрастает при переходе к полиатомным фенолам. Так, при плавлении 1,4-дигидроксинафталина получается равновесная смесь, содержащая 10%-дикетоформы.
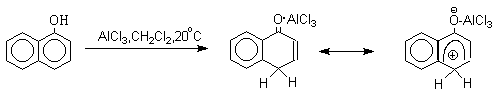
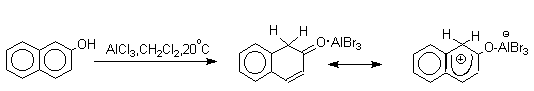
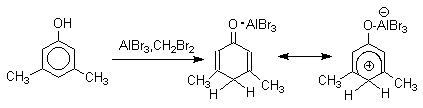
Длительное время не предпринималось попыток фиксации или стабилизации кето-формы фенолов ряда бензола и нафталина и проблема таутомерии фенолов не привлекала внимания исследователей. В 1968 году В.А.Коптюг с сотрудниками предложил простой и чрезвычайно эффективный способ стабилизации кето-формы разнообразных фенолов с помощью сильных кислот Льюиса- хлорида или бромида алюминия. Эти жесткие кислоты Льюиса связывают жесткий карбонильный кислород кето-формы в очень стабильный комплекс, который может быть зафиксирован с помощью ПМР- и ИК-спектроскопии. При этом для 1-нафтола, 2-нафтола и фенолов бензольного ряда, содержащих хотя бы одну алкильную группу в мета-положении к гидроксилу, равновесие в неполярной среде нацело смещается в сторону кето-формы.
Эти комплексы можно рассматривать также как биполярные ионы, т.е. как гидроксиаренониевые ионы, образующиеся при протонировании фенолов по бензольному кольцу. Для них должны быть характерны реакции, типичные для аренониевых ионов. Действительно, комплекс 2-нафтола с хлоридом алюминия может быть использован в качестве электрофильного агента в электрофильном ароматическом замещении в бензольном кольце.
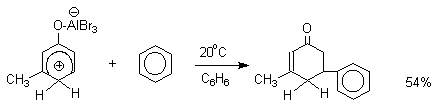
Аналогично реагирует и комплекс мета-крезола с AlBr3.
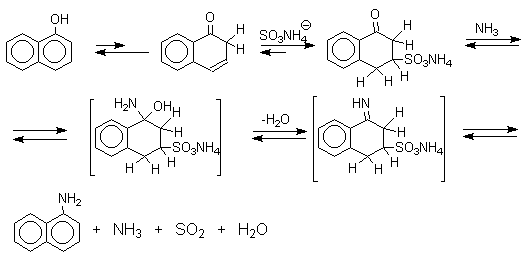
Кето-енольная таутомерия лежит в основе замещения фенольного гидроксила на аминогруппу, которое происходит при нагревании 1- или 2-гидроксинафталина, сульфопроизводных — и -нафтолов, 6- или 8-гидроксихинолинов и других гидроксипроизводных нафталина, антрацена, хинолина с водным раствором сульфита или гидросульфита аммония при 130-150 о С.
Эта реакция, открытая Г.Бухерером в 1904 году, применима к одноатомным фенолам ряда нафталина, антрацена и других конденсированных ароматических систем, но в нее практически не вступают одноатомные фенолы бензольного ряда.
В ряду производных бензола в реакцию вступают многоатомные фенолы, содержащие две или три гидроксильные группы в мета-положении к друг другу:
Для реакции Бухерера предложен, но строго не доказан механизм, в котором сульфит- или гидросульфит-ион присоединяется в -положение кето-формы нафтола с образованием -кетосульфокислоты в качестве интермедиата, который в отдельных случаях был выделен в индивидуальном виде.
Последующее аминирование и отщепление сернистой кислоты приводит к амину. Реакция обратима и при обработке 1- или 2-амино-нафталина и их производных гидросульфитом натрия в воде при 130-150 о С они превращаются в соответствующие фенолы, например:
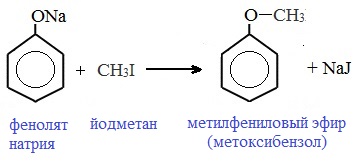
3.3. С- и О-Алкилирование амбидентных фенолят-ионов
Феноксид-ионы, как типичные амбидентные анионы, способны к реакциям О- и С-алкилирования. В большинстве случаев феноксид-ионы подвергаются региоселективному О-алкилированию независимо от природы радикала и уходящей группы алкилирующего агента. Самые разнообразные жесткие и мягкие алкилирующие агенты дают эфиры фенолов в реакциях со щелочными фенолятами. Наилучшие результаты для О-алкилирования достигаются в диполярных апротонных растворителях, хорошо сольватирующих катионы щелочных металлов.
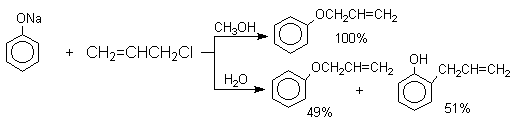
Если же растворитель избирательно сольватирует кислородный центр феноксид-иона, открывается возможность для С-алкилирования. Кислородный центр феноксид-ионов подвергается избирательной сольватации с помощью водородной связи в воде, трифторэтаноле, феноле. В этих растворителях удается осуществить С-алкилирование феноксид-иона под действием таких мягких алкилирующих агентов, как аллилгалогениды и бензилгалогениды.
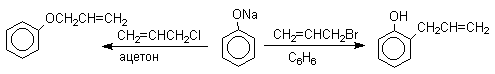
Кислородный центр аниона блокируется в результате избирательной сольватации и алкилирующий агент атакует другой нуклеофильный центр амбидентного аниона — атом углерода в орто-положении по отношению к атому кислорода. Аналогичный результат может быть достигнут за счет блокирования кислородного центра противоионом в сложном ассоциате ионных пар щелочных фенолятов и нафтолятов. Действительно, при алкилированиии фенолята натрия в бензоле аллилбромидом образуется 2-аллилфенол, тогда как в ацетоне в тех же условиях получается только аллиловый эфир фенола.
По той же причине алюминиевые соли фенолов подвергаются С-алкилированию в орто-положение бензольного кольца.
Эта реакция имеет практическое значение для синтеза стерически затрудненных фенолов, используемых в качестве стабилизаторов полимеров против термоокислительной деструкции. Фенолы, подобно карбоновым кислотам, подвергаются селективному О-метилированию при действии диазометана в эфирном растворе. Напомним, что спирты реагируют с диазометаном только в присутстсвии катализаторов — кислот Льюиса.
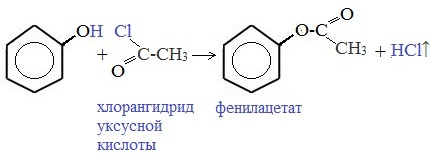
3.4. Этерификация фенолов
Ариловые эфиры карбоновых кислот нельзя получать прямой этерификацией фенолов карбоновыми кислотами. Обратимая реакция фенола с уксусной кислотой эндотермична в отличие от реакции этерификации спиртов, которая экзотермична.
Ариловые эфиры карбоновых кислот получают ацилированием фенолов или их Na-, K-солей галогенангидридами или ангидридами кислот.
Видео:Электролитическая диссоциацияСкачать

Уравнение диссоциации фенола в воде
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
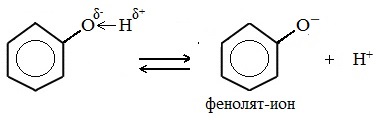
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
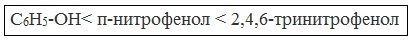
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: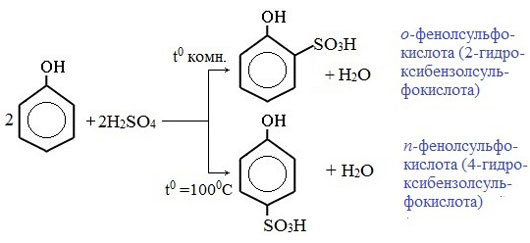
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
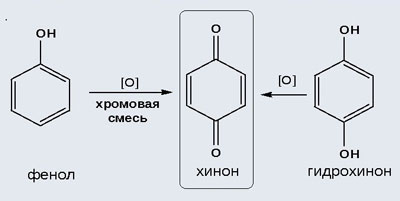
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
🎥 Видео
9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Химические свойства фенола. 10 класс.Скачать

Механизм электролитической диссоциацииСкачать

Фенолы. Химические свойства. 1 часть. 10 класс.Скачать

Электролитическая диссоциацияСкачать

Фенолы. Получение. 10 класс.Скачать