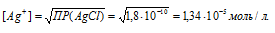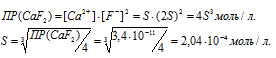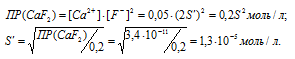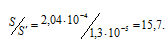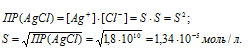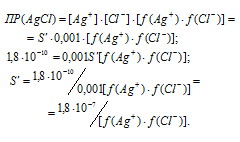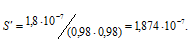Задача 571.
Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе AgCl, если прибавить к нему столько соляной кислоты, чтобы концентрация ионов Cl — в растворе стала равной 0,03 моль/л?
Решение:
Уравнение диссоциации AgCl имеет вид:
AgCl ⇔ Ag+ + Cl — ;
ПР(AgCl) = [Ag + ] + [Cl — ] = 1,8 . 10 -10 .
Поскольку [Ag +] = [Cl — ], то после прибавления соляной кислоты концентрация ионов Ag + и ионов Cl — стала равной 0,03 моль/л, т.е. [Ag + ] = [Cl — ] = 0,03 моль/л.
Рассчитаем уменьшение концентрации ионов Ag + :
0,03/(1,34 . 10-5) = 2239.
Ответ: в 2239 раз.
Задача 572.
Вычислить растворимость (в моль/л) CaF2 в воде и в 0,05 М растворе CaCl2. Во сколько раз растворимость во втором случае меньше, чем в первом?
Решение:
а) Вычисление растворимости соли CaF2 в воде
Обозначим искомую растворимость соли CaF2 через S (моль/л). Тогда в насыщенном растворе CaF2 содержится S моль/л) ионов Ca 2+ и 2S (моль/л) ионов Cl — .
б) Вычисление растворимости соли CaF2 в 0,05 М растворе CaCl2
Находим растворимость соли CaF2 в 0,05М раствора CaCl2, обозначив её через S’. Концентрация ионов F- в насыщенном растворе будет равна 2S’, а концентрация ионов Ca 2+ составит (S’ + 0,05) Поскольку S’ 2+ ] = 0,05 моль/л. Тогда можно записать:
Находим, во сколько раз растворимость соли CaF2 уменьшилась в присутствии 0,05М раствора CaCl2:
Ответ: а) 2,04 . 10 -4 моль/л; б) 1,3 . 10 -5 моль/л; в) в 15,7 раза.
Задача 573.
Во сколько раз растворимость AgCl в 0,001 н. растворе NaCl меньше, чем в воде? Расчет произвести с учетом коэффициентов активности, пользуясь табличными данными.
Решение:
Обозначим искомую растворимость соли через S(моль/л). Тогда в насыщенном растворе AgCl содержится S (моль/л) ионов Ag + и S(моль/л) ионов Cl — .
Выразим произведение растворимости соли AgCl через активности ионов:
Пр(AgCl) = 

Обозначим искомую растворимость соли AgCl через S’, находим, что [Ag + ] = S’ (моль/л), [Cl — ] = S’ ( + 0,001 моль/л). Поскольку S’ — ] = 0,001 моль/л. Тогда можно записать:
Для нахождения значений коэффициентов активностей ионов нужно вычислить значение ионной силы раствора сильного электролита NaCl:
I(NaCl) = 1/2[CM(Na + ) . Z 2 (Na + ) + CM(Cl — ) . Z 2 (Cl — )] =
= 1/2[(0,001 . 12) + (0,001 . 12)] = 0,001 моль/л.
Согласно табличным данным при ионной силе раствора равной 0,001 коэффициенты активностей однозарядных ионов равны 0,98.
Рассчитаем, во сколько раз S’ меньше, чем S:
- Хлорид серебра (AgCl), формула, диссоциация, свойства
- Как получить хлорид серебра?
- диссоциация
- Низкая диссоциация в воде
- Физические свойства
- Химические свойства
- Разложение под воздействием тепла или света
- Осаждение серебра
- растворимость
- Использование и приложения
- фотография
- гравиметрия
- Анализ воды
- волюметрия
- Cоставьте уравнение диссоциации хлорида серебра AgCl.
- 💥 Видео
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Хлорид серебра (AgCl), формула, диссоциация, свойства
хлорид серебра (AgCl химической формулы), представляет собой бинарную соль, образованную серебром и хлором. Серебро — блестящий, пластичный и ковкий металл с химическим символом Ag. Чтобы иметь возможность образовывать новые соединения, этот металл должен быть окислен (потеряв электрон своего последнего энергетического уровня), который превращает его в его ионные частицы, катион серебра, положительно заряженный.
Хлор — газ зеленовато-желтого цвета, слегка раздражающий и с неприятным запахом. Его химический символ — Cl. Для образования химических соединений с металлами хлор восстанавливается (получает электрон, чтобы завершить восемь электронов на своем последнем энергетическом уровне) до его хлорид-аниона, заряженного отрицательно..
При обнаружении в ионной форме оба элемента могут образовывать соединение хлорида серебра либо естественным путем (как можно найти в некоторых месторождениях), либо химическим синтезом, который дешевле получить.
Хлорид серебра находится в нативном виде в виде хлоргидрита («хлор» для хлора, «аргыр» для аргента). Окончание «ите» указывает на название минерала.
Он имеет зеленовато-желтый вид (очень типичный для хлора) и сероватый по серебру. Эти тональности могут варьироваться в зависимости от других веществ, которые могут быть найдены в окружающей среде.
Полученный синтетически хлорид серебра выглядит как белые кристаллы, очень похожие на кубическую форму хлорида натрия, хотя в целом он будет выглядеть как белый порошок.
- 1 Как получить хлорид серебра?
- 2 Диссоциация
- 2.1 Низкая диссоциация в воде
- 3 Физические свойства
- 4 Химические свойства
- 4.1 Разложение под воздействием тепла или света
- 4.2 Осаждение серебра
- 4.3 Растворимость
- 5 Использование и применение
- 5.1 Фотография
- 5.2 Гравиметрия
- 5.3 Анализ воды
- 5.4 Объемность
- 6 Ссылки
Видео:Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Как получить хлорид серебра?
В лаборатории его можно легко получить следующим способом:
Нитрат серебра вступает в реакцию с хлоридом натрия и образуется хлорид серебра, который выпадает в осадок, как показано стрелкой вниз, а нитрат натрия растворяется в воде.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

диссоциация
Диссоциация в химии относится к возможности того, что ионное вещество может быть разделено на его компоненты или ионы, когда оно встречает вещество, которое позволяет такое разделение.
Это вещество известно как растворитель. Вода универсальный растворитель, который может диссоциировать большинство ионных соединений.
Хлорид серебра называют галоидной солью, потому что он образуется с элементом хлора, который соответствует семейству VIIA периодической таблицы, называемому галогенами. Галоидные соли — это ионные соединения, в основном плохо растворимые в воде.
Низкая диссоциация в воде
AgCl, который принадлежит к этому типу соединений, имеет очень низкую диссоциацию в воде. Такое поведение может быть вызвано следующими причинами:
— Когда образуется AgCl, именно в коллоидном состоянии, когда молекула диссоциирует на свои ионы серебра (+) и хлора (-), сразу же образуется исходная молекула хлорида серебра AgCl, устанавливающая динамическое равновесие между ними. (диссоциированный продукт и нейтральная молекула).
— Из-за молекулярной стабильности AgCl, когда образуется связь, его прочность имеет тенденцию быть более ковалентной, чем ионной, создавая устойчивость к диссоциации.
— Плотность серебра намного выше, чем у хлора, и именно серебро уменьшает диссоциацию и увеличивает осаждение AgCl в растворе.
Одним из факторов, влияющих на растворимость вещества, является температура. При нагревании вещества, растворенного в воде, растворимость увеличивается, и, следовательно, диссоциация его компонентов легче. Однако перед нагреванием AgCl подвергается разложению в газообразном Ag и Cl.
Видео:Механизм электролитической диссоциации. 9 класс.Скачать

Физические свойства
Это те характеристики, которыми обладает вещество и которые позволяют идентифицировать его и отличать от других. Эти свойства не изменяют внутреннюю структуру вещества; то есть они не изменяют расположение атомов в формуле.
Хлорид серебра имеет твердый белый кристаллический цвет без запаха и в чистом виде имеет геометрию в форме октаэдра. Основные физические свойства описаны ниже:
— Температура плавления: 455 ° C
— Точка кипения: 1547 ° C
— Плотность: 5,56 г / мл
— Молярная масса: 143,32 г / моль.
Когда он обнаружен как хлораргирит (минерал), он имеет твердый вид и может быть бесцветным, зелено-желтым, зелено-серым или белым, в зависимости от места и веществ, которые находятся вокруг него. Твердость по шкале Мооса от 1,5 до 2,5..
Считается также блеском, адамантином (алмазом), смолой и шелковистостью. Это относится к несколько яркой внешности.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Химические свойства
Речь идет о реакционной способности химического вещества, когда он находится в контакте с другим. В этом случае его внутренняя структура не сохраняется, поэтому атомное расположение в формуле изменяется.
Разложение под воздействием тепла или света
Разлагает хлорид серебра на элементы.
Осаждение серебра
Осаждение серебра — лучший способ извлечь этот элемент из фотографических и рентгенографических пленок..
растворимость
Хлорид неба очень нерастворим в воде, но растворим в низкомолекулярных спиртах (метанол и этанол), в аммиаке и в концентрированной серной кислоте..
Видео:9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Использование и приложения
фотография
Хлорид серебра используется из-за его высокой чувствительности к свету. Этот процесс был открыт Уильямом Генри Фоксом Тэлботом в 1834 году..
гравиметрия
Гравиметрический анализ состоит в определении количества элемента, радикала или соединения, которое содержится в образце. Для этого необходимо удалить все вещества, которые могут создавать помехи, и преобразовать вещество, подлежащее исследованию, в вещество определенного состава, которое можно взвесить.
Это получается с помощью веществ, которые легко осаждаются в водной среде, как это происходит с AgCl.
Анализ воды
Этот процесс осуществляется посредством оценки, которая проводится с использованием AgNO3 в качестве титранта и индикатора, определяющего окончание реакции (изменение цвета); то есть, когда в воде больше нет хлоридов.
Эта реакция приводит к осаждению AgCl вследствие сродства хлорид-иона к катиону серебра.
волюметрия
Это оценка образца с неизвестной концентрацией (хлориды или бромиды). Чтобы найти концентрацию образца, он реагирует с веществом; конечная точка реакции распознается по образованию осадка. В случае хлоридов это будет хлорид серебра.
Видео:Задание 13: Все про электролитическую диссоциацию на ОГЭСкачать

Cоставьте уравнение диссоциации хлорида серебра AgCl.
| 🎓 Заказ №: 22179 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Cоставьте уравнение диссоциации хлорида серебра AgCl. Вычислите растворимость AgCl при 25 °С.
Решение: Уравнение диссоциации хлорида серебра AgCl Ag Cl Произведение концентраций ионов Ag и Cl в насыщенном водном растворе хлорида серебра – постоянная величина (произведение растворимости ПР). При 25 °С произведение растворимости хлорида серебра равно
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
💥 Видео
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать

Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Химия 9 класс (Урок№5 - Сущность процесса электролитической диссоциации.)Скачать

Реакции ионного обмена. 9 класс.Скачать

Механизм электролитической диссоциацииСкачать

Основные положения теории электролитической диссоциации | Химия 8 класс #41 | ИнфоурокСкачать

72. Электролитическая диссоциацияСкачать

75. Ионные реакции в растворах электролитовСкачать

Теории кислот, оснований и растворов. Теория Аррениуса-Оствальда. 11 класс.Скачать

Теория электролитической диссоциацииСкачать