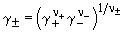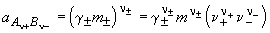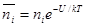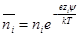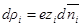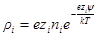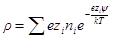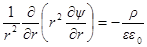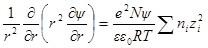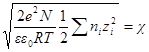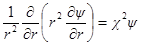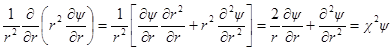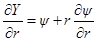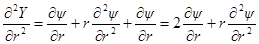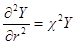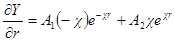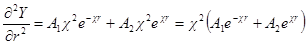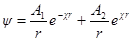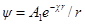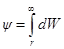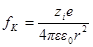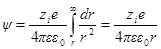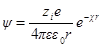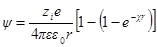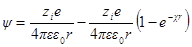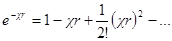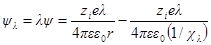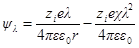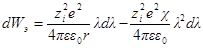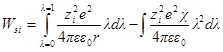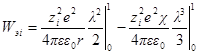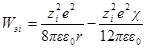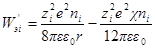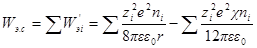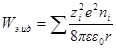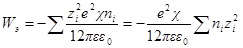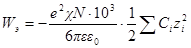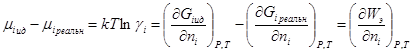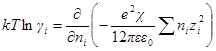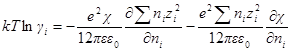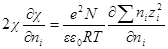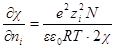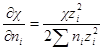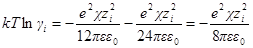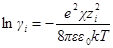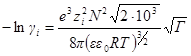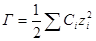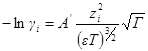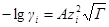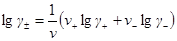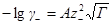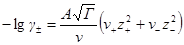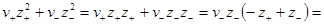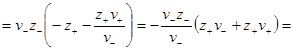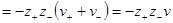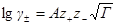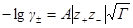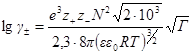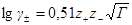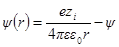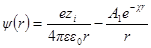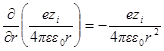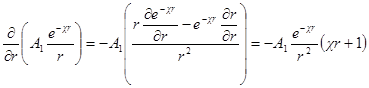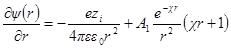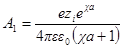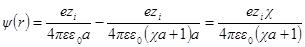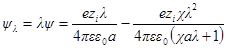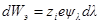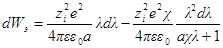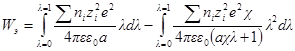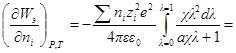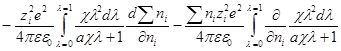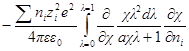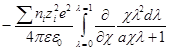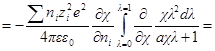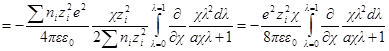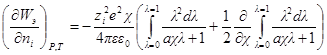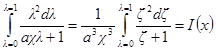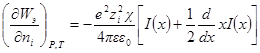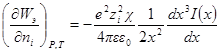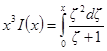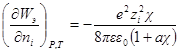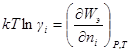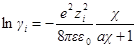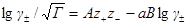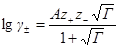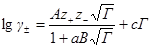Переносчиками электрического тока в растворах электролитов являются ионы, образующиеся при диссоциации молекул электролитов. Поскольку при диссоциации число частиц в растворе возрастает, растворы электролитов обладают аномальными коллигативными свойствами.
Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств идеальных растворов электролитов, если ввести поправочный изотонический коэффициент Вант-Гоффа i, например:


Изотонический коэффициент связан со степенью диссоциации 
i = 1 + 
где n — количество ионов, образующихся при диссоциации одной молекулы.
Свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность. Активность иона ai выражается в виде произведения концентрации иона mi на его коэффициент активности 
ai = 
Экспериментально определить активности катиона a+ и аниона a— невозможно, поэтому вводится понятие средней ионной активности a 
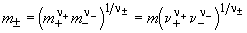
Аналогично определяют средний ионный коэффициент активности 
и среднюю ионную моляльность m
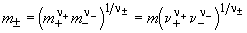
где 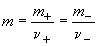
Активность электролита определяется как
Согласно закону ионной силы, коэффициенты активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от ионной силы I раствора:
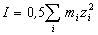
где zi — заряд иона (в единицах заряда протона), mi — его моляльная концентрация.
Согласно первому приближению теории Дебая-Хюккеля, можно рассчитать как коэффициент активности 
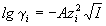
так и средний ионный коэффициент активности 

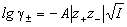
где z+ и z— заряды катиона и аниона, I — ионная сила раствора, A — константа, зависящая от диэлектрической проницаемости растворителя и температуры. Для водного раствора при 25 o C A = 0.509.
Пример 11-1. Рассчитать активность электролита a и среднюю ионную активность a 


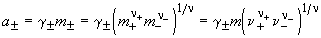
a 
a(CaCl2) = (a 
Ответ. a 
Пример 11-2. Рассчитать моляльность раствора Na2SO4. имеющего ионную силу 0.24 моль . кг -1 .
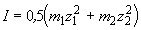
где m1 и m2 — моляльности катиона и аниона соли, равные соответственно m1 = 2m и
m2 = m, где m — моляльность раствора Na2SO4. Отсюда
0.24 = 0.5 (2m . 1 2 + m . 2 2 )
m = 0.08 моль . кг -1 .
Ответ. m = 0.08 моль . кг -1 .
Пример 11-3. Растворимость AgCl в воде при 25 o C равна 1.274 . 10 -5 моль . кг -1 . Рассчитать: а) стандартную энергию Гиббса для реакции AgCl(тв) 
Решение. а) Константа равновесия для реакции AgCl(тв) 
K = a(Ag + ) . a(Cl — ) . = 

Ионная сила раствора
I = m = 1.274 . 10 -5 моль . кг -1 .
lg 



K = 0.996 2 (1.274 . 10 -5 ) 2 = 1.61 . 10 -10

б) Ионная сила 0.020 моль . кг -1 раствора K2SO4
I = 0.5 (2 0.020 1 2 + 0.020 2 2 ) = 0.060 моль . кг -1 .
lg 



m = K 0.5 / 

11-1. Водный раствор, содержащий 0.225 моль . кг -1 NaOH, замерзает при -0.667 o C. Определить кажущуюся степень диссоциации NaOH в этом растворе, если криоскопическая константа воды равна 1.86. (ответ)
11-2. Осмотическое давление крови составляет 0.811 МПа. Какова должна быть концентрация раствора NaCl, чтобы он был изотоничен с кровью . Принять степень диссоциации NaCl равной 0.950. (ответ)
11-3. Водные растворы сахарозы и KNO3 изотоничны при концентрациях 1.00 и 0.60 моль . л -1 соответственно. Найти кажущуюся степень диссоциации KNO3 в растворе. (ответ)
11-4. Вывести выражения для активности NaCl, CaCl2. CuSO4 и LaCl3 через их моляльности m и средние ионные коэффициенты активности 

11-5. Средний ионный коэффициент активности 0.1 M водного раствора HCl при 25 o C равен 0.796. Рассчитать активность HCl в этом растворе. (ответ)
11-6. Средний ионный коэффициент активности 0.1 M водного раствора H2SO4 при 25 o C равен 0.265. Рассчитать активность H2SO4 в растворе. (ответ)
11-7. Рассчитать активность электролита a и среднюю ионную активность a 


11-8. Рассчитать ионную силу раствора, содержащего 0.10 моль . кг -1 KCl и 0.20 моль . кг -1 CuSO4. (ответ)
11-9. Рассчитать ионную силу раствора, содержащего 0.040 моль . кг -1 K3[Fe(CN)6], 0.030 моль . кг -1 KCl и 0.050 моль . кг -1 NaBr.(ответ)
11-10. Рассчитать моляльность раствора Al(NO3)3. имеющего ионную силу 0.30 моль . кг -1 . (ответ)
11-11. Раствор NaNO3 имеет ионную силу 0.30 моль . кг -1 . Чему равна моляльность раствора Al2(SO4)3. имеющего такую же ионную силу . (ответ)
11-12. Чему равна моляльность раствора Na3PO4. имеющего такую же ионную силу, как 0.36 моль . кг -1 раствор KCl? (ответ)
11-13. Рассчитать массу Ca(NO3)2, которую нужно добавить к 0.150 моль . кг -1 раствору K NO3, содержащему 500 г воды, чтобы увеличить его ионную силу до 0.250 моль . кг -1 . (ответ)
11-14. Используя первое приближение теории Дебая-Хюккеля, рассчитать коэффициенты активности ионов K + , Al 3+ и SO4 2- в 1.0 . 10 -3 моль . л -1 растворе KAl(SO4)2 при 25 o C. (ответ)
11-15. Используя первое приближение теории Дебая-Хюккеля, рассчитать коэффициенты активности ионов Ca 2+ , Cl — и средний ионный коэффициент активности в 0.002 моль . л -1 растворе CaCl2 при 25 o C. (ответ)
11-16. Используя первое приближение теории Дебая-Хюккеля, рассчитать коэффициенты активности ионов Ca 2+ , SO4 2- и средний ионный коэффициент активности в 0.001 моль . л -1 растворе CaSO4 при 25 o C. (ответ)
11-17. Константа диссоциации уксусной кислоты при 25 o C равна 1.75 . 10 -5 моль . л -1 . Используя первое приближение теории Дебая-Хюккеля, рассчитать степень диссоциации кислоты, если ее моляльность равна 0.100 моль . кг -1 . (ответ)
11-18. Средний ионный коэффициент активности в 0.500 моль . кг -1 водном растворе LaCl3 при 25 o C равен 0.303. Какова ошибка в определении этой величины по первому приближению теории Дебая-Хюккеля?(ответ)
11-19. Растворимость Ag2CrO4 в воде при 25 o C равна 8.00 . 10 -5 моль . л -1. а в 0.04 моль . л -1 растворе NaNO3 8.00 . 10 -5 моль . л -1 . Рассчитать средний ионный коэффициент активности Ag2CrO4 в 0.04 моль . л -1 растворе NaNO3. (ответ)
11-20. Растворимость AgCl в воде при 25 o C равна 1.31 . 10 -5 моль . л -1 . Рассчитать растворимость AgCl в 0.1 моль . кг -1 водном растворе KCl, в котором 



Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Видео:Ионная сила раствора. Теория (кратко) + задача.Скачать

Определение средних ионных коэффициентов активности
Методом ЭДС можно определить средние ионные коэффициенты активности. Причем часто это необходимо сделать при температуре, отличной от 298 К. Поступают следующим образом. Составляют гальванический элемент без переноса, например, такой:
Проводят серию опытов, в которых измеряют ЭДС такого гальванического элемента, но концентрация электролита в каждом опыте разная. Эта концентрация задается исследователем, т. е. она известна. Например, ЭДС (Е, В) указанного гальванического элемента была измерена при температуре 313 К в серии опытов с различными значениями концентрации соляной кислоты сНС1, моль/л.
Как найти по этим данным величину среднего ионного коэффициента активности в растворе соляной кислоты какой-либо концентрации, например 0,023 моль/л.
При температуре 313 К в справочниках нет данных о значениях стандартных электродных потенциалов, поэтому величину стандартной ЭДС необходимо находить графически.
Уравнение Нернста для итоговой реакции, протекающей в данном гальваническом элементе, будет иметь вид (1.14).
Запишем уравнение в виде, удобном для дальнейших расчетов:
Слева в уравнении (1.24) находятся заданные по условию эксперимента (сна) и измеренные в эксперименте величины (Е). То, что расположено справа в уравнении, содержит две неизвестные величины — стандартную ЭДС (Е°) и средний ионный коэффициент активности в растворе хлорида водорода, который и нужно определить (у* НС|).
Существует способ, который позволяет в определенных условиях сделать в правой части уравнения не две неизвестные величины, а одну. Если рассмотреть такое состояние, при котором средний ионный коэффициент активности в растворе электролита можно принять равным единице, то логарифм его будет равен нулю и тогда в правой части уравнения будет только одна неизвестная — стандартная ЭДС гальванического элемента при температуре исследования.
Известно, что средние ионные коэффициенты активности стремятся к единице в сильноразбавленных растворах, когда концентрация равна 0. Как это следует из предельного закона теории Дебая — Хюккеля, логарифм среднего ионного коэффициента активности пропорционален корню квадратному из величины ионной силы раствора (или корню квадратному концентрации электролита). Именно поэтому при графическом методе нахождения стандартной ЭДС гальванического элемента строят зависимость левой части уравнения (1.24) от корня квадратного из концентрации раствора электролита (рис. 1.8).
Нанеся экспериментальные значения Е-—1псНС1 при раз-
ных значениях yjcHa на график, получают зависимость, которую затем экстраполируют на нулевое значение ^сИС|. Так находят стандартную ЭДС гальванического элемента при температуре, отличной от 298 К.
Затем возвращаются к уравнению (1.24). Вычисляют -Jcucl (т. е. корень квадратный из концентрации, при которой нужно найти средний ионный коэффициент активности, — точка а на рис. 1.8).
По графику определяют значение Е н—1псНС1 ( точка Ь). Зная Е°,
по уравнению (1.24) нетрудно рассчитать и требуемую величину среднего ионного коэффициента активности.
Для сравнения определенных экспериментально средних ионных коэффициентов активности с рассчитанными по теории Дебая — Хюккеля воспользуемся формулами предельного закона теории и второго приближения этой теории.
В случае предельного закона теории Дебая — Хюккеля
где z+, z_ — заряды катиона и аниона; / — ионная сила раствора; h — константа, зависящая от диэлектрической проницаемости растворителя и температуры.
Для водных растворов при разных температурах величина константы h равна:
температура, К 298 303 313 323
константа/г, (л/моль) 0 ‘ 5 0,512 0,517 0,528 0,539
Уравнение (1.26) справедливо до ионной силы 0,01 моль/л.
Второе приближение теории Дебая — Хюккеля выражается следующим уравнением:
где а — расстояние наибольшего сближения электрических центров ионов; В — эмпирический параметр, зависящий от температуры. Для водного раствора при 298 К В = 3,29 • 10 9 м _| • моль 4 *- 5 • кг 0 — 5 .
Если принять расстояние наибольшего сближения равным а = 0,304 нм, то можно вычислить средние коэффициенты активности по уравнению Гюнтельберга:
Уравнение (1.27) справедливо до ионной силы 0,1 моль/л.
Видео:Активность раствора и Коэффициент активности. В чем отличие от концентрации раствора.Скачать

РАСЧЕТ КОЭФФИЦИЕНТА АКТИВНОСТИ ПО ДЕБДШ И ХЮККЕЛЮ
В теории Дебая и Хюккеля расчет коэффициента активности данного сорта ионов базируется на следующих основных положениях.
Во-первых, принимается, что между ионами действуют только чисто электростатические (кулоновские) силы. Данное предположение оправдано для разбавленных растворов, поскольку кулоновские силы наиболее дальнодействующие и на больших расстояниях всеми другими видами взаимодействий между ионами можно пренебречь. В первоначальной теории ионы рассматривались как существующие в несольватированном виде. Это допущение не является справедливым, ибо в растворе каждый ион сольватирован и ион-дипольное взаимодействие между молекулами растворителя и ионом в не очень концентрированных растворах не зависит от концентрации. Поэтому вслед за Робинсоном и Стоксом правильно считать, что все дальнейшие расчеты относятся к ионам сольватированным.
Далее, в теории Дебая и Хюккеля принято, что число ионов в единице объема прямо пропорционально концентрации электролита, т. е. что при всех концентрациях электролит полностью диссоциирован. Если же диссоциация электролита неполная или ионы взаимодействуют с образованием нейтральных ионных пар, то в расчетных формулах должна фигурировать только концентрация электролита, распавшегося на ионы. При расчете кулоновского взаимодействия между ионами Дебай и Хюккель полагают, что в разбавленных растворах можно пользоваться значением диэлек- трической проницаемости чистого растворителя. Между тем, вблизи ионов молекулы растворителя ориентированы и, следовательно, диэлектрическая проницаемость такого структурированного слоя растворителя отличается от диэлектрической проницаемости того же растворителя с беспорядочным расположением молекул. Поэтому использование значения диэлектрической проницаемости чистого растворителя будет оправдано только для разбавленных растворов, когда вклад толщины структурированных слоев вокруг ионов в расстояние между ними незначителен.
В очень разбавленных растворах, когда центры ионов находятся друг от друга на столь больших расстояниях, что радиусом ионов можно пренебречь по сравнению с межионным расстоянием, ионы можно рассматривать как геометрические точки, несущие на себе электрический заряд.
Определение величины взаимодействия между ионами Дебай и Хюккель проводят на основе кристаллоподобной модели раствора электролита. Как в ионном кристалле вокруг любого произвольно выбранного положительно или отрицательно заряженного и имеется избыток ионов противоположного знака, так и в растворе вокруг любого выбранного (так называемого центрального) и имеется избыток ионов противоположного знака, образующих ионную атмосферу или ионное облако. В среднем заряд ионной атмосферы равен заряду центрального иона и по знаку противоположен ему. Однако ионное облако не является статическим образованием. Его нужно рассматривать как динамическое образование подвижных ионов, часть которых в каждую единицу времени покидает ионную атмосферу, заменяясь другими ионами. Но процесс этот происходит так, что суммарный электрический заряд ионного облака в среднем равен и противоположен знаку заряда центрального иона, т. е. в ионном облаке сохраняется избыток ионов, противоположных по знаку заряда центральному иону. Если центральный ион имеет валентность, скажем, +1, то суммарный избыточный заряд ионной атмосферы должен быть равен заряду электрона.
Такой заряд можно представить равномерно размытым по всему объему ионной атмосферы, если считать, что ионы ионной атмосферы участвуют в создании заряда ионного облака вокруг данного центрального иона только частью своих зарядов. Другая часть зарядов образует заряды ионных облаков вокруг других центральных ионов. Ведь на самом деле каждый ион, выбранный нами за центральный, в свою очередь включается в ионные облака других ионов, и все ионы в растворе в отношении своего центрального положения равноценны.
Расчет коэффициента активности по Дебаю и Хюккелю включает несколько этапов:
1. Определение плотности электрического заряда ионной атмосферы и ее связи с потенциалом ионной атмосферы.
2. Установление связи между потенциалом ионной атмосферы ее радиусом.
3. Расчет электрической работы образования ионной атмосферы
4. Установление связи между работой образования ионной
атмосферы и коэффициентом активности данного сорта ионов.
5. Вывод формулы для среднего ионного коэффициента активности.
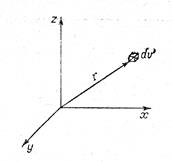
На первом этапе расчета выберем начало координат, coвпадающее с положением центрального иона, и определим плотность электрического заряда в каком-нибудь бесконечно малом o6ъеме dv ионной атмосферы на расстоянии rот центрального иона (рис. 3.6). Введем обозначения:
ni — число ионов i-гo сорта в 1 м 3 раствора;
zi — заряд ионов i-го сорта с учетом их знака;
е — заряд электрона;
ψ — средний потенциал в объеме dv;
k — постоянная Больцмана; k = R/N, где R — газовая постоянная, а N — число молекул в моле (число Авогадро);
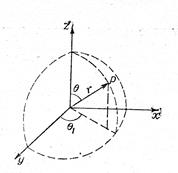
Рис. 3.6. Схема для расчета плотности заряда ионной атмосферы. Рис. Рис. 3.7. Положение точки Р в сферических координатах.
ε — диэлектрическая проницаемость растворителя;
ε0 — диэлектрическая проницаемость вакуума.
Для определения числа ионов i-гo сорта в объеме dv Дебай и Хюккель используют формулу Больцмана
в которой 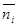
Для рассматриваемого случая формулу Больцмана записываем так:
Электрический заряд i-го сорта ионов в объеме dv будет
а в единице объема:
Для электролита или для смеси электролитов нужно произвести суммирование по всем сортам ионов с учетом знаков их заряда:
Чтобы в дальнейшем получить достаточно простое решение, приемлемое для разбавленных растворов, когда eziψ 2 ψ / ∂θ1 2 = 0, и
Подставим в уравнение Пуассона вместо ρ его выражение:
Умножим и разделим выражение в правой части на два и введем обозначение:
Для решения этого уравнения сперва продифференцируем по r выражение в скобках:
Введем теперь новую переменную ψr = Y и определим вторую производную Y по r:
и
Сравнивая это выражение с предыдущим, получим:
Из этого уравнения У определяется в виде
Так как Y= ψr, то
В этих уравнениях A1 и A2 — постоянные интегрирования. Константу A2 определяем из граничного условия, отвечающего r → ∞. Потенциал ψ при этом стремится к нулю, так как силы взаимодействия зарядов центрального иона и ионов в объеме dv с ростом r все более и более ослабевают. Это может быть лишь тогда, когда в уравнении для потенциала оба члена правой части стремятся к нулю при r → ∞. Первый член действительно стремится к нулю при r → ∞, так как при этом e –χ r уменьшается быстрее, чем растет r. Второй же член уравнения не стремится к нулю при r → ∞, поскольку e χr растет быстрее, чем r. Следовательно, он может превратиться в нуль только если a2= 0. Таким образом:
Константу А1определяем из граничного условия, отвечающего r → 0. При r → 0 выражение e – χr стремится к единице и
Но при этом граничном условии потенциал в непосредственной близости от центрального иона определяется только им, а потенциал ионной атмосферы стремится к нулю.
Выражение для потенциала на расстоянии г найдем из следующих соображений. Поскольку потенциал в данной точке это работа удаления W единичного заряда из данной точки в бесконечность, то
где fK — сила взаимодействия по закону Кулона, равная
(второй заряд единичный).
Из этих выражений:
Сравнив данную формулу с выражением ψ = A1 / rполучим:
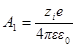
Переписав выражение для потенциала в виде
Разложим экспоненту в ряд
и ограничимся двумя первыми членами. Это ограничение, справед-ливо только для разбавленных растворов, когда χr 3 радиус ионной атмосферы
Таблица 3.2. Расчетные значения радиуса ионной атмосферы 1 / χ
| Тип валентности | Примеры | (1 / χ) ∙ 10 10 (м) при концентрации (кмоль / м 3 ) | |||
| 1,0 | 0,1 | 0,01 | 0,001 | 0,0001 | |
| 1—1 | KCl | 3,0 | 9,6 | 30,5 | 96,4 |
| 1—2; 2—1 | H2SO4, MgCl2 | 1,8 | 5,6 | 19,3 | 55,8 |
| 2—2 | ZnSO4 | 1,5 | 4,8 | 15,3 | 48,2 |
| 1-3; 3-1 | K3Fe(CN)6, LaCl3 | 1,2 | 3,9 | 13,6 | 39,4 |
превышает радиус иона на порядок и больше, то при концентрациях 0,1 кмоль/м 3 и выше радиус ионной атмосферы становится уже соизмеримым с радиусом иона и даже меньше его, что физически невероятно. Правдоподобные значения 1 / χ получаются для водных растворов 1 — 1 -валентных электролитов при концентрациях, меньших 0,01 кмоль/м 3 . Для электролитов с ионами более высоких валентностей этот предел концентраций еще ниже.
Перейдем теперь к расчету собственно межионного взаимодействия. Расчет в теории Дебая и Хюккеля проводится на основе следующего мысленного эксперимента. Допустим, что все ионы в растворе в какой-то момент времени лишены электрических зарядов и с этого момента мы начинаем их заряжать непрерывно, подводя к ним по определенной доле λ их полного заряда zie. В каждый заданный момент времени ионы обладают одинаковой долей λ, их конечного заряда, и потенциал, создаваемый центральным ионом в этот момент, согласно уравнению для потенциала, будет равен:
Здесь χλ – радиус ионной атмосферы при заряде иона zieλ,
т. е. χλ = λχ . Следовательно
При увеличении заряда иона на dλпроизводится электрическая работа dWэ, равная
Полная работа заряжения одного иона составит
Если в единице объема (1 м 3 ) содержится ni ионов каждого сорта, то электрическая работа заряжения одного сорта ионов будет
а суммарная электрическая работа заряжения всех сортов ионов в этом объеме составит:
Когда отсутствует ионная атмосфера, т. е. χ = 0, раствор находится в идеальном состоянии, и выражение для общей электрической работы заряжения ионов, находящихся в идеальном состоянии, будет иметь вид:
Работа Wэ, расходуемая на заряжение ионной атмосферы, равна Wэ.с – Wэ.ид; для достаточно разбавленных растворов, для которых диэлектрическая проницаемость практически равна диэлектрической проницаемости растворителя, будем иметь:
Подставив, как и раньше, вместо ni значение CiN∙10 3 и умно- жив числитель и знаменатель на два, получим:
На основании значений электрической работы заряжения ионной атмосферы можно получить выражение для коэффициента активности данного сорта ионов, а затем и среднего ионного коэффициента активности электролита.
разность химических потенциалов μi ид – μi реальн должна равняться изотермической и обратимой работе образования ионной атмосферы, поскольку по теории Дебая — Хюккеля отклонение реального раствора от идеального связано только с электростатическим взаимодействием между ионами. Поэтому
или, учитывая уравнение для электрической работы заряжения
Чтобы решить это уравнение, продифференцируем сперва уравнение характеристической длины по ni
Производная суммы равна zi 2 ,так как все остальные члены суммы от ni не зависят. Следовательно
Умножив и разделив правую часть на ∑nizi 2 , можно написать
Для логарифма коэффициента активности, таким образом, получаем:
Не следует забывать,что γi в теории Дебая и Хюккеля отличается от γi по Льюису, поскольку в этой теории учитываются только кулоновские силы взаимодействия между ионами и в случае неполной диссоциации соли нужно вводить поправку на долю диссоциированных молекул.
Подставив в выражение для ln γi значение характеристической длины, получим
называется ионной силой или ионной крепостью раствора.
Вынесем в уравнении для ln γi универсальные постоянные в общую константу
а если ε и T постоянны, то после перехода к десятичным логарифмам имеем:
Перейдем теперь к выводу формулы для среднего ионного коэффициента активности. Для этого прологарифмируем уравнение, определяющее γ±:
Напишем выражения для γ+ и γ–
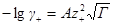
и подставим их в предыдущее уравнение:
Преобразуем выражение в скобках, помня, что из условия электронейтральности ν+z+ = – ν–z–. Минус здесь получился из-за того, что валентность отрицательного иона ранее была принята отрицательной. Тогда
В литературе можно часто встретить эту формулу со знаком минус перед логарифмом среднего ионного коэффициента активности. Это получается в том случае, если при выводе формулы пользуются абсолютными значениями z+ и z–. Тогда
и конечный результат будет тем же.
Полное выражение для среднего ионного коэффициента актив-
ности будет:
Для водного раствора и стандартной температуры 25 °С после подстановки в это уравнение величин: е= 1,602∙10 –19 Кл, N = 6,022∙10 23 моль –1 ; R = 8,314 Дж/(моль∙К); εε0 = 78,3∙0,885∙10 –11 Ф/м, получим:
где А =0,51 (м 3 /кмоль) 1/2 .
Это уравнение называется уравнением первого приближения теории Дебая и Хюккеля для коэффициента активности, поскольку оно выведено в наиболее упрощенном приближении к истинной картине взаимодействий в растворе электролита. Можно ожидать, что уравнение будет удовлетворительно описывать поведение растворов электролитов при очень низких концентрациях.
Замечательной особенностью уравнения первого приближения теории Дебая и Хюккеля является отсутствие в нем каких-либо эмпирических постоянных и «подгоночных параметров». Этим уравнением также обосновывается эмпирически установленное ранее правило ионной силы Льюиса и Рендалла, согласно которому:
Во всех очень разбавленных растворах электролитов при равной ионной силе средние ионные коэффициенты активности электролитов одного и того же типа валентности численно одинаковы.
Это правило непосредственно вытекает из формулы первого приближения, поскольку Г = const; z+z– = const и lg γ± = const, ибо все остальные величины, входящие в уравнение Дебая и Хюккеля, являются универсальными постоянными.
В более концентрированных растворах нельзя уже считать ионы геометрическими точками. В связи с этим во втором приближении теории Дебая и Хюккеля вводится предположение, согласно которому ион представляет собой шар радиусом а, в центре которого находится заряд, равный заряду иона. Это предположение физически ближе всего подходит к точечным сольватированным ионам и то, если допустить, что диэлектрическая проницаемость сольват-ного слоя такая же, как и всей массы растворителя.
Радиус а иона является индивидуальной величиной для каждого сорта ионов, и его нельзя определить расчетом или из независимого эксперимента. Фактически это постоянная величина, которую подбирают таким образом, чтобы расчет коэффициента активности по формуле соответствовал бы эксперименту. Кроме того, выше сказано, что во втором приближении теории Дебая и Хюккеля ионы рассматриваются как точечные, окруженные соль-ватной оболочкой и, следовательно, понятие радиуса иона не является вполне строгим.
И, наконец, как это будет ясно из дальнейшего, величина а оказывается одной и той же для всех сортов ионов в данном элек- тролите или в данной смеси электролитов. Таким образом, а — это фактически какая-то средняя величина. Поэтому величину а часто определяют как кажущийся радиус иона или усредненную половину расстояния, на которое максимально могут приблизиться друг, и другу центры ионов.
Уравнение для коэффициента активности выводится аналогии но выводу в первом приближении теории Дебая и Хюккеля, однако определение константы А1сложнее, чем в первом случае, поскольку мы не имеем возможности использовать граничное условие, отвечающее r →0.
Как и раньше, представим себе ион радиуса а, окруженный ионной атмосферой радиусом 1 / χ. Необходимо определить потенциал на поверхности шаровой сферы. Он будет определяться, с одной стороны, зарядом центрального иона и, с другой, — зарядом ионной атмосферы. Потенциал, определяемый зарядом центрального иона, как и раньше, будет ezi / 4πεε0r. Потенциал же ионной атмосферы на расстоянии r от центра обозначим через ψ (r). Тогда
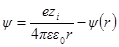
Подставим вместо ψ величину из формулы 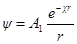
Продифференцируем теперь это уравнение по r: производная первого члена уравнения
Значения производных первого и второго членов уравнения при r = а должны быть равны друг другу, а это значит, что ∂ ψ (r) / ∂r при r = а должно быть равно нулю. Следовательно, можно получить константу А1в виде:
Подставив теперь А1в формулу для ψ (r) при r = а, получим:
Сравнивая это выражение с аналогичным выражением первого приближения, видим, что учет радиуса иона приводит к отличию величины потенциала ионной атмосферы на выражение 1 / (χa + 1).
Для расчета межиониого взаимодействия проведем, как и раньше, мысленный опыт непрерывного и обратимого заряжения всех ионов от заряда, равного нулю, до заряда, равного полному заряду ezi. В каждый данный момент потенциал ионов будет равен λ-й доле полного потенциала, т. е. ψλ = λψ и χλ = λχ. Тогда:
При увеличении заряда на dλпроизводится электрическая работа
Интегрирование этого уравнения от λ = 0 до λ = 1 дает полную энергию заряжения одного иона. Если ni — число ионов каждого сорта в единице объема, то полная работа образования ионной ат-мосферы составит:
Как и раньше, первый член уравнения дает работу заряжения для идеального случая, а второй — работу образования ионной атмосферы.
Производная Wэпо числу ионов i-гo сорта равняется:
Второй член правой части этого уравнения можно представить в виде:
Но ранее показано, что
Обозначим: х = aχ; ζ = χaλ, откуда λ = ζ / χa; dx = adχ; dζ = aχdλ. Тогда выражение под интегралом переписывается так:
Подставив его в выражение для ∂W / ∂ni, получим:
Выражение в квадратных скобках равно 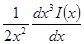

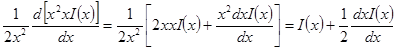
Но как получено ранее
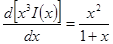
В случае очень разбавленных растворов, когда χ мало и aχ 10 (εТ) –1/2 = = 0,328∙10 10 м –1 (м 3 /кмоль) 1/2 . По физическому смыслу знаменатель в уравнении коэффициента активности учитывает короткодействующие силы между ионами, которые представляются как недеформируемые шары. Величины А и В изменяются при изменении природы растворителя, в то время как а остается приблизительно постоянной.
Значения параметра а определяют из экспериментальных данных по зависимости коэффициента активности от концентрации. Преобразовывая уравнение для коэффициента активности, получим:
В соответствии с этим уравнением величина lg γ± / 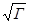
Катионы а, нм Анионы а, нм
H + 0,9 F – , Cl – , Br – , I – , CN – , 0,3
Li + 0,6 NO2 – , NO3 – , OH – , CNS –
Rb + , Cs + , NH4 + , Tl + , Ag + 0,25 CO3 2– , SO3 2– 0,5
Mg 2+ , Be 2+ 0,8 PO4 3– , Fe(CN)6 3– 0,4
Ca 2+ , Cu 2+ , Zn 2+ , Sn 2+ , 0,6
Mn 2+ , Fe 2+ , Ni 2+ , Co 2+
Pb 2+ , Sr 2+ , Ba 2+ , Ra 2+ , 0,5
Fe 3+ , Al 3+ , Cr 3+ , Sc 3+ , 0,9
Y 3+ , La 3+ , In 3+ , Ce 3+
Приведенные значения параметра а позволяют рассчитывать коэффициенты активности электролитов до ионной силы 0,1—0,2. Однако наиболее хорошего совпадения с экспериментальными результатами удается достигнуть, если для каждой концентрации использовать свое значение а. Таким образом, величина параметра оказывается зависящей от концентрации.
Интересно отметить, что по порядку величины произведение (аВ) близко к единице, поэтому для не очень точных расчетов можно применять формулу второго приближения в виде:
Уравнение второго приближения охватывает зависимость изменения коэффициента активности от концентрации до несколько больших концентраций, чем уравнение первого приближения. Однако оно не может отразить возрастание коэффициента активности многих электролитов с ростом концентрации.
Для охвата единой формулой всей кривой изменения коэффициента активности с концентрацией Хюккель с помощью поправочного члена сГ придал формуле для коэффициента активности вид:
Это уравнение называется уравнением третьего приближения теории Дебая и Хюккеля. Коэффициент с учитывает изменение диэлектрической проницаемости с концентрацией, но он не может быть рассчитан теоретически, подобно коэффициентам А к В. Таким образом, третье приближение Дебая и Хюккеля приводит к формуле, содержащей две эмпирические постоянные, которые подбираются из соображений наилучшего соответствия рассчитанных величин экспериментально определенным.
🎥 Видео
4 1 Представления Дебая Хюккеля 4 1 Представления Дебая Хюккеля Содержание курса Analytical chemСкачать

Лекция 15 Предельный закон Дебая ГюккеляСкачать

Физическая химия 2 Электрохимия — Лекция 3 — Межионное взаимодействие, Теория Дебая-Хюккеля (начало)Скачать

Физическая химия 2 Электрохимия — Лекция 5 — Теория Дебая-Хюккеля (окончание), Неравновесные явленияСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Коэффициент вариации – пример расчетаСкачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

сильные и слабые электролиты РАСЧЕТ рНСкачать

Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – ПростоСкачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

Шеховцова Т.Н. - Аналитическая химия - Химическое равновесие. Титриметрические методы анализаСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

25. Схема реакции и химическое уравнениеСкачать