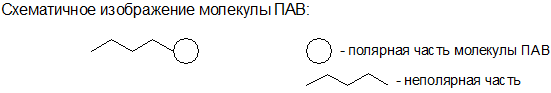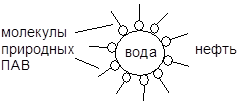Электролиз по Кольбе – это электролиз растворов солей карбоновых кислот. В ходе реакции образуются соответствующие алканы.
Например, рассмотрим электролиз водного раствора ацетата натрия CH3COONa. В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO – + Na +
При этом на катод притягиваются катионы натрия Na + и молекулы воды H2O. Восстанавливаться на катоде будут молекулы воды, т.к. окислительные свойства ионов водорода превышают окислительные свойства катионов щелочных металлов:
K(-): 2H2O + 2e = H2 + 2OH –
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы. При этом от карбоксильной группы остаются метильные радикалы, которые образуют газообразный этан.
A(+): 2CH3COO – — 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
В общем виде получается:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
То есть при электролизе раствора пропионата натрия образуется бутан:
Видео:Гидролиз ацетата натрияСкачать

Уравнение ацетата натрия и фенолфталеина

Уксусная кислота – слабый электролит. Ацетат натрия – соль образованная сильным основанием и слабой кислотой. При растворении этой соли в воде создается щелочная среда. Особенностью кристаллогидрата ацетата натрия является то, что он при нагревании легко плавится и ацетат натрия растворяется в своей кристаллизационной воде. Смешает ацетат натрия с сухим индикатором фенолфталеином. Полученную смесь нагреем. Появляется малиновая окраска. Соль частично расплавилась, в расплаве появились гидроксид- ионы.
При охлаждении соль кристаллизуется, равновесие смещается в сторону образования ацетата натрия, гидроксид-илны исчезают, и окраска пропадает. Опыт доказывает, что уксусная кислота является слабой кислотой.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Видео:"Горячий лёд" - эксперимент и получение ацетата натрия!Скачать

Опыт 2. Влияние температуры на равновесие реакции обратимого гидролиза ацетата натрия
В основе опыта лежит реакция гидролиза ацетата натрия:
В этой обратимой реакции прямая реакция – гидролиз соли, обратная – нейтрализация. При смещении равновесия в сторону гидролиза образуется сильное основание, присутствие которого может быть установлено малиновым окрашиванием фенолфталеина, добавляемого в реакционную систему в качестве кислотно-основного индикатора.
Реактивы: 0,1 Н раствор ацетата натрия, спиртовый раствор фенолфталеина.
Посуда и принадлежности:пробирки, спиртовка, спички, держатель для пробирок.
Методика проведения опыта. Налейте в пробирку 3-4 мл раствора ацетата натрия и добавьте 1-2 капли раствора фенолфталеина. Нагрейте жидкость до кипения. В наблюдениях отметьте окраску раствора до и после нагревания. Охладите пробирку. Отметьте, изменился ли цвет жидкости в пробирке после охлаждения. Объясните, почему окраска фенолфталеина изменяется при нагревании и охлаждении.
Напишите выражение константы равновесия для данной реакции.
В выводах укажите:
– с какими тепловыми эффектами протекают прямая и обратная реакции и почему;
– каково направление смещения химического равновесия в данной реакции при повышении температуры и что является причиной этого.
Опыт 3. Влияние температуры на обратимую реакцию и установление термохимического типа прямой и обратной реакции (УИРС)
При действии раствора иода на крахмал образуется комплексное соединение – иодкрахмал, имеющий характерное синее окрашивание:
соединение окраска окраска
Реактивы: раствор иода в воде (c желтой окраской средней интенсивности), свежеприготовленный крахмальный клейстер (приготовить суспензию из 0,5 г крахмала в 10 мл холодной воды, вылить ее в 150 мл горячей воды и довести до кипения).
Посуда и принадлежности:пробирки, спиртовка, спички, держатель для пробирок.
Методика проведения опыта. Налейте в пробирку 2-3 мл раствора крахмального клейстера, добавьте несколько капель раствора иода. Отметьте и запишите в графе «Наблюдения» окраску полученного раствора. Нагрейте пробирку на спиртовке. Отметьте изменение окраски. Пробирку охладите под струей воды из-под крана. Отметьте, что происходит с окраской раствора при охлаждении.
В выводах укажите направления смещения химического равновесия в данной обратимой реакции соответственно при повышении и понижении температуры, а также знаки тепловых эффектов прямой и обратной реакций. Объясните причины этого.
Тема 4. Гетерогенные химические системы и поверхностные явления в них (спецраздел с элементами УИРС) (базовый материал)
Рекомендуемая литература по теме 4 приведена на с. 30.
Гетерогенные химические системы (ГХС) состоят из нескольких фаз.
Фаза – это часть ГХС, однородная по химическому составу и агрегатному состоянию во всех своих точках и отделенная от других частей системы границей раздела (межфазной поверхностью).
Гетерогенные химические системы бывают со сплошными границами раздела фаз (например, жидкость в емкости в контакте с воздухом), а могут быть дисперсными.
Дисперсные ГХС – гетерогенные системы, в которых частицы одной фазы, называемой дисперсной, находятся в раздробленном (диспергированном) состоянии и равномерно распределены между частицами другой фазы, называемой дисперсионной средой. Например, сырая нефть – это гетерогенная дисперсная система (ГДС). В ней диспергированные частицы природной воды, горных пород, газов равномерно распределены между частицами углеводородной дисперсионной среды. Эта система стабилизирована вследствие действия имеющихся в ней природных (нефтяных) поверхностно-активных веществ (ПАВ). В отличие от гомогенных дисперсных систем (истинных растворов), размеры частиц дисперсной фазы в гетерогенных дисперсных системах (ГДС) превышают ионно-молекулярный уровень.
Природа веществ, образующих фазы, различна, поэтому на межфазной поверхности (МП) возникают нескомпенсированные молекулярные силы и, как результат, избыточная поверхностная энергия Гиббса:
DGпов = s . S, кДж,
где S (м 2 ) – суммарная площадь поверхности раздела фаз, s (кДж/м 2 ) – удельная поверхностная энергия Гиббса, т.е. приходящаяся на единицу поверхности раздела фаз. Для систем с конденсированными фазами s называют поверхностным натяжением.
Стремление ГХС уменьшить значение DGпов обусловливает возникновение в них поверхностных явлений: смачивание, адгезия, сорбция (адсорбция или абсорбция), а в гетерогенных дисперсных системах еще возникает агрегация и коагуляция.
Смачивание – это межмолекулярное взаимодействие на границе раздела фаз между веществами двух конденсированных фаз (жидкость – жидкость или твердое тело – жидкость), находящихся в контакте с газовой фазой. Полное (растекание) или частичное смачивание поверхности одной фазы веществом другой фазы оказывается возможным только если эти вещества способны к какому-либо межмолекулярному взаимодействию (силы Ван-дер-Ваальса, водородные связи и др.).
Адгезия – это смачивание, завершаемое прилипанием одной фазы к поверхности другой фазы.
Когезия – это взаимодействие между частицами вещества внутри одной фазы.
Адсорбция – это концентрирование вещества, растворенного в одной фазе (эта фаза представляет собой истинный раствор), на поверхности другой фазы, т.е. на границе раздела фаз. Вещество, которое адсорбируется – адсорбат; вещество, на поверхности которого происходит адсорбция – адсорбент. Процесс адсорбции обратим и достигает состояния равновесия. Обратный процесс – десорбция.
В основе адсорбции лежит тот или иной вид межмолекулярного взаимодействия между адсорбатом и адсорбентом на границе раздела фаз. Существует правило: подобное адсорбируется на подобном, т.е. полярные вещества адсорбируются на полярных адсорбентах и наоборот.
Смачивание и адсорбция приводят к частичной компенсации нескомпенсированных молекулярных сил на границе раздела фаз и в результате – к снижению удельной поверхностной энергии s, а, следовательно, и к уменьшению DGпов.
Особую роль играет адсорбция поверхностно-активных веществ (ПАВ). Молекулы ПАВ дифильны, они в своей структуре имеют одновременно неполярный гидрофобный фрагмент и полярный гидрофильный фрагмент. Благодаря такому строению молекулы ПАВ могут адсорбироваться на любой межфазной поверхности: полярной частью на полярной поверхности, а неполярной частью на неполярной поверхности.
В результате адсорбции ПАВ происходит уравнивание полярностей поверхностей фаз на границе их раздела и, как результат – снижение s и DGпов.
Отличительным признаком действия ПАВ является возрастание эффекта снижения поверхностного натяжения s по мере увеличения концентрации ПАВ (т.е. степени адсорбции) на границе раздела фаз (до момента достижения равновесия).
Разновидностью ПАВ являются мыла. Мыла представляют собой растворимые соли карбоновых кислот с числом атомов углерода С14-С20. Такие кислоты образуются при гидролизе жиров, поэтому им дали название «жирные кислоты». Мыла ROO — M + (M + = Na + , K + ; R – углеводородный остаток) представляют собой водорастворимые анионактивные ПАВ, т.к. при их диссоциации в воде образуется поверхностно-активный анион ROO — :
Примером действия ПАВ является стабилизация эмульсии, образующейся из сырой нефти и воды в присутствии природных поверхностно-активных веществ:
Гетерогенные дисперсные системы (ГДС) имеют громадное множество границ раздела между частицами дисперсной фазы и дисперсионной среды. В результате этого суммарная площадь поверхности раздела фаз (S) и, следовательно, DGпов в ГДС очень значительны. Гетерогенные дисперсные системы имеют возможность самопроизвольно уменьшить величину S путем слипания или слияния частиц дисперсной фазы. Такое явление называется агрегацией. В результате укрупнения частиц дисперсной фазы их масса растет, и в какой-то момент происходит их оседание под действием сил тяжести. Такое явление называется седиментацией.
Агрегация, приводящая к седиментации и имеющая необратимый характер, называется коагуляцией. В результате коагуляции происходит разрушение ГДС.
Стабилизация ГДС может быть достигнута в результате адсорбции ПАВ или возникновения двойного электрического слоя на границах раздела частиц дисперсной фазы и дисперсионной среды. Возможность действия этих факторов определяется природой частиц фазы и среды.
В зависимости от размера частиц дисперсной фазы ГДС подразделяются на коллоидные растворы (размер частиц фазы 10 -7 – 10 -5 см) и взвеси (размер частиц фазы более 10 -5 см). Взвеси подразделяются на микрогетерогенные системы (размер частиц 10 -5 – 10 -3 см) и грубодиспер-сные системы (размер частиц 10 -3 – 1 см).
По агрегатному состоянию дисперсной фазы и дисперсионной среды ГДС подразделяются на следующие разновидности (табл. 1.8):
Таблица 1.8 – Разновидности гетерогенных дисперсных систем
| Дисперсионная среда | Дисперсная фаза | Обозначение (фаза/среда) | Название |
| Газообразная (Г) | Жидкая (Ж) Твердая (Т) | Ж/Г Т/Г | Аэрозоли |
| Жидкая (Ж1) | Газообразная (Г) Жидкая (Ж2) Твердая (Т) | Г/Ж1 Ж2/Ж1 Т/Ж1 | Жидкие пены Эмульсии Суспензии |
| Твердая (Т1) | Газообразная (Г) Жидкая (Ж) Твердая (Т2) | Г/Т1 Ж/Т1 Т2/Т1 | Твердые пены, пористые тела Капиллярные системы, твердые эмульсии Сплавы, минералы |
Рекомендуемая литература по теме 4:[1], гл. 10, §§ 10.1-10.3, 105, 108; [2], гл. 6, §§ 6.5, гл. 8, §8.7; [4], гл. 9, § 1-6.
🎬 Видео
Гидролиз ацетата натрияСкачать

Реакция фенолфталеина на гидроксид натрияСкачать

Индикаторы: ФенолфталеинСкачать

Взаимодействие уксусной кислоты с гидроксидом натрияСкачать

гидролиз ацетата натрияСкачать

ФЕНОЛФТАЛЕИН - как он работает? Что вы про него не знали?Скачать

Перенасыщение ацетатом натрияСкачать

Получение ацетата натрия двумя способами. Наблюдение разного теплового эффектаСкачать

Видеоопыты. Органика 24. Гидролиз ацетата натрияСкачать

024 Гидролих ацетата натрияСкачать

🔥КАРМАННЫЙ ОБОГРЕВАТЕЛЬ своими руками! Научный ВЛОГ #2Скачать

Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать

кристаллизация ацетата натрия. Экзотермическая реакция. горячий лёдСкачать

Опыты по химии. Реакция нейтрализацииСкачать

Электролиз раствора ацетата натрия | ЕГЭ по химииСкачать

Практическая работа № 2. Опыт 3. Реакция нейтрализации (в присутствии фенолфталеина).Скачать

Приготовление Ацетата натрия для электролита НикелированияСкачать

024 Гидролих ацетата натрияСкачать