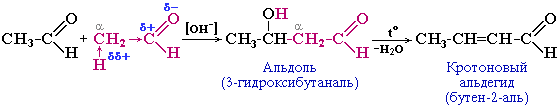Вы будете перенаправлены на Автор24
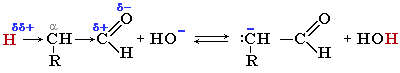
Альдегиды в щелочной среде вступают в реакции альдольной конденсации (А. Бородин, Ж. Вурц, 1872):
Сначала под действием основного катализатора — гидроксид-аниона или этоксид-аниона $C_2H_5O^-$ из альдегида образуется сопряженный анион — сильный нуклеофил, который атакует электрофильный центр карбонильной группы следующей молекулы альдегида. Полученный в результате такого взаимодействия алкоголятний анион быстро превращается в альдоль.
Так, например, две молекулы пропаналя в реакции с водными растворами гидроксидов при 0-5 $^circ$С образуют 3-гидрокси-2-метилпентаналь с 55-60% выходом, а две молекулы уксусного альдегида дают альдоль с 50%-ным выходом:
Видео:Альдольная конденсацияСкачать

Механизм альдольной конденсации катализируемой основаниями
Механизм реакций альдольной конденсации, катализируемых основаниями, включает три стадии:
На первой стадии образуются енолят-ионы. Равновесные концентрации енолят-ионов очень малы и редко превышают 1-3%, поскольку $pK_a$ альдегидов примерно равны 17-18, а для воды значение $pK_a$ равно 15,7. Присоединение енолят-ионов к карбонильным группам неионизированных молекул альдегидов на второй стадии определяет скорость всего процесса.
Готовые работы на аналогичную тему
Видео:Альдольно кротоновая конденсацияСкачать

Дегидратация альдолей
Синтезированные альдоли при нагревании, как правило, легко отщепляют воду с образованием ненасыщенных карбонильных соединений. Процесс получения ненасыщенного альдегида или кетона из альдолей называют кротоновой конденсацией, по названию альдегида, впервые полученного таким методом:
Дегидратация альдолей в $alpha, beta$-ненасыщенные альдегиды также катализируется основаниями и протекает с промежуточным образованием енолят-ионов альдолей:
Видео:АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯСкачать

Механизм альдольной конденсации катализируемой кислотами
Альдегиды способны вступать в альдольную конденсацию и в кислой сред, но остановить реакцию на стадии альдолей при этом достаточно трудно, и часто получается продукт кротоновой конденсации.
В кислых средах определяющей скорость всего процесса стадией является присоединение енолов к карбонильным группам.
В отличие от щелочного катализатора, который действует только на метиленовую компонента, при кислотном катализе наблюдается действие как на метиленовый, так и на карбонильный компонент с протонизацией атомов кислорода:
В кислых средах практически невозможно остановить процесс на стадии образования альдолей и конечными продуктами оказываются $alpha, beta$-ненасыщенные альдегиды — продукты их дегидратации.
Для протонованой метиленовой компоненты характерно отщепление $H+$ от группы $OH$ с образованием исходной карбонильной молекулы или от $alpha$-углеродного атома с образованием енола. В еноле же под влиянием $+M$-эффекта атома кислорода и $-I$-эффекта вицильной группы электронная плотность $pi$-связи смещена отгидроксильной группы, в результате чего енол реагирует далее с активированной карбонильной компонентой.
В сильнокислой среде для альдолей обычно характерна дегидратация с образованием оксида мезитила. В условиях реакции оксид мезитила реагирует с последующей молекулой карбонильного соединенния и конечным продуктом, в отличие от реакции в щелочной среде, является форон (в присутствия газообразной кислоты) или мезитилен (в присутствии концентрированной жидкой кислоты).
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Уравнение альдольной конденсации для этаналя
В молекуле альдегида или кетона на a -атоме углерода (соседнем с карбонильной группой) под влиянием карбонила понижена электронная плотность. Это вызывает поляризацию связи С a -Н и способствует отщеплению атома водорода в форме протона (H + ). В частности, происходящий под действием оснований отрыв протона от a -углеродного атома, приводит к образованию соответствующего карбаниона.
Такие карбанионы могут играть роль нуклеофилов по отношению к карбонильной группе другой молекулы альдегида или кетона. Поэтому оказываются возможными реакции, в которых одна молекула карбонильного соединения (в форме карбаниона) присоединяется к C=O-группе другого карбонильного соединения.
Например, уксусный альдегид на холоду при действии разбавленных растворов щелочей превращается в альдоль; при проведении реакции в более жестких условиях (при нагревании) альдоль дегидратируется с образованием кротонового альдегида.
Легкое отщепление воды от альдоля объясняется подвижностью водородного атома в a -звене, на которое действуют —I-эффекты двух групп (ОН и С=О).
Конденсацию альдегидов или кетонов, протекающую по первому типу, называют альдольной конденсацией, или альдольным присоединением, а по второму типу — кротоновой конденсацией.
Впервые эти реакции осуществили одновременно (1872 г.) и независимо друг от друга А.П. Бородин и Ш.А. Вюрц.
Видео:10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🔍 Видео№ 82. Органическая химия. Тема 16. Альдегиды. Часть 7. Реакции конденсации, полимеризации альдегидовСкачать  10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  Ч-1 АЛЬДОЛЬНАЯ И АЛЬДОЛЬНО-кротоновая конденсацииСкачать  Химия с нуля — АЛКИНЫ, Тройная связь, Типы Гибридизации // Органическая ХимияСкачать  карбонильные соединения. часть 4Скачать  Химия. Альдегиды и кетоныСкачать  Лекция 18Скачать  Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать  Химические свойства альдегидов и кетонов. 11 класс.Скачать  Парообразование и конденсация. 8 класс.Скачать  Конденсат Бозе - Эйнштейна: пятое агрегатное состояние веществаСкачать  Альдегиды строение, свойства | Химия 10 класс #28 | ИнфоурокСкачать  10.2. Альдегиды и кетоны: Способы получения. ЕГЭ по химииСкачать  Органическая Химия — Алканы и Цепь из АтомовСкачать  Получение альдегидов и кетонов. 11 класс.Скачать  |