При изучении поведения газов в физике много внимания уделяется изопроцессам, то есть таким переходам между состояниями системы, во время которых сохраняется один термодинамический параметр. Тем не менее, существует газовый переход между состояниями, который не является изопроцессом, но который играет важную роль в природе и технике. Речь идет об адиабатическом процессе. В данной статье рассмотрим его подробнее, акцентируя внимание на том, что такое показатель адиабаты газа.
- Адиабатический процесс
- Уравнение Пуассона для адиабаты идеального газа
- Что такое показатель адиабаты?
- Теплоемкости CP и CV
- Величина γ для газа идеального одноатомного
- Зависимость γ от числа степеней свободы
- Показатель адиабаты для смеси газов
- Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
- Кратко об идеальном газе
- Что это адиабатический процесс?
- Уравнения Пуассона для адиабатического процесса
- Пример задачи
- Новое в блогах
- Физический смысл адиабатного процесса (Часть 1 — Давление газа)
- 🌟 Видео
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Адиабатический процесс
Согласно термодинамическому определению, под адиабатическим процессом понимают такой переход между начальным и конечным состояниями системы, в результате которого не существует обмена теплом между внешней средой и изучаемой системой. Такой процесс возможен при наличии следующих двух условий:
- теплопроводность между внешней средой и системой по той или иной причине является низкой;
- скорость процесса велика, поэтому обмен теплом не успевает происходить.
В технике адиабатный переход используют как для разогрева газа при его резком сжатии, так и для его охлаждения во время быстрого расширения. В природе рассматриваемый термодинамический переход проявляет себя, когда воздушная масса поднимается или опускается по склону холма. Такие подъемы и спуски приводят к изменению точки росы в воздухе и к возникновению осадков.
Видео:29. Адиабатический процесс. Уравнение ПуассонаСкачать

Уравнение Пуассона для адиабаты идеального газа
Идеальный газ представляет собой систему, в которой частицы движутся хаотично с большими скоростями, не взаимодействуют друг с другом и являются безразмерными. Такая модель является очень простой с точки зрения ее математического описания.
Согласно определению адиабатного процесса, можно записать следующее выражение в соответствии с первым законом термодинамики:
Иными словами, газ, расширяясь или сжимаясь, совершает работу P*dV за счет соответствующего изменения своей внутренней энергии dU.
В случае идеального газа, если воспользоваться уравнением его состояния (закон Клапейрона-Менделеева), то можно получить следующее выражение:
Это равенство называется уравнением Пуассона. Люди, которые знакомы с физикой газов, заметят, что если величина γ будет равна 1, то уравнение Пуассона перейдет в закон Бойля-Мариотта (изотермический процесс). Однако такое преобразование уравнений невозможно, поскольку γ для любого типа идеального газа больше единицы. Величина γ (гамма) называется показателем адиабаты идеального газа. Рассмотрим подробнее его физический смысл.
Видео:Адиабатный процесс. 10 класс.Скачать

Что такое показатель адиабаты?
Показатель γ, который появляется в уравнении Пуассона для газа идеального, представляет собой отношение теплоемкости при постоянном давлении к аналогичной величине, но уже при постоянном объеме. В физике теплоемкостью называют величину теплоты, которую нужно передать данной системе или забрать у нее, чтобы она изменила свою температуру на 1 Кельвин. Будем обозначать символом CP изобарную теплоемкость, а символом CV — изохорную. Тогда для γ справедливо равенство:
Поскольку γ всегда больше одного, то он показывает, во сколько раз изобарная теплоемкость изучаемой газовой системы превышает аналогичную изохорную характеристику.
Видео:Физика. Термодинамика: Адиабатный процесс. Центр онлайн-обучения «Фоксфорд»Скачать

Теплоемкости CP и CV
Чтобы определить показатель адиабаты, следует хорошо понимать смысл величин CP и CV. Для этого проведем следующий мысленный эксперимент: представим, что газ находится в закрытой системе в сосуде с твердыми стенками. Если нагревать сосуд, то все сообщенное тепло в идеальном случае перейдет во внутреннюю энергию газа. В такой ситуации будет справедливо равенство:
Величина CV определяет количество теплоты, которое следует передать системе, чтобы изохорно нагреть ее на 1 К.
Теперь предположим, что газ находится в сосуде с подвижным поршнем. В процессе нагрева такой системы поршень будет перемещаться, обеспечивая поддержание постоянного давления. Поскольку энтальпия системы в таком случае будет равна произведению изобарной теплоемкости на изменение температуры, то первый закон термодинамики примет вид:
Отсюда видно, что CP>CV, так как в случае изобарного изменения состояний необходимо расходовать тепло не только на повышение температуры системы, а значит, и ее внутренней энергии, но и на выполнение газом работы при его расширении.
Видео:Адиабатное расширениеСкачать

Величина γ для газа идеального одноатомного
Самой простой газовой системой является одноатомный идеальный газ. Предположим, что мы имеет 1 моль такого газа. Напомним, что в процессе изобарного нагрева 1 моль газа всего на 1 Кельвин, он совершает работу, равную величине R. Этим символом принято обозначать универсальную газовую постоянную. Она равна 8,314 Дж/(моль*К). Применяя последнее выражение в предыдущем пункте для данного случая, получаем такое равенство:
Откуда можно определить значение изохорной теплоемкости CV:
Известно, что для одного моль одноатомного газа значение изохорной теплоемкости составляет:
Из последних двух равенств следует значение показателя адиабаты:
Отметим, что величина γ зависит исключительно от внутренних свойств самого газа (от многоатомности его молекул) и не зависит от количества вещества в системе.
Видео:Адиабатный процесс. Практическая часть. 10 классСкачать

Зависимость γ от числа степеней свободы
Выше было записано уравнение для изохорной теплоемкости одноатомного газа. Появившийся в нем коэффициент 3/2 связан с количеством степеней свободы у одного атома. У него существует возможность двигаться только в одном из трех направлений пространства, то есть существуют только поступательные степени свободы.
Если система образована двухатомными молекулами, то к трем поступательным добавляются еще две вращательные степени. Поэтому выражение для CV приобретает вид:
Тогда значение γ будет равно:
Отметим, что на самом деле существует у двухатомной молекулы еще одна колебательная степень свободы, но при температурах в несколько сотен Кельвин она не задействуется и не вносит вклад в теплоемкость.
Если молекулы газа состоят из более, чем двух атомов, тогда у них будет 6 степеней свободы. Показатель адиабаты при этом будет равен:
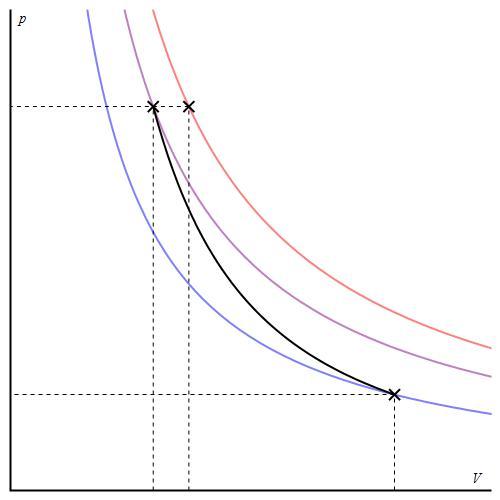
Таким образом, при увеличении числа атомов в молекуле газа величина γ уменьшается. Если построить график адиабаты в осях P-V, то можно заметить, что кривая для одноатомного газа будет вести себя более резко, чем для многоатомного.
Видео:Урок 172. Применение 1 закона термодинамики для различных процессовСкачать

Показатель адиабаты для смеси газов
Выше мы показали, что величина γ от химического состава газовой системы не зависит. Однако она зависит от количества атомов, которое составляет ее молекулы. Предположим, что система состоит из N компонент. Атомная доля компонента i в смеси равна ai. Тогда для определения показателя адиабаты смеси можно использовать следующее выражение:
Где γi — это величина γ для i-го компонента.
Например, это выражение можно применить для определения γ воздуха. Поскольку он состоит на 99 % из двухатомных молекул кислорода и азота, то его показатель адиабаты должен быть очень близок к значению 1,4, что подтверждается при экспериментальном определении этой величины.
Видео:Теплоемкость. Теплоемкость газа. Молярная теплоемкостьСкачать

Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
Видео:Физика. Термодинамика: Внутренняя энергия идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.

Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R — газовая константа, которая играет роль коэффициента пропорциональности.
Видео:Уравнение состояния идеального газаСкачать

Что это адиабатический процесс?
Адиабатический процесс — это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Видео:Физика 10 класс. Адиабатный процесс.Скачать

Уравнения Пуассона для адиабатического процесса
Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV — изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV — малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP — изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ — это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
Цветные линии на графике соответствуют изотермам, черная кривая — это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Видео:Лекция №7. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ ИДЕАЛЬНЫХ ГАЗОВСкачать

Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.
Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 oC?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 oC.
Видео:Урок 178. Тепловые двигатели и их КПД. Цикл КарноСкачать

Новое в блогах
Видео:Физика для чайников. Урок 27. Теплоёмкость газаСкачать

Физический смысл адиабатного процесса (Часть 1 — Давление газа)
1. Это первая часть статьи, которую я планирую написать и опубликовать. Вторая часть будет посвящена температуре, третья — экспериментальной проверке теоретических выводов.
2. Приношу свои извинения за не совсем адекватное написание формул. Всем, кого заинтересовала эта статья, могу выслать на мыло вариант в формате docx с нормально написанными формулами (мой адрес — [email protected])
3. Приглашаю к сотрудничеству по разработке основных положений электромагнитной теории теплоты всех желающих
4. Продолжение следует.
Хорошо известно, что при сжатии газа повышается его давление и его температура. Соответственно, при расширении газа температура и давление падают. Если при этом система (сжимаемый газ и ёмкость, в котором этот газ содержатся) не обменивается тепловой энергией друг с другом и с окружающим пространством, то такие процессы сжатия и расширения называются адиабатными (адиабатическими).
Современная теоретическая физика (статистическая физика, статистическая механика, физическая кинетика) до сих пор объясняет изменение давления и температуры газов работой, которая совершается над газами при их сжатии или которую совершает сам газ при расширении. См, например: ( http://ru.wikipedia.org/wiki/%C0%E4%E8%E0%E1%E0%F2%E8%F7%E5%F1%EA%E8%E9_%EF%F0%EE%F6%E5%F1%F1 )
Характер изменения величин давления и температуры газов при адиабатном процессе в современной теоретической физике считается потенциальной функцией, основанием которой является занимаемый газом определенной массой объём V , а показатель зависит от т.н. показателя адиабаты k :
k = C (p) /C (V) , где
Cp и CV — теплоёмкости газа при постоянном давлении и постоянном объёме, соответственно.
Для идеальных газов, с которыми так любит иметь дело современная теоретическая физика, теплоёмкости которых считаются постоянными, характер изменения давления и температуры определяется простейшими уравнениями:
p= const /V^ k =co nst V^ (- k ) ,
T= const/ V^ (k-1) =const V^ (1-k) , где
p – давление газа,
V – объем, занимаемый газом,
T – температура газа (абсолютная),
k – показатель адиабаты.
Тому же самому учат и все современные школьные учебники и курсы лекций по общей физике.
Современная теоретическая физика считает, что величина показателя адиабаты k равна 5/3 для одноатомных газов, 7/5 – для двухатомных и 4/3 – для трёхатомных газов. Изменение величины показателя адиабаты принято обосновывать количеством неких «степеней свободы» у газообразных молекул. Хотя абсолютно никакой логики и никакого физического смысла в попытке связать эти самые «степени свободы» с величиной показателя адиабаты нет.
Что же происходит при адиабатных процессах с газами согласно разрабатываемой мной электромагнитной теории теплоты (ЭТТ).
Согласно ЭТТ агрегатное состояние вещества определяется текущим распределением электронов атомов, входящих в состав молекулы. Существует три основным электронных уровня – газообразующий, в котором может находиться не более двух электронов, гидрогенный («жидкостной») и кристаллообразующий, в группах которых может содержаться максимум по 8 электронов. Таковы на сегодняшний день представления ЭТТ о строении атомов и молекул, сделанные на основе свойств элементов периодической таблицы Менделеева.
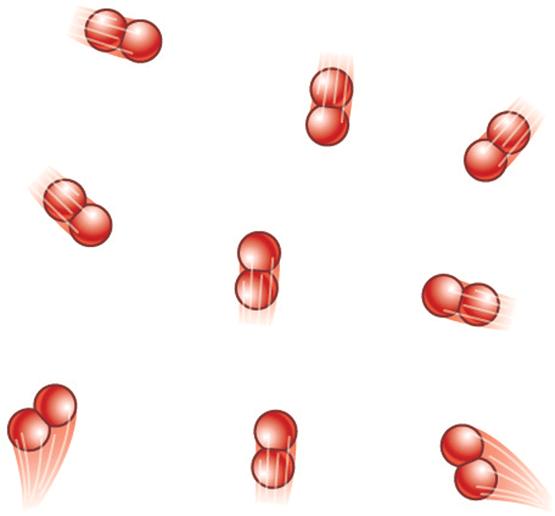
Молекула реального газа гелия (He), более всех других подходящего на роль «идеального» газа, представлена на рис. 1. Она имеет одноатомное молекулярное ядро, в состав которого входит два протона и два нейтрона, и два электрона, которые при нормальных условиях располагаются на газообразующем уровне – вращаясь по замысловатым траекториям вокруг молекулярного ядра, они создают вокруг него сферическое электронное «облако».
Рис. 1. Газообразная молекула He (гелия)
согласно электромагнитной теории теплоты.
Электроны, вращаясь вокруг молекулярного ядра, создают т.н. «электронное облако», которое индуцирует электрическое и магнитное поля. Эти поля, взаимодействуя с электрическими и магнитными полями, индуцируемыми электронами соседних молекул, и заставляют газообразные молекулы отталкиваться друг от друга, как одноимённые электрические заряды и одинаковые полюса магнитов. Эти силы отталкивания молекул друг от друга и приводят ко всем хорошо известным свойствам газов занимать весь предоставленный объём, рассеиваться в вакууме (космическом пространстве), обладать упругостью, создавать, вследствие действия силы притяжения к Земле, атмосферное давление, передавать давление в разных направлениях, например, звуковые волны и т.д. и т.п.
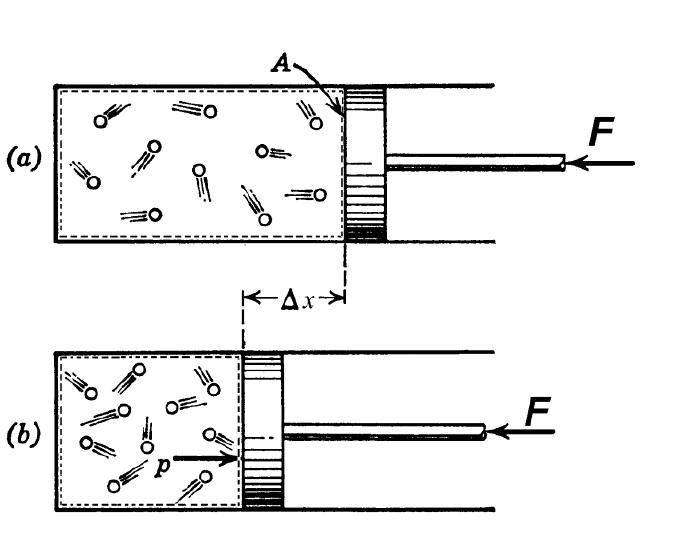
Предположим, мы имеем некий цилиндр с поршнем, наполненный молекулами «идеального» газа гелия (см. рис. 2 слева). Приложив к штоку поршня некоторую силу F , т.е. попросту надавив на поршень, мы уменьшили объём газа в n раз – например, как это показано на рис. 2 справа – вдвое.
Рис. 2. Адиабатное сжатие газа
согласно электромагнитной теории теплоты.
Вследствие сжатия газообразные молекулы гелия уплотнились, расстояния между молекулярными ядрами уменьшились. Соответственно, главные эквипотенциальные поверхности полей молекул сократились в размерах, – что наглядно изображено на рис. 2.
Кстати, рис. 2 наглядно отображает характер уплотнения молекул. Хотя сперва кажется, будто бы я просто-напросто не нарисовал половину молекул внутри цилиндра с поршнем. Присмотритесь внимательно – в каждом ряду молекул на рисунке справа – 9 штук, а слева – уже 11. Я не ошибся. При уменьшении объёма вдвое расстояние между молекулами уменьшается всего на одну пятую часть – см. рис. 3.
Рис. 3. Изменение соотношений длины ребра и площади грани куба
при уменьшении его объёма вдвое.
То есть, при уменьшении объёма в n раз расстояние между центрами газовых молекул сокращается в куб.корень из < n> раз.
Определим, в какой пропорции увеличиваются силы отталкивания между отдельными молекулами (см. рис. 4).
Рис. 4. Увеличение сил отталкивания между отдельными газовыми молекулами при сжатии газа.
Согласно закона Кулона, величина силы взаимодействия двух точечных зарядов прямо пропорциональна произведению модулей этих зарядов q 1 и q 2 и обратно пропорциональна квадрату расстояния R между ними:
k в данном случае – коэффициент пропорциональности.
Эта формула универсальна для всех известных полей – и для магнитного и для гравитационного. Для гравитационного поля, например, этой формулой описывается закон всемирного тяготения:
где γ — гравитационная постоянная, по сути – тот же самый коэффициент пропорциональности, а m 1 и m 2 – масса тел («гравитационный заряд»).
В нашем случае мы под обозначением q 1 и q 2 будем понимать условную сумму всех типов «зарядов», индуцирующих соответствующие поля – и электрического, и магнитного, и пытающегося им противостоять гравитационного (как известно, гравитационное поле создаёт лишь силы притяжения). Таким образом (см. рис. 4), до сжатия газа, отдельно взятые молекулы отталкивались друг от друга с силой:
а после сжатия – с силой:
Таким образом, при уменьшении объёма в n раз (специалисты в области двигателей внутреннего сгорания называют эту величину степенью сжатия) сила отталкивания между отдельными молекулами увеличится в:
Во сколько же раз в этом случае возрастёт давление газа? Чтобы правильно ответить на этот вопрос, вспомним, что же такое давление. Это величина усилия на единицу площади.
После сжатия, как мы определили, усилие каждой отдельной газовой молекулы на внутреннюю поверхность цилиндра увеличилось в <куб. кор из n>^ 2 раз. Но, помимо этого, увеличилось и количество молекул, оказывающих давление на ту же самую площадь внутренней поверхности цилиндра (см. рис. 5).
Рис. 5. При сжатии газа увеличивается количество молекул,
оказывающих давление на единицу площади.
Допустим, что если до сжатия на «единичную» площадь оказывало давление a× a молекул, то, как абсолютно очевидно, после сжатия газа в n раз число этих молекул стало <куб. кор. из n> a × <куб. кор. из n> a = <куб. кор. из n>^ 2 a^ 2 . То есть количество газовых молекул, оказывающих давление на «единичную» площадь, увеличилось в ^ 2 раз.
Если количество молекул, оказывающих давление на единицу площади поверхности, увеличилось в ^ 2 раз, и сила давления каждой молекулы на поверхность тоже увеличилось в ^ 2 раз, то давление газа при его сжатии в n раз увеличивается в ^ 2 × <куб.кор. из n>^ 2 = <куб.кор. из n>^ 4 = n ^<4/ 3> раз.
Таким образом, используя простейшие математические операции и логику, мы получаем показатель адиабаты для одноатомных идеальных газов, равный 4/3.
Как видим, он не соответствует общепринятому на сегодня показателю адиабаты для идеальных одноатомных газов, равному 5/3. Значит, выводы поспешны и не соответствуют истине? Вовсе нет. Ответ на вопрос, какая теория – молекулярно-кинетическая или электромагнитная более адекватно и более точно описывает реальное состояние газовых сред, могут дать только натурные эксперименты. Дело в том, что результаты прямого измерения показателя адиабаты для инертных газов вовсе не соответствуют теоретическим выкладкам, полученным из количества степеней свободы.
🌟 Видео
Рассмотрение темы: "Теплоёмкость газов"Скачать

Уравнение состояния идеального газаСкачать

Физика. 10 класс. Расчёт КПД цикловСкачать

Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

При изохорном охлаждении 6 моль идеального двухатомного газа, давление уменьшилось в 3 раза - №24387Скачать

Физик газ заставил работать. Работа одноатомного идеального газа (2 часть)Скачать