Формула для расчёта механической работы
при изменении объёма системы
Выражение (8.2) можно рассматривать как интегральную форму записи первого закона термодинамики.
Анализировать различные термодинамические процессы удобно, если пользоваться не интегральной, а дифференциальной формой записи первого закона термодинамики. В частности, это даёт возможность рассчитывать величину l – удельную работу процесса или, более строго, удельную энергию, подведённую к системе или отведённую от неё в форме механической работы.
Дифференциальная форма записи справедлива только для равновесных процессов. Рассмотрим её вывод из (8.2) для произвольного равновесного процесса изменения объёма некоторой термодинамической системы. Такой системой, в частности, может быть некоторый объём газа.
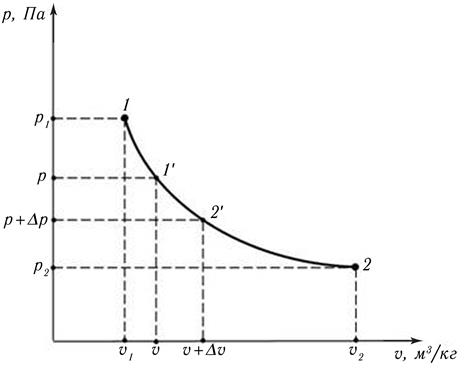
Известно, что равновесный процесс может быть изображён непрерывной кривой, например, в рυ – координатах (рис. 9.1). Это будет р = р (υ) – уравнение процесса, описывающее зависимость абсолютного давления системы р, Па, в ходе процесса, от удельного объёма υ, м 3 /кг.
Рис. 9.1. Равновесный процесс в рυ – координатах
Для некоторой системы, в которой реализуется процесс 1 – 2, первый закон термодинамики (8.1) запишется в виде:
На кривой р(υ) выберем произвольную промежуточную точку 1′ с параметрами р и υ. Рассмотрим малую часть процесса 1 – 2 в районе точки 1′, т.е. процесс 1′ – 2′, при котором параметры состояния изменяются на малые величины Δр и Δυ.
Для малого процесса 1′ – 2′ запишем первый закон термодинамики в виде:
где U и U +ΔU – внутренние энергии системы в точках 1′ и 2′ соответственно, Дж; ΔU – изменение внутренней энергии системы в процессе 1′ → 2′, Дж; ΔQ – теплота процесса 1′ – 2′, Дж; ΔL – работа процесса 1′ – 2′, Дж.
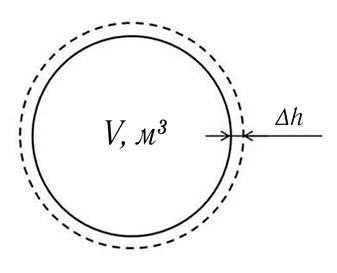
Для определения ΔL схематично изобразим систему в точках 1′ (сплошная линия) и 2′ (пунктирная линия) на рис. 9.2.
Рис. 9.2. Схема процесса 1′ – 2′:
V – объём системы в точке 1′; Δh – перемещение поверхности системы в процессе 1′ – 2′
Исходя из определения механической работы, можем записать:
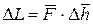
где 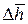
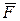
В силу малости процесса 1′ – 2′, можем записать:
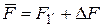
где 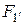
Значение 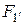
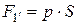
Подставляя (9.5) и (9.6) в (9.4) получаем:
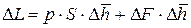
В (9.7) перейдём к пределу при Δр (а значит и Δυ) стремящемся к нулю:
lim ΔL = p · S · lim 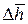
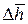
В результате, отбросив по очевидным причинам бесконечно малые величины второго порядка малости, получаем:
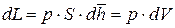
где dL – дифференциал механической работы в процессе 1 – 2, Дж; 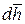
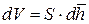
Замечание:
Для наглядности проиллюстрируем справедливость выражения 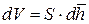
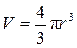
Будем считать, что сфера «раздувается», то есть её радиус изменяется. После дифференцирования (9.9) получаем формулу для бесконечно малого приращения объёма «раздувающейся» сферы:
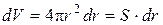
где S – площадь сферы, м 2 ; dr – дифференциал (бесконечно малое приращение) радиуса сферы, м.
Переходя в (9.3) к пределу при Δр (и Δυ) стремящихся к нулю и подставляя (9.8) будем иметь:
где dU, dQ и dL – дифференциалы (бесконечно малые приращения) внутренней энергии системы, теплоты и работы процесса соответственно, Дж.
Выражение (9.10) является дифференциальной формой записи первого закона термодинамики.
Разделив обе части (9.10), например, на массу системы, получаем уравнение для удельных величин:
где dυ – дифференциал удельного объема системы, м 3 /кг.
Таким образом, удельная механическая работа рассчитывается путём интегрирования дифференциального уравнения вида:
где р = p(υ) – уравнение процесса. В примере, изображённом на рис. 9.1. это процесс 1 – 2.
После интегрирования (9.12) от начала в точке 1 до конца процесса в точке 2 получаем формулу для расчёта удельной работы любого процесса 1 – 2:
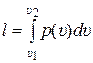
где υ1 и υ2 – значения удельного объёма в начале и конце процесса 1 – 2 соответственно, м 3 /кг.
Из геометрической интерпретации интеграла следует, что значение удельной работы, рассчитываемое по (9.13), равно площади под уравнением процесса р(υ) в рυ – координатах. На рис. 9.1 это площадь под линией процесса 1 – 2.
Для того чтобы по формуле (9.13) вычислить значение удельной работы необходимо знать вид функции р(υ) и пределы интегрирования υ1 и υ2.
Видео:Урок 172. Применение 1 закона термодинамики для различных процессовСкачать

Первый закон термодинамики
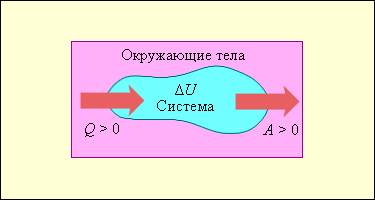
На рисунке 3 . 9 . 1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q > 0 , если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A > 0 .
Рисунок 3 . 9 . 1 . Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Состояние системы меняется, когда происходит процесс ее обмена теплом с окружающими объектами, и она совершает положительную или отрицательную работу. Изменяются макроскопические параметры системы, такие как температура, объем и давление. По причине того, что внутренняя энергия U всецело определяется макроскопическими параметрами, которые характеризуют состояние системы, процессы совершения работы и теплообмена провоцируют изменения внутренней энергии данной системы Δ U .
Видео:Применение первого закона термодинамики к изопроцессам. 10 класс.Скачать

Определение 1 -го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Изменение Δ U внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q , переданной системе, и работой A , совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Видео:Первый закон термодинамики. 10 класс.Скачать

Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В изохорном процессе, то есть в условиях неизменного объема ( V = c o n s t ) , газ не совершает работы, A = 0 .
В этом случае справедливой будет формула внутренней энергии газа:
Q = ∆ U = U ( T 2 ) — U ( T 1 ) .
В данном выражении U ( T 1 ) и U ( T 2 ) представляют внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит лишь от температуры, что исходит из закона Джоуля. При изохорном нагревании газ поглощает тепло ( Q > 0 ) , чем провоцирует увеличение его внутренней энергии. В условиях охлаждения тепло отдается внешним объектам ( Q 0 ) .
В изобарном процессе, предполагающем постоянность значения давления ( p = c o n s t ) , работа, совершаемая газом, выражается в виде соотношения:
A = p ( V 2 — V 1 ) = p ∆ V .
Первый закон термодинамики для изобарного процесса дает:
Q = U ( T 2 ) — U ( T 1 ) + p ( V 2 — V 1 ) = ∆ U + p ∆ V .
При изобарном расширении Q > 0 тепло поглощается газом, и он совершает положительную работу. При изобарном сжатии Q 0 тепло переходит внешним телам. В таком случае A 0 . При изобарном сжатии уменьшаются температура газа T 2 T 1 и значение внутренней энергии Δ U 0 .
В изотермическом процессе температура газа не меняет своей величины, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0 .
Первый закон термодинамики для изотермического процесса выражается соотношением
Теплота Q , приобретенная газом в процессе изотермического расширения, превращается в работу, совершаемую над внешними объектами. И наоборот, изотермическое сжатие приводит к преобразованию уже работы внешних сил, произведенной над газом, в передающееся окружающим телам тепло.
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Рисунок 3 . 9 . 2 . Модель адиабатического процесса.
В адиабатическом процессе Q = 0 . По данной причине первый закон термодинамики принимает вид:
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Расширение или сжатие газа на плоскости p , V проиллюстрирована кривой, называемой адиабатой.
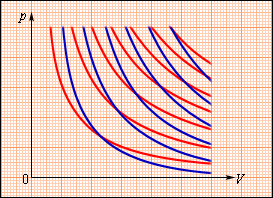
В процессе адиабатического расширения газом совершается положительная работа A > 0 , что является причиной понижения значения внутренней энергии Δ U 0 . Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом (рис. 3 . 9 . 3 ).
Рисунок 3 . 9 . 3 . Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
В условиях координат ( p , V ) выводящееся в термодинамике уравнение адиабатического процесса для идеального газа принимает следующий вид:
p V γ = c o n s t .
Данное выражение, в котором γ = C p C V – показатель адиабаты, C p и C V – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом, называется уравнением Пуассона. В условиях одноатомного газа γ = 5 3 = 1 , 67 , двухатомного γ = 7 5 = 1 , 4 , многоатомного γ = 1 , 33 .
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
A = C V ( T 2 — T 1 )
Адиабатический процесс относится к изопроцессам.
В термодинамике важное место занимает физическая величина, называемая энтропией. Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу Δ Q T . Так как на каждом участке адиабатического процесса Δ Q = 0 , энтропия в нем не претерпевает изменений.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
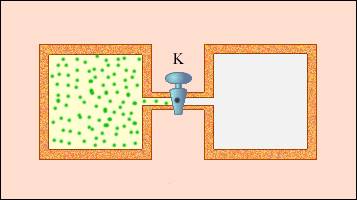
Примером неквазистатического процесса, в котором промежуточные состояния не находятся в состоянии равновесия, служит расширение газа в пустоту. На рисунке 3 . 9 . 3 иллюстрируется жесткая адиабатическая оболочка, состоящая из двух разделенных вентилем K сообщающихся емкостей. В изначальном состоянии газом заполнен один из сосудов, в это же время во втором находится лишь вакуум. Открытие вентиля запускает процесс расширения газа. Он заполняет оба сосуда, и устанавливается новое равновесное состояние.
В таком процессе Q = 0 , по той причине, что исключен теплообмен с окружающими телами, и A = 0 , так как оболочка недеформируема. Первый закон термодинамики позволяет сказать, что Δ U = 0 , то есть внутренняя энергия газа не претерпела никаких изменений. Так как внутренняя энергия идеального газа зависит лишь от температуры, температура газа в начальном и конечном состояниях одинакова. Изображающие эти состояния точки на плоскости ( p , V ) лежат на одной изотерме. Все промежуточные состояния газа не являются равновесными и не могут быть изображены на диаграмме.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Рисунок 3 . 9 . 4 . Расширение газа в пустоту.
Видео:Физика 10 класс (Урок№24 - Первый закон термодинамики.)Скачать

Первое начало термодинамики
Вы будете перенаправлены на Автор24
Закон сохранения энергии для количества теплоты как формы энергии может быть записан в виде:
[delta Q=dU+delta A left(1right).]
[CdT=dU+delta A left(2right),]
где C — теплоемкость системы.
В термодинамике уравнение (1) является крайне важным и называется первым началом. В отличие от закона сохранения их механики, первое начало термодинамики содержит бесконечно малое количество теплоты $delta Q$. Мы знаем, что изучение разного рода переходов именно этой формы энергии — предмет термодинамики. Очень часто уравнение (1) записывается в виде:
[delta Q=dU+pdV left(3right).]
Уравнения (1), (2) и (3) записаны в дифференциальной форме.
В связи с тем, что теплота и работа не являются функциями состояния, то для бесконечно малого количества теплоты и элементарной работы используют обозначение $delta Q$, а не $dQ$ и $delta A$, а не $dA$. Этим подчёркивается, что $delta Q$ и $delta A$ не рассматриваются как полные дифференциалы, т.е. невсегда могут быть представлены как бесконечно малые приращения функций состояния (только в частных случаях).
Первое начало термодинамики не может предсказать направление развития процесса. Этот закон лишь констатирует факт изменения величин в процессе и говорит о величине их изменения. Забегая вперед, скажем, что второе начало термодинамики определяет направление процесса.
В том случае, если рассматривается круговой процесс (система возвращается в исходное состояние), изменение внутренней энергии системы $dU=0$, то первое начало термодинамики говорит о том, что все тепло, которое получила система, идет на совершение этой системой работы.
Видео:Применение первого начала термодинамики к изопроцессамСкачать

Интегральная форма первого начала термодинамики
Первое начало термодинамики можно записать и в интегральной форме:
[Q=triangle U+A left(4right).]
На словах уравнение (4) означает, что подводимая к системе теплота идет на изменение внутренней энергии системы и совершение этой системой работы.
Обратимся опять к круговому процессу ($triangle U$). Если в круговом процессе $Q=0, то A=0.$ Это означает, что невозможен процесс производства работы без какого-то ни было изменения во внешних к системе телах. Или говорят по-другому: не возможен вечный двигатель первого рода.
Рассмотрим изохорный процесс. При постоянном объеме система работу не совершает. В таком случае:
говорят, что все подводимое к системе тепло идет на изменение (увеличение) внутренней энергии системы.
В изотермическом процессе внутренняя энергия системы неизменна, следовательно:
все подводимое системе тепло идет на совершение системой работы.
Задание: В идеальном газе совершается процесс заданный уравнением: $T=T_0e^$, где $T_0, a- $ постоянные. Изохорная молярная теплоемкость газа $c_$ известна. Найти $c_$(V) для заданного процесса.
Основой для решения будет первое начало термодинамики в дифференциальном виде:
[CdT=dU+delta A left(1.1right).]
Приращение внутренней энергии $dU$ равно:
[dU=fracnu RdT to CdT=fracnu RdT +pdVleft(1.2right),]
Используем для дальнейших вычислений уравнение Менделеева — Клайперона:
Подставим в (1.3) вместо T уравнение процесса, получим:
[pV=nu RT_0e^to p=nu RT_0frac<e^> left(1.4right).]
Так как из уравнения процесса $dT$ равно:
То, подставив (1.5) и (1.4) в (1.2), получим выражение:
Соответственно, для молярной теплоемкости процесса получим:
Ответ: Молярная теплоемкость для заданного процесса выражается формулой: $c_left(Vright)=c_+frac$.
Готовые работы на аналогичную тему
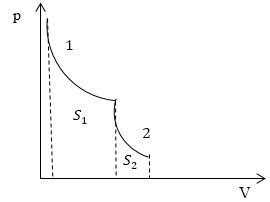
Задание: На рис.1 представлен процесс, состоящий из изотермы (1) и адиабаты (2). Укажите площадь, которая представляет количество теплоты, которое поглощает газ.
Запишем первое начало термодинамики в интегральном виде:
[Q=triangle U+A left(2.1right).]
Первая часть процесса, который представлен на рис.1, является изотермой, следовательно: $triangle U_1=0$ и уравнение (2.1) запишется, как:
Вторая часть процесса представлена адиабатой. Относительно адиабатных процессов известно, что они проводятся без подвода тепла, следовательно:
а работа по расширению газа идет за счет уменьшения его внутренней энергии.
Итак, мы получили, что в указанном на рис.1 процессе тепло подводится только на участке 1, и оно равно работе, которую совершает газ в процессе своего расширения. По определению в процессе 1 работа равна:
Из геометрического свойства интеграла $A_1=S_1$ на рис. 1.
Ответ: Количество теплоты, подведенное в заданном процессе, представлено площадью $S_1$ на рис. 1.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
📺 Видео
Что такое первый закон термодинамики?Скачать

Первый закон термодинамики. Применение первого закона терм-ки к изопроцессам. Практ. ч. 10 класс.Скачать

Урок 170. Количество теплоты. Первый закон термодинамикиСкачать

Физика. 10 класс. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессамСкачать

ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИСкачать

Физики 10 класс Следствия первого закона термодинамики для различных процессовСкачать

Законы Термодинамики. Что Такое Термодинамика?Скачать

ФИЗИКА ЗА 5 МИНУТ - ТЕРМОДИНАМИКАСкачать

Физика. Термодинамика: Первое начало термодинамики. Центр онлайн-обучения «Фоксфорд»Скачать

2 1 Первый закон термодинамики ЭнтальпияСкачать

Первый закон термодинамики простым языком!Скачать

Первый закон термодинамики | Физика 10 класс #41 | ИнфоурокСкачать

Дифференциальные уравнения термодинамикиСкачать

Урок 171. Простейшие задачи на 1-й закон термодинамикиСкачать

Первый закон термодинамики для ЕГЭ #shortsСкачать