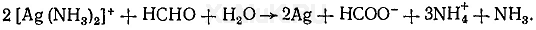В две пробирки прибавляют по 10 капель свежеприготовленного бесцветного раствора фуксинсернистой кислоты (реактив Шиффа). В одну пробирку добавляют 3-4 капли 40%-ного раствора формалина, в другую – несколько капель ацетона. Как изменяется окраска раствора? В обе пробирки добавляют по несколько капель концентрированной соляной кислоты. Отмечают наблюдаемые явления.
Все альдегиды и кетоны, содержащие метильную группу, дают цветную реакцию с фуксинсернистой кислотой. Однако, характерная окраска в сильнокислой среде характерна только для формальдегида.
Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
В пробирку помещают 10 капель дистиллированной воды, 2 капли ацетона и 5 капель 1%-ного раствора нитропруссида натрия. Добавляют несколько капель 10%-ного раствора едкого натра. В какой цвет окрасился раствор?
Разливают раствор в две пробирки и в одну из них прибавляют 5-6 капель 30%-ной уксусной кислоты. Сравнивают окраску в обеих пробирках.
Нитропруссид натрия Na2[Fe(CN)5NO] (пентацианоферроат натрия) дает характерную окраску в присутствии кетонов, не исчезающую в среде уксусной кислоты.
Эта цветная реакция используется для открытия ацетона (качественная реакция на группу СН3СО-)
Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
В пробирку помещают маленький кипятильный камешек. Наливают 3 мл 10%-ного раствора едкого натра и нагревают до кипения. Затем щелочь выливают в специальную посуду, а пробирку охлаждают на воздухе (водой не ополаскивать).
В охлажденную пробирку прибавляют 10 капель (0,5мл) свежеприготовленного 1%-ного аммиачного раствора оксида серебра и 5 капель 1%-ного раствора формалина. Пробирку помещают в водяную баню (или стакан с горячей водой). Через некоторое время на стенках пробирки образуется налет металлического серебра (“cеребряное зеркало”).
Альдегиды очень легко окисляются гидроксидами металлов в щелочной среде. При взаимодействии альдегидов с аммиачным раствором оксида серебра протекает реакция в соответствии со следующей схемой (написать уравнение реакции окисления формальдегида).
После окончания опыта раствор из пробирки сливают в специальную посуду для слива отходов серебра.
Окисление формальдегида гидроксидом меди (II) в щелочной среде
В пробирку помещают 10 капель 10%-ного раствора едкого натра и добавляют 4-5 капель 3%-ного раствора сульфата меди (II). К образовавшемуся голубому осадку гидроксида меди (II) прибавляют 8-10 капель 40%-ного раствора формальдегида. Затем смесь взбалтывают и нагревают до кипения. При нагревании цвет осадка меняется на желтый, а затем происходит образование на стенках пробирки красного налета оксида меди (I).
Написать уравнение происходящей реакции.
Эта реакция является качественной реакцией на альдегиды. Кетоны не окисляются этими реактивами.
Реакция дисмутации водных растворов формальдегида
В пробирку помещают 2-3 капли 40%-ного раствора формальдегида. Добавляют 1 каплю индикатора метилового красного. Раствор окрашивается в красный цвет. Это указывает на кислую реакцию. При стоянии растворов формальдегида в них постепенно протекают процессы окисления-восстановления, называемые реакцией дисмутации. Реакция дисмутации заключается в том, что при участии воды из каждых двух молекул формальдегида одна окисляется до кислоты, а другая восстанавливается в спирт. Написать уравнение данной реакции.
Реакции такого типа характерны для альдегидов, не вступающих в реакцию альдольной конденсации, и катализируются сильными основаниями.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Окислением каких спиртов можно получить следующие соединения: а) 2-метилбутаналь; б) изомасляный альдегид; в) 5,5-диметилгексанон-3; г) метилизобутилкетон?
2. Из каких альдегидов и кетонов при восстановлении могут быть получены следующие спирты: а) 1-пентанол; б) этилпропилкарбинол; в) метилизопропилкарбинол; г) метилтретбутилкарбинол?
3. Какие соединения получатся при действии гидросульфита натрия на: а) пропаналь; б) 2-метилбутаналь; в) метилэтилкетон?
4. Написать уравнение реакции взаимодействия пропионового альдегида с пропанолом-2.
5. Предложить способ распознавания метилпропилкетона и диэтилкетона.
6. Получить реакцией оксосинтеза изомасляный альдегид и написать для него уравнение реакции “серебряного зеркала”.
7. Получите 3-метилпентаналь окислением соответствующего спирта. Напишите для альдегида уравнение реакции с хлоридом фосфора (V).
8. Напишите уравнение альдольной конденсации: а) уксусного альдегида с формальдегидом; б) формальдегида с ацетоном; в) диметилуксусного альдегида.
9. Напишите схемы окисления кетонов: а) бутанона; б) 2-метилпентанона; в) 2,2-диметил-3-гексанона.
10. Предложите химический метод, с помощью которого можно разделить: а)гексаналь и гексан; б) пентаналь и диэтилкетон.
11. Используя в качестве исходного вещества ацетилен, получите 2-бутеналь и напишите для него уравнение реакции с синильной кислотой.
12. Получите метилвинилкетон из следующих веществ: а) ацетона и формальдегида; б) ацетилена и неорганических реагентов.
13. Напишите уравнения реакций в соответствии со следующей схемой: спирт® альдегид ®дигалоидпроизводное® альдегид и укажите условия проведения.
14. Написать уравнение реакции Канниццаро для триметилуксусного альдегида.
15. Написать уравнение реакции сложноэфирной конденсации пропаналя.
ЛАБОРАТОРНАЯ РАБОТА №9
Тема: КАРБОНОВЫЕ КИСЛОТЫ
Цель работы: Практическое ознакомление с некоторыми общими и специфическими свойствами карбоновых кислот на примере отдельных представителей.
Оборудование и реактивы:муравьиная, уксусная, бензойная, сорбиновая, стеариновая (или пальмитиновая) кислоты; растворители: вода, диэтиловый спирт, бензол или другие растворители; хлороформ; 10%-ный раствор гидроксида натрия, 1%-ный раствор нитрата серебра; 5%-ный раствор аммиака, концентрированная серная кислота; известковая (или баритовая) вода; ацетат натрия; 10%-ный раствор серной кислоты; 10%-ный раствор уксусной кислоты или столовый уксус; 2%-ный раствор перманганата калия; 10%-ный раствор карбоната натрия; олеиновая кислота; бромная вода; концентрированная азотная кислота; медь (стружки или проволока); синяя лакмусовая бумага (или универсальная), бани водяные; изогнутые газоотводные трубки; пипетки; прямые газоотводные трубки с оттянутым концом; пробирки.
Теоретическая часть
Карбоновыми кислотаминазывают производные углеводородов, содержащие одну или несколько карбоксильных групп — СООН.
Карбоновые кислоты классифицируют по числу карбоксильных групп (одноосновные и многоосновные), по количеству атомов углерода (низшие и высшие), в зависимости от строения углеводородного радикала (предельные, непредельные, ароматические, оксикислоты, фенолокислоты, альдегидо- и кетокислоты и другие группы). В соответствии с вышеуказанным различают следующие гомологические ряды карбоновых кислот.
| Предельные одноосновные кислоты | Непредельные одноосновные кислоты | ||
| НСООН | муравьиная | СН2=СН-СООН | Акриловая |
| СН3СООН | уксусная | СН2=СН-СН2-СООН | Винилуксусная |
| СН3СН2СООН | пропионовая | СН3СН=СНСООН | кротоновая |
| СН3(СН2)2-СООН | масляная | СН2=С(СН3)-СООН | метакриловая |
| СН3(СН2)3-СООН | валериановая | СН3-(СН=СН)2-СООН | сорбиновая |
| СН3(СН2)4-СООН | капроновая | СН3(СН2)7СН=СН(СН2)7-СООН | Олеиновая (цис-), элаидиновая (транс-) |
| СН3(СН2)5-СООН | энантовая | С17Н31СООН | линолевая |
| СН3(СН2)10-СООН | лауриновая | С17Н29СООН | Линоленовая |
| СН3(СН2)14-СООН | пальмитиновая | СН=С-СООН | Пропиоловая |
| СН3(СН2)16-СООН | стеариновая | СН3С=С-СООН | тетроловая |
| С20Н31СООН | арахидоновая |
Предельные двухосновные кислоты: НООС-СООН – щавелевая, НООС-СН2-СООН – малоновая, НООС-(СН2)2-СООН – янтарная, НООС-(СН2)3-СООН – глутаровая, НООС-(СН2)4-СООН – адипиновая, НООС-(СН2)5-СООН – пимелиновая, НООС-(СН2)6-СООН – пробковая, НООС-(СН2)7— СООН – азелаиновая, НООС-(СН2)8-СООН – себациновая.
Непредельные двухосновные кислоты:НООС-СН=СН-СООН – малеиновая (цис-изомер) и фумаровая (транс-изомер).
Ароматические карбоновые кислоты: одноосновные – С6Н5-СООН –бензойная; СН3-С6Н4-СООН – толуиловые кислоты (орто-, мета-, пара-), двухосновные:
фталевая изофталевая терефталевая
Предельные жирно-ароматические кислоты:С6Н5-СН2-СООН – фенилуксусная.
Непредельные жирно-ароматические кислоты: С6Н5-СН=СН-СООН – коричная
Оксикарбоновые кислоты:одноосновные: НО-СООН – оксимуравьиная, угольная; НО-СН2-СООН – гликолевая; СН3СН(ОН)-СООН – молочная; двухосновные: НООС-СНОН-СООН – тартроновая, НООС-СН2-СНОН-СООН – яблочная, НООС-СНОН-СНОН-СООН – винная;
НООС-СН2-С(ОН)(СООН)-СН2-СООН – лимонная; ароматические оксикислоты (фенолокислоты):
Методы получения
Карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная кислота – в крапиве, яблочная – в фруктах, сорбиновая – в ягодах рябины, брусники, изовалериановая – в валериановом корне), а также в виде сложных эфиров и жиров. Основным источником получения карбоновых кислот является все же органический синтез.
1. Окисление спиртов, альдегидов, кетонов, углеводородов (см. химические свойства указанных соединений).
2. Оксосинтез:
|
Процесс проводят при высокой температуре и давлении в присутствии карбонилов никеля или кобальта (Ni(CO)4, Co(CO)8).
3. Гидролиз нитрилов (R-C=N) в кислой или щелочной среде при нагревании:
4. Гидролиз тригалогенпроизводных:
5. Магнийорганический синтез(лабораторные методы):
Видео:Качественные реакции на альдегидыСкачать

Опыт 6. Свойства ализарина.
Лабораторная работа №2.
Тема: Карбонильные органические соединения.
Цель: исследовать химические свойства и осуществить качественные реакции на карбонильные соединения.
Опыт 1. Цветная реакция на альдегиды с фуксинсернистой кислотой.
Реактивы и материалы: формальдегид, 40%-ный водный раствор; этаналь; фуксинсернистая кислота.
В две пробирки помещают по 2 капли раствора фуксинсернистой кислоты и добавляют в одну из них 2 капли раствора формальдегида, в другую – 2 капли этаналя. Раствор фуксинсернистой кислоты при добавлении раствора формальдегида постепенно окрашивается в фиолетовый цвет, при добавлении этаналя – в розово-фиолетовый цвет.
Опыт 2. Самоокисление водных растворов формальдегида.
Реактивы и материалы: формальдегид, 40%-ный водный раствор, метиловый красный, раствор.
В пробирку помещают 2—3 капли раствора формальдегида и добавляют 1 каплю индикатора метилового красного. Раствор принимает красную окраску, что указывает на кислую реакцию.
Альдегиды очень легко окисляются. В водных растворах они могут окисляться до кислоты за счет кислорода другой молекулы альдегида, восстанавливая ее в спирт — происходит реакция окислительного восстановления (дисмутации):
H-C-H + H-C-H → HCOOH + CH3OH
Опыт 3. Окисление альдегидов аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Реактивы и материалы: формальдегид, 40%-ный водный раствор; аммиак, 2 н. раствор; нитрат серебра, 0,2 н. раствор.
В чистую пробирку вводят 2 капли раствора нитрата серебра и прибавляют каплю аммиака. Образующийся бурый осадок гидроксида серебра растворяют, добавляя избыток (1-2 капли) раствора аммиака.
Затем прибавляют каплю раствора формальдегида и медленно подогревают содержимое пробирки над пламенем горелки. При осторожном нагревании содержимое пробирки буреет и на ее стенках может выделиться серебро в виде блестящего зеркального налета (комплексный ион металла восстанавливается до металлического серебра). Альдегид окисляется до кислоты, которая образует аммониевую соль.
Опыт 4. Окисление альдегидов гидроксидом меди (II).
Реактивы и материалы: формальдегид, 40%-ный водный раствор; сульфат меди CuSO4, 0,2 н. раствор; едкий натр, 2 н. раствор.
В пробирку помещают 4 капли раствора едкого натра, разбавляют 4 каплями воды и добавляют 2 капли раствора сульфата меди (II). К выпавшему осадку гидроксида меди (II) прибавляют 1 каплю раствора формальдегида и взбалтывают содержимое пробирки.
Нагревают над пламенем горелки до кипения только верхнюю часть раствора так, чтобы нижняя часть оставалась для контроля холодной. В нагретой части пробирки выделяется желтый осадок гидроксида меди (I) (СuОН), переходящий в красный оксид меди (I) (Сu2О), а иногда на стенках пробирки выделяется даже металлическая медь.
Повторите этот опыт, заменив раствор формальдегида раствором этаналя.
Опыт 5. Реакция бензальдегида с гидросульфитом натрия.
Реактивы и оборудование: бензальдегид; гидросульфит натрия (насыщенный раствор); водяная баня.
В пробирку помещают 3 капли бензойного альдегида, добавляют 5 капель насыщенного раствора гидросульфита натрия и энергично встряхивают смесь. Образуются кристаллы гидросульфитного соединения.
Затем к смеси добавляют 6 капель воды и помещают пробирку в горячую водяную баню. Кристаллы быстро исчезают, в растворе появляются маслянистые капли ощущается характерный запах бензальдегида.
При нагревании в водном растворе гидросульфитное соединение легко разлагается на исходные вещества:
Опыт 6. Свойства ализарина.
Реактивы и оборудование: ализарин; алюминиевые квасцы, насыщенный водный раствор; едкий нарт, 0,1 н. раствор; белая хлопчатобумажная ткань; фарфоровая чашка.
В пробирку помещают 3-5 капель ализарина, добавляют 6 капель щелочи и тщательно взбалтывают. Получается раствор, окрашенный в фиолетовый цвет.
1.В пробирку помещают 2 капли раствора ализарина и добавляют 3 капли раствора квасцов. Образуется оранжево-красный осадок алюминиевого ализаринового лака.
2.Кусочек белой ткани простирывают с мылом и тщательно прополаскивают в воде. В фарфоровую чашечку наливают раствор квасцов, пропитывают им ткань и отжимают.
В пробирку помещают 5 капель щелочного раствора ализарина, нагревают и в горячий раствор погружают кусочек «протравленной» ткани на 1-2 мин. Затем ткань, окрашенную в красный цвет, промывают водой.
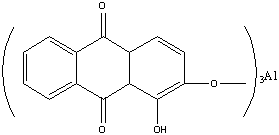
Ализарин — протравной краситель. С алюминиевой протравой он дает ярко-красную окраску; с оловянной — фиолетово-красную; с железной — черно-фиолетовую. С ионами этих металлов ализарин образует хелатные соединения за счет групп С=О и группы -ОН, находящейся в α-положении:
Видео:Качественная реакция на альдегиды с гидроксидом медиСкачать

§ 7. ФОРМАЛЬДЕГИД
Формальдегид (альдегид муравьиной кислоты)—газ, хорошо растворимый в воде, обладающий острым специфическим запахом. Водный раствор, содержащий 36,5—37,5 % формальдегида, называется формалином. Формальдегид образуется при неполном сгорании метана, при окислении метилового спирта и т. д. Газообразный формальдегид при комнатной температуре легко полимеризуется с образованием параформальдегида. Известно несколько продуктов полимеризации газообразного формальдегида. Один из полимеров формальдегида называется триоксиметилен (СН 2 О) 3. Он имеет температуру плавления 63—64°С. В водных растворах также образуется параформальдегид, относящийся к полиоксиметиленам, которые являются продуктами полимеризации значительно большего числа молекул формальдегида. ПараформаЛьдегид при нагревании, особенно в присутствии кислот, частично деполимеризуется с образованием газообразного формальдегида.
Формальдегид изолируют из биологического материала путем перегонки с водяным паром. Однако этим методом перегоняется только незначительная часть формальдегида. Считают, что формальдегид в водных растворах находится в виде гидрата (метиленгликоля), который трудно отгоняется с водяным паром:
Применение. Действие на организм. Формальдегид широко используется в промышленности для получения пластических масс и фенолоформальдегидных смол, дубления кож, консервирования анатомических препаратов, получения гексаметилентетрамина, синтетического каучука, протравливания зерна, обработки помещений, тары с целью дезинфекции.
Формальдегид проявляет дубящее, антисептическое и дезодорирующее действие., При вдыхании небольших количеств формальдегида он раздражает верхние дыхательные пути. При вдыхании больших концентраций формальдегида может наступить внезапная смерть в результате отека и спазма голосовой щели. При попадании формальдегида в организм через рот могут наступить некротические поражения слизистой оболочки рта, пищевого канала, появляется слюнотечение, тошнота, рвота, понос. Формальдегид угнетает центральную нервную систему, в результате этого может произойти потеря сознания, появляются судороги. Под влиянием формальдегида развиваются дегенеративные поражения печени, почек, сердца и головного мозга. Формальдегид оказывает влияние на некоторые ферменты. 60—90 мл формалина являются смертельной дозой.
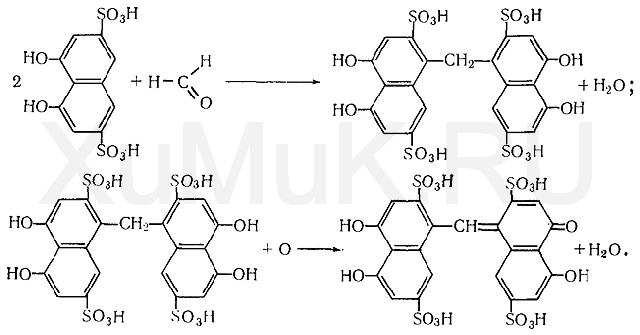
В химико-токсикологическом анализе для обнаружения формальдегида Η—СНО применяют реакции с хромотроповой кислотой, фуксинсернистой кислотой, с раствором кодеина в серной кислоте, с резорцином и др.
Реакция с хромотроповой кислотой. Хромотроповая кислота (1,8-диоксинафталин-3,6-дисульфокислота) с формальдегидом в присутствии серной кислоты дает фиолетовую окраску. При взаимодействии формальдегида с хромотроповой кислотой концентрированная серная кислота одновременно является водо-
отнимающим средством и окислителем. Вначале серная кислота вызывает конденсацию формальдегида с хромотроповой кислотой, а затем окисляет образовавшийся продукт конденсации:
Для успешного протекания указанной выше реакции требуется серная кислота, концентрация которой должна быть не ниже 72 %.
Выполнение реакции. В пробирку вносят 3—5 капель исследуемого раствора или дистиллята, 4 мл 12 н. раствора серной кислоты и несколько кристалликов хромотроповой кислоты, а затем пробирку нагревают в течение 10 мин на водяной бане до 60 °С. При наличии формальдегида в пробе появляется фиолетовая окраска.
Второй вариант реакции. В пробирку вносят 1 мл исследуемого раствора, 0,2 мл 1 %-го раствора хромотроповой кислоты в концентрированной серной кислоте, а затем прибавляют 5 мл концентрированной серной кислоты и взбалтывают. Появление фиолетовой или красно-фиолетовой окраски указывает на наличие формальдегида в исследуемом растворе.
Предел обнаружения: 1 мкг формальдегида в пробе.
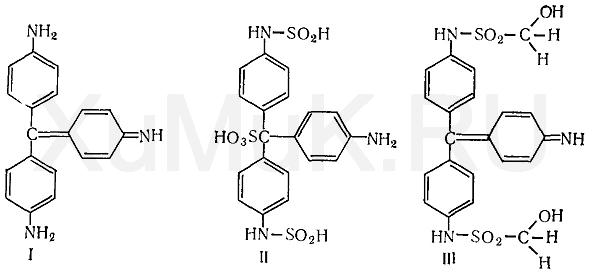
Реакция с фуксинсернистой кислотой. Фуксинсернистая кислота (реактив Шиффа) с формальдегидом дает синюю или сине-фиолетовую окраску.
Для приготовления фуксинсернистой кислоты берут раствор парафуксина (I), имеющий красную окраску, прибавляют водный раствор оксида серы (IV) или пропускают газообразный SO 2. При этом образуется фуксинсернистая кислота (II), не имеющая окраски. Эта кислота с альдегидами образует хиноидный краситель (III) розового цвета:
Выполнение реакции. В пробирку вносят 1 мл исследуемого раствора и 2—3 капли концентрированной серной кислоты. Содержимое пробирки взбалтывают и охлаждают проточной водой, затем прибавляют 1 мл раствора фуксинсернистой кислоты. Появление сине-фиолетовой или красно-фиолетовой окраски указывает на наличие формальдегида.
Раствор иногда окрашивается не сразу, а через 10—15 мин. Окраска может появляться не только под влиянием формальдегида, но и под влиянием окислителей (хлор, оксиды азота, кислород воздуха и др.). Поэтому появление окраски через 30 мин после прибавления реактивов не должно рассматриваться как положительный результат реакции на формальдегид.
Эта реакция не специфична для обнаружения формальдегида. Ее дают ацетальдегид, нитробензальдегид и др. Не дает указанной окраски хлоралгидрат. В сильно кислой среде (рН = 0,7) с фуксинсернистой кислотой реагирует только формальдегид. При рН >= 2,7 с фуксинсернистой кислотой реагирует ацетальдегид, фурфурол и др.
Приготовление реактива (см. Приложение 1, реактив 56).
Выполнение реакции. В пробирку вносят 1 мл исследуемого раствора и 0,5 мл 10 %-го раствора серной кислоты, а затем прибавляют такой же объем раствора метилового фиолетового, обесцвеченного сульфитом или гидросульфитом натрия. При наличии формальдегида в пробе появляется сине-фиолетовая окраска. Эта реакция не специфична для обнаружения формальдегида. Ее дают и некоторые другие альдегиды.
Приготовление реактива (см. Приложение 1, реактив 21).
Реакция с кодеином и серной кислотой. При нагревании формальдегида с кодеином в присутствии концентрированной серной кислоты появляется синяя окраска. Эта реакция основана на том, что под влиянием концентрированной серной кислоты от кодеина отщепляется метоксильная группа, в результате чего
образуется морфин, содержащий фенольную группу. При взаимодействии морфина с формальдегидом появляется синяя окраска.
Выполнение реакции. В фарфоровую чашку вносят 1 мл исследуемого раствора и прибавляют 5 мл концентрированной серной кислоты. После охлаждения жидкости прибавляют 0,02— 0,03 г кодеина. При наличии формальдегида сразу или через 5—10 мин появляется сине-фиолетовая или красно-фиолетовая окраска.
Предел обнаружения: 0,02 мкг формальдегида.
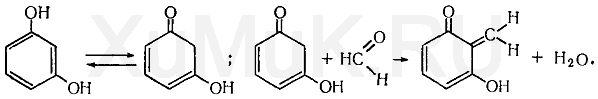
Реакция с резорцином. Альдегиды реагируют с резорцином в его таутомерной форме (кетоформе) с образованием окрашенного соединения:
Выполнение реакции. В пробирку вносят 1 мл исследуемого раствора и 1 мл 1 %-го раствора резорцина в 10 %-м растворе гидроксида натрия. Смесь нагревают в течение 3—5 мин на водяной бане. Появление розовой или малиновой окраски указывает на наличие формальдегида. Эту реакцию дают уксусный альдегид, акролеин, фурфурол и др.
Выполнение реакции. В хорошо очищенную от жира пробирку вносят 5 капель 1 %-го раствора нитрата серебра и по каплям прибавляют 10%-й раствор аммиака до растворения образовавшегося осадка гидроксида серебра. К полученному раствору прибавляют 1 мл исследуемого раствора, а затем смесь осторожно нагревают на пламени горелки. При наличии формальдегида происходит реакция образования «серебряного зеркала». Эта реакция успешно протекает при рН = 8. 9. Нагревание пробирки должно быть умеренным. При высокой температуре «серебряное зеркало» не образуется, а выпадает бурый осадок серебра.
Кроме формальдегида эту реакцию дают и некоторые другие восстанавливающие вещества.
Реакция с реактивом Фелинга. При нагревании реактива Фелинга с формальдегидом выпадает осадок оксида или гидроксида меди. Оксид меди (I) имеет черную окраску. Окраска гидроксида меди (I) зависит от размера частиц. Очень мелкие частицы имеют голубовато-зеленую окраску, а крупные — красную. Поэтому при взаимодействии реактива Фелинга с восстановителями в большинстве случаев выпадает желтый или красный осадок.
В реактиве Фелинга, который представляет собой смесь сульфата меди, щелочи и сегнетовой соли, медь входит в состав комплексного иона:
Выполнение реакции. 1 мл исследуемого раствора вносят в пробирку, в которую прибавляют 1—2 капли 10 %-го раствора гидроксида натрия до щелочной реакции (по лакмусу), а затем прибавляют 2—3 капли реактива Фелинга. Жидкость интенсивно взбалтывают и нагревают на пламени газовой горелки. Образование желтого или красного осадка указывает на наличие формальдегида в исследуемом растворе.
Эта реакция не специфична. Кроме формальдегида ее дают и другие альдегиды алифатического ряда, восстанавливающие сахара и др.
Приготовление реактива (см. Приложение 1, реактив 42).
📽️ Видео
Кач. реакция на альдегиды с фунсинсернистой кислотойСкачать

Химические свойства альдегидов и кетонов. 11 класс.Скачать

Качественная реакция на альдегиды с фуксинсернистой кислотой (Вывод)Скачать

Качественная реакция на альдегиды с фуксинсернистой кислотойСкачать

10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

АльдегидыСкачать

ВСЯ ТЕОРИЯ ПО АЛЬДЕГИДАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать

Альдегиды строение, свойства | Химия 10 класс #28 | ИнфоурокСкачать

Задача на разбавление уксусного ангидрида уксусной кислотой. Органика. Олимпиада.Скачать

Получение уксусного альдегидаСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Задачи по химии. Получение уксусного альдегида. Стехиометрические цепочкиСкачать

10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать

Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

Качественная Реакция На Альдегиды С Гидроксидом Меди.Скачать

Альдегиды и кетоны: свойства, про которые не пишут в учебниках... | Химия ЕГЭ | УмскулСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать