Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
Видео:Химия. 7 класс. Реакции разбавленных кислот с карбонатами /02.02.2021/Скачать  Исследовательская работа «Влияние кислоты на кальций»Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах. Описание презентации по отдельным слайдам:Автор: Приходько Марья Сергеевна ученица 4 «Б» класса МБОУ гимназия № 1 Научный руководитель: Краева Ольга Александровна Исследовательская работа «Влияние кислоты на кальций» Цель: изучить влияние кислоты (на примере уксусной) на кальций, входящий в состав костей и зубов человека. Задачи: узнать всё о кальции и веществах, влияющих на его разрушение; исследовать опытным путём влияние уксуса на яичную скорлупу и куриные косточки; проанализировать полученные результаты. Гипотеза: предположим, что уксусная кислота растворит кальций, входящий в яичную скорлупу и куриные косточки. Роль кальция в организме Кальций является жизненно необходимым для человека элементом. Он является составной частью костного скелета и зубов человека. Чем больше в зубах таких веществ как кальций и фтор, тем крепче они и устойчивее к кариесу. Кальций повышает свёртываемость крови. Обеспечивает нормальное функционирование нервной системы и мышц. С возрастом запасы кальция в костях истощаются. Но затормозить процесс можно и нужно. Для этого надо употреблять каждый день в пищу продукты, богатые кальцием. В каких продуктах содержится кальций? Количество употребляемого кальция детьми в сутки Норма для детей 10-летнего возраста – 7,7 – 8 мг Для проведения опыта № 1 понадобятся: сваренное вкрутую куриное яйцо; банка, в которую можно поместить яйцо целиком; столовый уксус 9%. Опускаем яйцо в ёмкость Заливаем его полностью уксусом На поверхности яйца моментально появляются крошечные пузырьки. Это выделяется углекислый газ, потому что уксусная кислота реагирует с карбонатом кальция, из которого состоит яичная скорлупа. Через три дня достаём яйцо, промываем водой и наблюдаем, что скорлупа растворилась, осталась только плёнка между скорлупой и яйцом. Вывод: уксусная кислота разрушает кальций. Скорлупы нет. Попробуем надавить на яйцо. Яйцо стало упругим как резина и им можно играть как мячиком. Для проведения опыта № 2 понадобятся: куриные косточки; банка, в которую можно поместить косточки целиком; столовый уксус 9% (уксусная кислота). Опускаем косточки в ёмкость Заливаем косточки уксусом и оставляем на три дня Достаём косточки, промываем водой и пробуем их согнуть. Косточки стали мягкими, эластичными, как бы резиновыми. Вывод: уксусная кислота разрушает кальций. Наши рекомендации У детей растущий организм. Если в пищу регулярно будет поступать уксусная кислота с маринованными продуктами и майонезом, будет происходить разрушение кальция. Кости могут потерять твердость, что может привести к искривлению конечностей и не прочности зубной эмали. Для поддержания количества кальция нужно употреблять молочные продукты каждый день. Мы рекомендуем детям и взрослым людям майонез по возможности заменить сметаной. Маринованные овощи употреблять в небольших количествах. Будьте здоровы. Спасибо за внимание! Курс повышения квалификации Охрана труда
Курс профессиональной переподготовки Охрана труда
Курс профессиональной переподготовки Библиотечно-библиографические и информационные знания в педагогическом процессе
Ищем педагогов в команду «Инфоурок» Видео:Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать  Дистанционные курсы для педагогов«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни» Свидетельство и скидка на обучение каждому участнику Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:5 577 936 материалов в базе Самые массовые международные дистанционные Школьные Инфоконкурсы 2022 33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок» Другие материалы
Вам будут интересны эти курсы:Оставьте свой комментарийАвторизуйтесь, чтобы задавать вопросы. Добавить в избранное
Настоящий материал опубликован пользователем Краева Ольга Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал. Автор материала
Московский институт профессиональной Видео:Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать  Дистанционные курсы | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
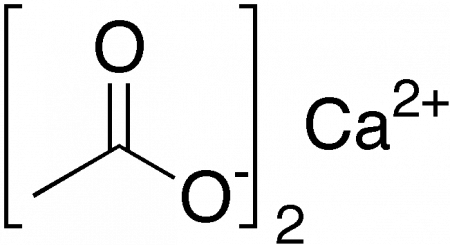
| Ацетат кальция | |
|---|---|
 | |
| Систематическое наименование | Ацетат кальция |
| Сокращения | Ca(OAc)2 |
| Традиционные названия | Пригорело-древесная соль |
| Хим. формула | Ca(CH3COO)2 |
| Рац. формула | CaC4H6O4 |
| Состояние | твёрдое |
| Молярная масса | 158.138 г/моль |
| Плотность | 1.6 г/см³ |
| Температура | |
| • плавления | 160 (с разложением) |
| • разложения | 160 ± 1 °C |
| Растворимость | |
| • в воде | 40 г/100 мл |
| Рег. номер CAS | 62-54-4 |
| PubChem | 6116 |
| Рег. номер EINECS | 200-540-9 |
| SMILES | |
| Кодекс Алиментариус | E263 |
| RTECS | AF7525000 |
| ChEBI | 3310 |
| ChemSpider | 5890 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат кальция — кальциевая соль уксусной кислоты. Бесцветное кристаллическое или аморфное вещество, хорошо растворимое в воде. Технический моногидрат может быть в форме гранул или некрупных игл. Обладает слабым вкусом и запахом уксуса. Химическая формула — Ca(CH3COO)2, однако чаще получают его моногидрат Ca(CH3COO)2•H2O.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Содержание
- 1 История названия
- 2 Получение
- 3 Применение
- 3.1 Пищевая промышленность
- 4 Медицина
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

История названия
Пригорело-древесная соль — старинное название ацетата кальция — в старину получалась при сухой перегонке древесины, из-за чего древесина, естественно, обугливалась, «пригорала». Из-за того, что метод сухой перегонки древесины использовался алхимиками с незапамятных времён, установить человека, давшего такое название этой соли или впервые получившего её, невозможно.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение
В лаборатории получают действием уксусной кислоты на карбонат, оксид или гидроксид кальция.
Видео:Взаимодействие уксусной кислоты с металламиСкачать

Применение
Не имеет промышленного применения.
Используется в лаборатории для получения диметилкетона (ацетона). Эту реакцию осуществляют, нагревая ацетат кальция до 160 °С:
Именно из-за этой реакции ацетат кальция нельзя хранить или сушить вблизи открытого огня, а помещения, в которых происходят работы с ацетатом кальция, должны быть оборудованы приточно-вытяжной вентиляцией.
Также может применяться в лаборатории для получения сложных эфиров уксусной кислоты — алкилацетатов:
Также ацетат кальция используется для получения ацетата калия обменными реакциями из карбоната и/или бикарбоната калия:
Также ацетат кальция применяют при получении лавсана в качестве катализатора.
Ещё одним способом применения ацетата кальция является приготовление аналога сухого спирта — твёрдого спиртового сольвата ацетата кальция — при смешивании ацетата кальция и этилового спирта.
Пищевая промышленность
Ацетат кальция зарегистрирован в пищевой промышленности в качестве пищевой добавки группы консервантов E263. Может применяться как консервант, регулятор кислотности, уплотнитель растительных тканей. Останавливает развитие болезнетворных бактерий в хлебобулочных изделиях, смягчает ярко выраженный кислый вкус консервированных овощей и фруктов. В сельскохозяйственной промышленности используется для консервации кормов. Так как действие ацетата кальция ограничено наличием в продуктах сульфатов, фосфатов, карбонатов и гидрокарбонатов, которые в конечном итоге дают осадки с катионом Ca 2+ , то применять его лучше в сочетании с другими консервантами.
| Массовая доля основного вещества,безводная форма, %, не менее | 98 |
| Потери при просушке, %, не более | 11 |
| pH 10%-го водного раствора | 6-9 (включительно) |
| Массовая доля нерастворимых веществ, %, не более | 0,3 |
Видео:Реакция КАЛЬЦИЯ и УКСУСНОЙ КИСЛОТЫ. Химические опыты.Chemical experiment with acid.Эксперименты домаСкачать

Медицина
Ацетат кальция оказывает абсорбирующее действие на анионы фосфорных кислот:
Также ацетат кальция восстанавливает положительный кальциевый баланс у больных с почечной недостаточностью в легкой, средней и тяжелой форме и у больных, находящихся на гемодиализе или перитонеальном диализе. Является безалюминиевым и безмагниевым фосфат-связывающим препаратом (фосфат-биндером). Фосфат-связывающая способность ацетата кальция в 2 раза выше, а всасываемость его в кишечнике значительно меньше, чем у кальция карбоната.
🌟 Видео
Взаимодействие уксусной кислоты с карбонатом кальция | ЕГЭ по химииСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Взаимодействие карбоната кальция с соляной кислотой I ЕГЭ по химииСкачать

РЕШЕНИЕ ЗАДАЧИ. ВЗАИМОДЕЙСТВИЕ КАРБОНАТА КАЛЬЦИЯ С УКСУСНОЙ КИСЛОТОЙСкачать

Практическая работа.Получение и свойства уксусной кислоты.Скачать

Химия, 12-й класс, Практическая работа № 1 Химические свойства уксусной кислотыСкачать

11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Реакция магния с уксусной кислотойСкачать

Реакция уксусной кислоты с карбонатом натрияСкачать

Задача на разбавление уксусного ангидрида уксусной кислотой. Органика. Олимпиада.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать








