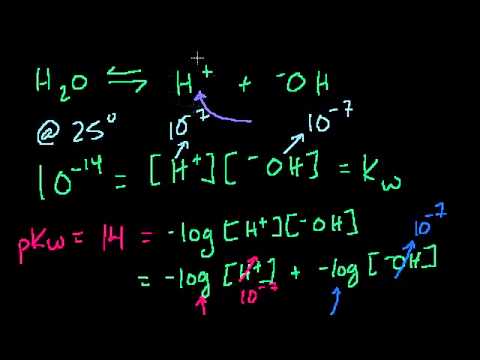- § 7.2. Слабые кислоты и основания
- Электролитическая диссоциация
- Степень диссоциации
- Классификация электролитов
- Диссоциация электролитов
- Константа диссоциации
- Примеры решения задач
- Задачи для самостоятельного решения
- Как правильно рассчитать константу диссоциации слабого электролита
- 1. Вычисление степень диссоциации уксусной кислоты
- 2. Вычисление константы диссоциации уксусной кислоты
- 1. Вычисление концентрацию муравьиной кислоты
- 2. Вычисление константы диссоциации НСООН
- 1. Вычисление константы диссоциации (CH3)2NH
- 1. Вычисление степень диссоциации этановой кислоты
- 2. Вычисление константы диссоциации этановой кислоты
- 📽️ Видео
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК


Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3/2004
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

§ 7.2. Слабые кислоты и основания
Если вы будете заниматься исследовательской работой, вам понадобится знание среды раствора и его рН. Сейчас вы познакомитесь с растворами слабых электролитов, узнаете, как рассчитать рН раствора, зная концентрацию соли и константу равновесия диссоциации слабого электролита.
Расчет концентрации ионов водорода и гидроксид-ионов в растворах слабых кислот и слабых оснований несколько сложнее, чем расчет для сильных кислот и оснований (щелочей), и проводится с использованием констант их диссоциации.
Уксусная кислота – слабый электролит и в очень незначительной степени диссоциирует по уравнению:
Константа диссоциации (равновесия) К уксусной кислоты:
Учитывая, что в растворе уксусной кислоты концентрации ионов водорода и ацетат-ионов равны, т.е. [СН3СОО – ] = [Н + ], а сама она – слабый электролит и поэтому в состоянии диссоциации находится лишь малая часть ее молекул, концентрацию непродиссоциировавших молекул СН3СООН можно считать равной концентрации кислоты скисл. Тогда получаем:
Пример. Константа диссоциации уксусной кислоты (данные справочника) равна:
Ккисл = 1,86•10 –5 . Требуется рассчитать концентрацию ионов водорода и рН в 0,1М и 0,01М растворах уксусной кислоты.
Для 0,1М раствора имеем:
рН = –lg (1,36•10 –3 ) = 2,87.
Посмотрим, как скажется на концентрации ионов водорода и рН раствора разбавление в 10 раз.
Для 0,01М раствора имеем:
рН = –lg (4,31•10 –4 ) = 3,37.
Разбавление уксусной кислоты в 10 раз привело к понижению концентрации ионов водорода в 1,36•10 –3 /4,31•10 –4 = 3,1 раза, при этом рН повысился на 3,37 – 2,87 = 0,5 единицы рН.
Вспомните, как изменится концентрация ионов водорода и рН при разбавлении в 10 раз 0,1М раствора соляной кислоты.
Аналогично определяют концентрацию ионов водорода и рН раствора гидроксида аммония:
NH4OH = 
константа диссоциации которого равна Косн = 1,79•10 –5 . Сначала рассчитывают концентрацию гидроксид-ионов:
и рОН. затем – концентрацию ионов водорода:
и определяют рН = 14 – рОН. В 0,01М растворе гидроксида аммония рН = 10,6. Проверьте.
Если в растворе сильной кислоты или сильного основания увеличить концентрацию одноименного иона введением соответствующей соли, например в раствор НСl или NаОН добавить хлорид натрия NаCl, то концентрации ионов водорода или гидроксид-ионов практически не изменяются. Если же такую операцию, т. е. увеличение концентрации одноименного иона, провести с раствором слабой кислоты или слабого основания, то наблюдается резкое изменение рН раствора.
Рассмотрим, как изменится рН раствора уксусной кислоты при введении в раствор ацетата натрия NаСН3СОО, т. е. одноименного ацетат-иона СН3СОО – .
Согласно принципу Ле Шателье равновесие реакции диссоциации
сместится влево в результате увеличения концентрации ацетат-ионов СН3СОО – , образующихся при полной диссоциации ацетата натрия как сильного электролита. Такое смещение равновесия диссоциации уксусной кислоты означает уменьшение концентрации ионов водорода, т. е. увеличение рН раствора.
Пример. Рассчитать рН 0,01М раствора уксусной кислоты, содержащей 0,01 моль/л ацетата натрия NаСН3СОО.
В выражении константы равновесия
концентрация ацетат-ионов определяется в основном концентрацией хорошо диссоциирующей соли NаСН3СОО. Поэтому можно записать:
Из этого соотношения находим концентрацию ионов водорода:
Таким образом, в результате введения в 1 л 0,01М раствора уксусной кислоты 0,01 моль
NаСН3СОО концентрация ионов водорода уменьшилась в 23 раза (4,31•10 –4 /1,86•10 –5 = 23), а значение рН возросло на 1,36 (4,73 – 3,37 = 1,36) единицы (значение рН = 3,37 из предыдущего примера).
Аналогично при введении в раствор слабого основания NН4ОН хлорида аммония NH4Cl положение равновесия диссоциации гидроксида аммония смещается в менее основную область и среда раствора становится более кислотной:
Следовательно, одноименный ион (за исключением иона водорода и гидроксид-иона), введенный в раствор слабой кислоты или слабого основания, изменяет рН таким образом, что среда раствора приближается к нейтральной. Одноименные ионы в такого типа системах ведут себя как нейтрализующие агенты: анион нейтрализует слабую кислоту, выполняя роль основания, а катион нейтрализует слабое основание, выполняя роль кислоты. Такое необычное, с нашей точки зрения, поведение веществ характерно для многих явлений природы, показывая нам всеобщую связь и взаимозависимость объектов окружающего нас мира и нас самих от него.
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Электролитическая диссоциация
Материалы портала onx.distant.ru
Примеры решения задач
Задачи для самостоятельного решения
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Видео:Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать

Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные) . Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциаты образуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К + , Cl — , а также возможно образование ионных пар (К + Cl — ), ионных тройников (K2Cl + , KCl2 — ) и ионных квадруполей (K2Cl2, KCl3 2- , K3Cl 2+ ).
- Комплексные соединения (как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4] 2+ , [Fe(CN)6] 3+ , [Cr(H2O)3Cl2] + .
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура t, о С | Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Видео:Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H + + Cl —
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na + + OH —
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na + + HSO3 —
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3 — → H + + SO3 2-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH + + Cl —
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH + → Mg 2+ + OH —
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6] 3- → Fe 3+ + 6CN —
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Константа диссоциации
При растворении слабого электролита К А в растворе установится равновесие:
КА ↔ К + + А —
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации :
Kд = [К + ] · [А — ] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н + больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10 — 4 , а К(HCN) = 4,9·10 — 10 .
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α 2· с)/(1-α) (3)
Для практических расчетов при условии, что α
Кд = α 2· с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT 0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Видео:Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
Следовательно, концентрации ионов К + и РО4 3- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН — (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10 — 5 .
Решение. Уравнение диссоциации электролита:
Концентрации ионов: [NH4 + ] = α С ; [OH — ] = α С , где С – исходная концентрация NH 3 ·H 2 О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Кд ≈ α 2 С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH 3 ·H 2 О . Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √( Кд / С) = √(1,76× 10 — 5 / 0,03 ) = 0,024 или 2,4 %
[OH — ] = αС, откуда [OH — ] = 2,4·10 — 2 ·0,03 = 7,2·10 -4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО — + Н + .
α = [Н + ] / Сисх(CH3CОOH)
откуда [Н + ] = 9,4·10 — 2 ·0,002 = 1,88·10 -4 М.
Kд = [Н + ] 2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2 С .
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10 — 4 . Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд = α 2 С , откуда получаем С исх (HNO 2 ) = 4,6·10 — 4 /(5·10 — 2 ) 2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н + и СООН — в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н + | СООН — |
| ΔGT 0 , кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT 0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT 0 /RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10 — 4 .
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3















![Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])](https://i.ytimg.com/vi/joRCWgvvlXs/0.jpg)