Видео:Гидролиз солей. 9 класс.Скачать

Теория к заданию 23 из ЕГЭ по химии
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греч. hydro — вода, lysis — распад, разложение).
Гидролиз — это реакция обменного разложения вещества водой.
Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Водные растворы солей имеют разные значения рН и различные типы сред — кислотную ($рН 7$), нейтральную ($рН = 7$). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов $Н^$ или $ОН^$, и раствор соли становится кислотным или щелочным соответственно.
Классификация солей
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль $KClO$ образована сильным основанием $KOH$ и слабой кислотой $HClO$.
В зависимости от силы основания и кислоты можно выделить четыре типа солей.
Рассмотрим поведение солей различных типов в растворе.
1. Соли, образованные сильным основанием и слабой кислотой.
Например, соль цианид калия $KCN$ образована сильным основанием $KOH$ и слабой кислотой $HCN$:
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения
2) полная диссоциация соли (сильного электролита):
Образующиеся при этих процессах ионы $Н^$ и $CN^$ взаимодействуют между собой, связываясь в молекулы слабого электролита — цианистоводородной кислоты $HCN$, тогда как гидроксид — ион $ОН^$ остается в растворе, обусловливая тем самым его щелочную среду. Происходит гидролиз по аниону $CN^$.
Запишем полное ионное уравнение происходящего процесса (гидролиза):
Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), т.к. вода — значительно более слабый электролит, чем цианистоводородная кислота $HCN$.
Уравнение показывает, что:
а) в растворе есть свободные гидроксид-ионы $ОН^$, и концентрация их больше, чем в чистой воде, поэтому раствор соли $KCN$ имеет щелочную среду ($рН > 7$);
б) в реакции с водой участвуют ионы $CN^$, в таком случае говорят, что идет гидролиз по аниону. Другие примеры анионов, которые участвуют в реакции с водой:
| $HCOO^, CH_3COO^, NO_2^$ | от слабых кислот — муравьиной $HCOOH$, уксусной $CH_3COOH$, азотистой $HNO_2$ |
| $S^, CO_3^, SO_3^, PO_4^$ | от слабых кислот — сероводородной $H_2S$, угольной $H_2CO_3$, сернистой $H_2SO_3$, ортофосфорной $H_3PO_4$ |
Рассмотрим гидролиз карбоната натрия $Na_2CO_3$.
Происходит гидролиз соли по аниону $CO_3^$.
Полное ионное уравнение гидролиза:
Сокращенное ионное уравнение гидролиза:
Продукты гидролиза — кислая соль $NaHCO_3$ и гидроксид натрия $NaOH$.
Среда водного раствора карбоната натрия — щелочная ($рН > 7$), потому что в растворе увеличивается концентрация ионов $ОН^$. Кислая соль $NaHCO_3$ тоже может подвергаться гидролизу, который протекает в очень незначительной степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по аниону:
а) по аниону соли, как правило, гидролизуются обратимо;
б) химическое равновесие в таких реакциях сильно смещено влево;
в) реакция среды в растворах подобных солей щелочная ($рН > 7$);
г) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
2. Соли, образованные сильной кислотой и слабым основанием.
Рассмотрим гидролиз хлорида аммония $NH_4Cl$.
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
2) полная диссоциация соли (сильного электролита):
Образующиеся при этом ионы $OH^$ и $NH_4^$ взаимодействуют между собой с получением $NH_3·H_2O$ (слабый электролит), тогда как ионы $Н^$ остаются в растворе, обусловливая тем самым его кислотную среду.
Полное ионное уравнение гидролиза:
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, т.к. вода $Н_2О$ — значительно более слабый электролит, чем гидрат аммиака $NH_3·H_2O$.
Сокращенное ионное уравнение гидролиза:
Уравнение показывает, что:
а) в растворе есть свободные ионы водорода $Н^$, и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду ($рН 7)
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма. Например, в состав крови входят соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды. Это происходит за счет смещения равновесия процессов гидролиза:
Если в крови избыток ионов $Н^$, они связываются с гидроксид-ионами $ОН^$, и равновесие смещается вправо. При избытке гидроксид-ионов $ОН^$ равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно.
Другой пример: в составе слюны человека есть ионы $HPO_4^$. Благодаря им в полости рта поддерживается определенная среда ($рН=7-7.5$).
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
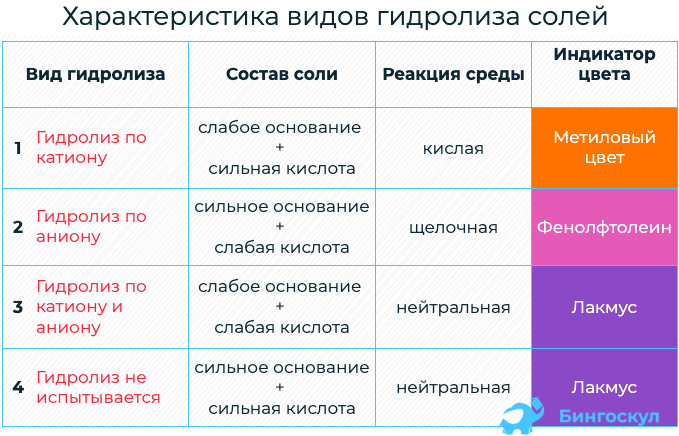
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
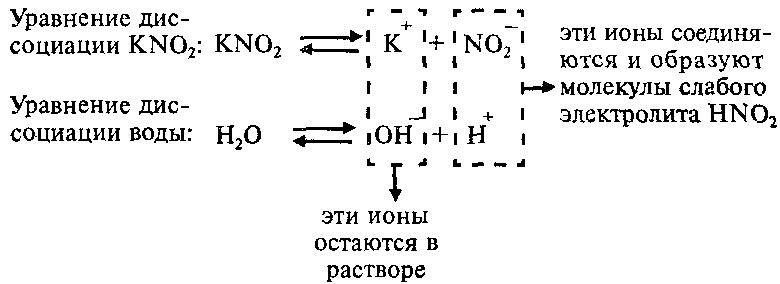
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
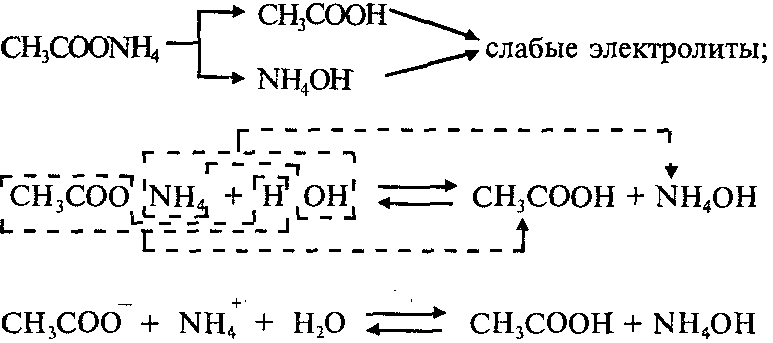
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
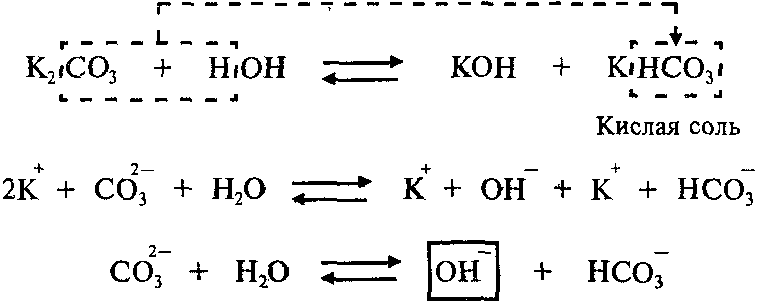
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Видео:Химия ЕГЭ 2019. Задание № 23. Гидролиз солей. Среда водных растворов кислая, нейтральная, щелочнаяСкачать

Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Содержание:
Гидролиз – самый распространенный химический процесс на нашей Земле, определяющий наличие жизни на нашей планете. В результате гидролиза образуются вещества, которые определяют основной химический состав жидкостей во всех живых системах: крови, плазме, тканевой жидкости. Благодаря гидролизу между мембранами клеток функционирует натрий – калиевый насос и регулируется количество основных ионов Na + и K + .
Самый известный на Земле растворитель – вода. Почти все органические и неорганические соединения готовы растворяться в водном растворе.
По химическим свойствам H2O слабый электролит, плохо разлагающийся на ионы. Для водного раствора свойственна нейтральная среда. В данной среде концентрация ионов водорода и гидроксид-ионов равны.
Растворяя всевозможные вещества в воде, возможно получить различные концентрации ионов H + и OH — . Это будет находиться в зависимости от природы вещества и степени его диссоциации.
В зависимости от этого различают слабые и сильные электролиты. К сильным электролитам относятся растворимые соли, кислоты и щелочи.
Соли в водных растворах не просто растворяются, а разлагаются на ионы. Подобный процесс получил название гидролиза.
Состав солей определяется кислотой и основанием, их степенью диссоциации и химическими свойствами. Кислоты и основания могут быть сильными и слабыми.
В зависимости от состава органические вещества относятся к разной степени гидролизуемых веществ: чем выше ионизация в молекуле, тем большему гидролизу подвергается вещество.
Сила электролита
Основание
Кислота
Растворимые основания или щелочи, например:
- гидрооксид натрия – NaOH,
- гидрооксид калия – КОН,
- гидрооксид бария – Ba(OH)2
- и т.д.
- соляная – HCl
- бромоводородная – HBr
- йодоводородная – HI
- азотная — HNO3
- серная – H2SO4
Нерастворимые основания и гидрооксид аммония NH4OH. Hапример:
- гидрооксид алюминия – Al(OH), гидрооксид калия – КОН,
- гидрооксид бария – Ba(OH)2
- и т.д.
- фтороводородная – HF
- сероводородная – H2S
- азотистая – HNO2
- сернистая – H2SO3
- угольная – H2CO3
- ортофосфорная – H3PO4
- кремниевая – H2SiO3
- уксусная – CH3COOH
В зависимости от состава соли определяется тип гидролиза, свойственный для данного вида.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Типы гидролиза солей
- Для солей, которые включают слабое основание и сильную кислоту, свойственен гидролиз по катиону.
К примеру CuCl2, — это средняя соль. Состав представлен слабым основанием Cu(OH)2 (нерастворимым в воде) и сильной кислотой HCl.
Все растворимые соли считаются сильными электролитами, вследствие этого при растворении в воде всецело диссоциируют на ионы.
Раствор представляет собой частичную диссоциацию молекулы воды и абсолютное разложение на ионы хлорида меди (II). OH — анионы объединяются с катионом Cu 2+ и образуют нерастворимое соединение, которое не диссоциирует на ионы. Ионы H + и Cl — связываются в молекулу сильного электролита – соляную кислоту. В итоге получается накопление в растворе ионов H + , которые обеспечивают, кислую реакцию среды раствора и изменение цвета индикаторов. Индикатор может быть метиловым оранжевым. В нейтральной среде имеет оранжевый цвет, в кислой окрашивается в красный.
Представляем процесс в виде уравнений реакции:
1) Cu 2+ + H2O = Cu(OH)2 ↓ + 2H + — сокращенное ионное уравнение
2) Cu 2+ + 2Cl — + 2H2O = Cu(OH)2 ↓ + 2H + + 2Cl — — полное ионное уравнение
3) CuCl2 + 2H2O = Cu(OH)2 ↓ + 2HCl— молекулярное уравнение реакции
Для солей, которые включают сильное основание и слабую кислоту, характерен гидролиз по аниону.
К примеру, Na2CO3 представляет собой соль, образованную сильным основанием NaOH (водорастворимым) и слабой кислотой H2CO3.
Когда карбонат натрия растворяется в воде, он полностью распадается на ионы, а молекулы воды отчасти диссоциируют на ионы. В итоге процесса гидролиза ионы Na + и OH — объединяются и получается сильный электролит гидроксид натрия. В растворе накапливается избыточное общее количество гидроксильных анионов OH — , которые свойственны для щелочной реакции среды. Катионы H + и анионы CO3 2- образуют слабую углекислоту, которая в растворе распадается на воду и углекислый газ.
Составляем уравнение гидролиза:
1) CO3 2- + H2O = 2OH — + H2O + CO2 ↑ — сокращенное ионное уравнение
2) 2Na + + CO3 2- + 2H2O = 2Na + + 2OH — + CO2 ↑ — полное ионное уравнение
3) Na2CO3+ 2H2O = 2NaOH + H2CO3 — молекулярное уравнение реакции
Углекислота очень слабая, в растворе распадается на H2O и CO2.
Уравнение будет выглядеть так:
Гидролиз по катиону и аниону характерен для солей, которые состоят из слабого основания и слабой кислоты.
Например, (NH4)2S представляет собой среднюю соль, образованную слабым основанием NH4OH и слабой кислотой H2S.
При растворении сульфида аммония в водном растворе происходит образование малодиссоциирующих веществ-гидроксида аммония и сероводорода. В растворе остаются лишь только молекулы воды, растворная среда станет нейтральной.
Составляем уравнение гидролиза:
1) (NH4)2S + H2O = 2NH3 ↑ + H2O +H2S↑ — молекулярное уравнение реакции
2) Полное и сокращенное ионные уравнения отсутствуют
Гидролизу не подвергается соль, состоящая из сильного основания и сильной кислоты.
Например, BaCl2 представляет собой соль, образованную сильным основанием Ba(OH)2 (водорастворимым) и сильной кислотой HCl.
Представленный тип солей не содержит кислотных остатков и катионов металлов, реагирующих с водой, т. е. способных влиять на РН водного раствора. Консистенции таких солей имеют нейтральную реакционную среду. В процессе растворения в воде образуются сильные электролиты, полностью распадающиеся на ионы.
Процессы диссоциации и гидролиза считаются обратимыми и подчиняются совокупным закономерностям смещения химического равновесия. Данные процессы возможно усиливать и замедлять, добавляя в раствор одноименный ион, разбавляя раствор или же нагревая его.
Для составления уравнений гидролиза солей существует конкретный алгоритм:
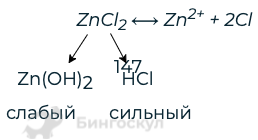
- Запишите формулу соли и определите ее растворимость в воде, применяя таблицу растворимости солей, кислот и оснований в воде.
- ZnCl2 растворимый в воде
- В случае если соль растворима, составьте уравнение диссоциации
- ZnCl2⟷ Zn 2+ + 2Cl —
- Определите состав соли
- Сделайте вывод, какой из ионов соли подвергается гидролизу:
- Zn 2+ — ион, образующий слабый электролит, поэтому он подвергается гидролизу.
В данном случае гидролиз проходит по катиону.
- Zn 2+ + 2H2O = Zn(OH)2↓ +2H +
- В данном случае среда является кислой.
- Zn 2+ + 2Cl — + 2H2O = Zn(OH)2↓ +2H + + 2Cl-
- ZnCl2 + 2H2O = Zn(OH)2↓ + 2HCl
📹 Видео
Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Гидролиз солей. 1 часть. 11 класс.Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Константа гидролиза и pH водного раствора солиСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Электролиз. 10 класс.Скачать

Гидролиз солей и среда водных растворов веществ, Задание 21 | ЕГЭ по химии 2024Скачать

11 класс. Гидролиз солей.Скачать

Химия 8 класс: Гидролиз солейСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

ГИДРОЛИЗ и определение СРЕДЫ РАСТВОРОВ! НОВОЕ 21 задание в ЕГЭ по ХИМИИ 2022Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

РТ по химии 2 этап | 2023-2024 | Полный разборСкачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать