Видео:Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Ваш ответ
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

решение вопроса
Видео:Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Похожие вопросы
- Все категории
- экономические 43,399
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,960
- разное 16,854
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Уравнение Ван дер ВаальсаСкачать

Уравнения состояния реальных газов
Вопрос №1
Идеальный газ. Законы идеальных газов
Идеальным называется газ, у которого объемы молекул бесконечно малы и отсутствуют силы межмолекулярного взаимодействия. Молекулы идеального газа представляют собой материальные точки, взаимодействие между которыми ограничено молекулярными соударениями.
Любой реальный газ тем ближе к идеальному, чем ниже его давление и выше температура. Например, окружающий нас воздух можно считать идеальным газом. Понятие идеального газа и законы идеальных газов полезны в качестве предела законов реального газа.
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
На практике часто приходится иметь дело с газами при невысоких давлениях, поэтому расчеты различных термодинамических процессов с достаточной степенью точности можно проводить по уравнениям идеального газа.
Закон Авогадро
Согласно этому закону, все газы при одинаковых температурах и одинаковом давлении содержат в одном и том же объеме одинаковое число молекул. Большую техническую значимость имеет следствие из закона Авогадро: объемы киломолей различных газов равны, если они находятся при одинаковых температурах и давлениях. При нормальных физических условиях (Т= 273,15 К, р = 760 мм рт. ст.) объем киломоля любого вещества равен Vµ=µν=22,4 м 3 /кмоль.Напомним, что киломолем называется количество вещества в килограммах, численно равное его молекулярной массе.
Этот закон был открыт независимо друг от друга английским физиком Р. Бойлем и французским ученым Э. Мариоттом. Ими было доказано, что при постоянной температуре газа произведение давления газа на его объем есть величина постоянная, т.е. при
рV= const и рv = const.
Закон Гей-Люссака
Этот закон устанавливает, что если в процессе нагрева или охлаждения газа давление подцерживается постоянным, то объем изменяется пропорционально абсолютной температуре, т.е. если
Р = const, то и v/ Т = const.
Если же мы рассмотрим процесс нагрева или охлаждения газа в сосуде постоянного объема (v= const), то р/Т = const.
Уравнение состояния идеального газа
Для 1 кг газа Клапейроном установлено уравнение состояния рv = RT, в котором газовая постоянная Rимеет для каждого газа свое постоянное значение. Измеряется Rв Дж/кг-К и имеет вполне определенный физический смысл — это работа, совершаемая 1 кг газа при его нагреве на один кельвин при постоянном давлении. Для газа с произвольной массой M/(кг) уравнение состояния имеет вид
Для одного киломоля вещества уравнение состояния (получено Д.И. Менделеевым) имеет вид рVµ =µRT, где µR— универсальная газовая постоянная, которая одинакова для всех газов и равна 8314 Дж/кмольК.
Во всех этих уравнениях давление подставляется в Па, температура — в К, объем — в м 3 и удельный объем — в м 3 /кг.
В резервуаре объемом 10 м 3 находится азот при избыточном давлении 100 кПа и при температуре 27 °С. Атмосферное давление равно 750 мм рт. ст. Требуется найти массу и плотность азота.
Выразим атмосферное давление в паскалях: рб = 10 5 Па.
Абсолютное давление газа равно:p =ри +рб = 100 • 10 3 + 10 5 = = 2 • 10 5 Па.
Газовая постоянная азота равна (µ = 28 кг/кмоль)
R = 8314/28 = 297 Дж/кгЧК. Масса газа равна
М =рV/RT= 2*10 5* 10/297 • (273,15 + 27) = 22,43 кг.
р = M/V= 22,43/10 = 2,243 кг/м 3 .
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
РЕАЛЬНЫЕ ГАЗЫ
Свойства реальных газов
Свойства реальных газов значительно отличаются от свойств идеальных газов, причем отличия тем значительнее, чем выше давление и ниже температура газа. Это объясняется тем, что молекулы реальных газов имеют конечный объем и между ними существуют силы межмолекулярного взаимодействия. Уравнение состояния 1 кг реального газа имеет вид
где z= φ(р, T) — коэффициент сжимаемости, который может быть как больше, так и меньше единицы.
При проведении термодинамических расчетов с реальными газами нужно учитывать зависимость внутренней энергии, энтальпии и теплоемкости не только от температуры, но и от давления газа. При одном и том же давлении какое-либо вещество в зависимости от температуры может находиться в разных состояниях.
Из физики известно, что любое вещество может находиться в твердом, жидком или газообразном состоянии. Эти состояния будем называть фазами, а процесс перехода из одного состояния в другое — фазовым переходом.
При определенных условиях могут существовать одновременно две фазы вещества, например, лед и жидкость, пар и жидкость. Если пар и жидкость находятся в состоянии равновесия, то пар называется насыщенным.
У всех веществ фазовые переходы происходят при определенных физических параметрах, поэтому рассмотрение свойств реальных газов можно начать на примере вещества, которое является основным рабочим телом в циклах тепловых электростанций, в том числе и атомных. Этим рабочим телом является вода, и не только потому, что она относительно дешева и нетоксична, а потому, что она обладает благоприятными для работы термодинамическими свойствами.
Рассмотрим диаграмму «v—p» воды и водяного пара, на которой изобразим границы между фазами (рис. 1.1). В области а находится в равновесии смесь льда и некипящей воды, в области Ь находится некипящая вода, в области с находится смесь кипящей воды и водяного пара, в области d— перегретый водяной пар. Прямой 1-2 показан изобарный процесс подвода теплоты.
Показанные на рис. 1.1 кривые называются пограничными; кривые, ограничивающие с двух сторон область с, называются левой и правой пограничными кривыми. Им соответствуют кипящая вода (левой) и сухой насыщенный пар (правой). Область между этими кривыми называется областью влажного насыщенного пара — в этой области находятся в равновесии сухой насыщенный пар и кипящая вода. Смесь сухого насыщенного пара и кипящей воды называют влажным насыщенным паром. Масса влажного насыщенного пара равна
где М’ — масса кипящей воды и М» — масса сухого насыщенного пара.
В дальнейшем все параметры, относящиеся к кипящей жидкости, будут иметь индекс «штрих» (р’, h’и т.д.), а все параметры, относящиеся к сухому насыщенному пару,— индекс «два штриха» (р’, h» и т.д.).
Температуру и давление насыщенного пара принято обозначать Тн и рн. В то же время в ряде литературных источников их обозначают Тs и рs (буква s является первой буквой английского слова sаturation — насыщение). Отношение массы сухого насыщенного пара к общей массе влажного насыщенного пара называется степенью сухости и обозначается х. Ясно, что на левой пограничной кривой х = 0, а на правой — х = 1. Разность <1-х) называется степенью влажности.
Чем выше давление пара, тем меньше расстояние по горизонтали между левой и правой пограничными кривыми, а при определенном давлении пара эти кривые смыкаются. Точка, в которой исчезают различия в свойствах кипящей жидкости и сухого насыщенного пара, называется критической (точка к на рис. 1.1).
Термические параметры различных веществ в критической точке различны. Эти параметры для ряда химических веществ приведены в табл. 1
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
Таблица 1 Критические параметры веществ
| Вещество | Tкр, К | pкр,МПа | ρкр, кг/м 3 |
| Азот N2 | 3,40 | ||
| Водород Н2 | 33,2 | 1,29 | |
| Водяной пар H2O | 647,12 | 22,115 | |
| Кислород О2 | 5,05 | ||
| Ртуть Нg | — | ||
| Диоксид углерода СО2 | 7,38 |
При сверхкритическом давлении не может быть влажного насыщенного пара. Если давление пара больше критического и постоянно по величине (р > ркр), то при подводе (или отводе) теплоты физические параметры (удельный объем, энтальпия и др.) меняются плавно, в то же время наблюдается резкое изменение тепло-емкостей сp исvв тех процессах, где сверхперегретая вода переходит в сверхперегретый водяной пар.
Уравнения состояния реальных газов
Известно значительное число уравнений состояния реальных газов, и одна из самых удачных попыток была сделана Ван-дер-Ваальсом, который получил уравнение в виде
Слагаемое a/v 2 учитывает внутреннее давление, обусловленное силами взаимодействия молекул газа, а величина b— уменьшение объема, в котором движутся молекулы реального газа. Если по этому уравнению находить величины удельных объемов реальных газов, то уравнение (1) имеет три действительных корня при Т Ткр . Точность вычислений по этому уравнению невелика.
В самой общей форме уравнение состояния реальных газов имеет вид
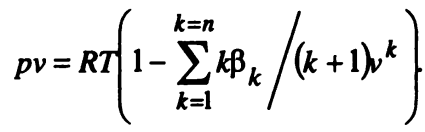
где 𝛽k — вириальные коэффициенты, зависящие от температуры газа.
Число членов ряда в уравнении (2) может быть достаточно велико, поэтому расчеты по этому уравнению вызывают значительные трудности.
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
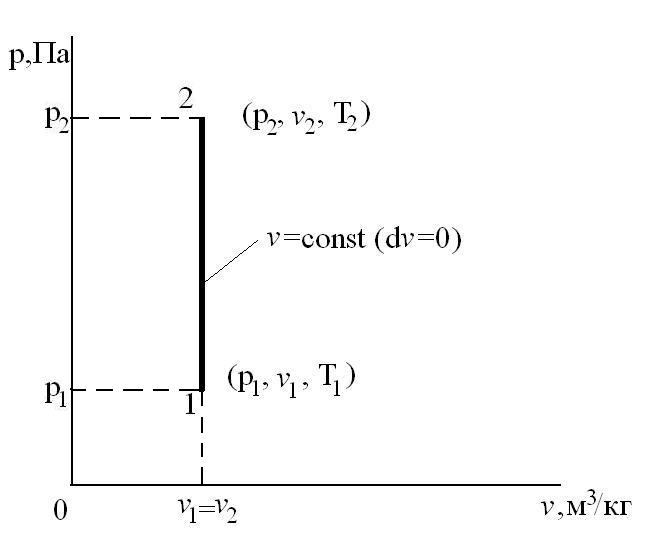
Изохорный процесс – это процесс сообщения или отнятия теплоты от газа при постоянном объеме v=const.
Этот процесс используется как подготовительный процесс в циклах.
Соотношение между параметрами для конечного участка процесса 1-2 определяется законом Шарля: 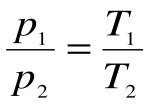
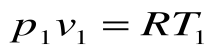
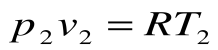
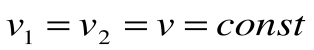
Поскольку работа расширения в этом процессе равна нулю: 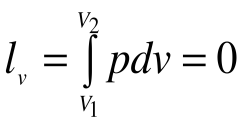
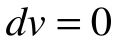
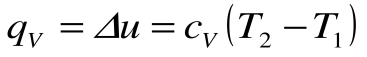
Таким образом, подведенная к газу в изохорном процессе теплота целиком идет на увеличение его внутренней энергии. Для ТП 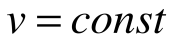
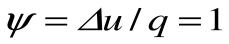

| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
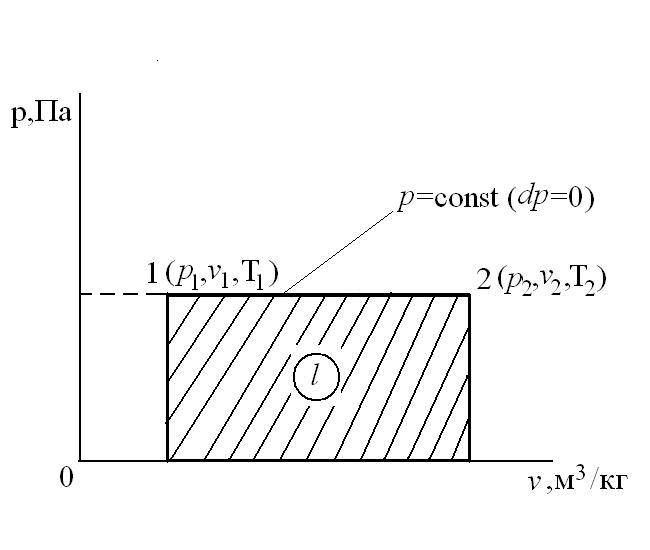
Изобарный процесс – это процесс сообщения или отнятия теплоты от газа при постоянном давлении р=const.
Соотношение между параметрами в процессе р=const: 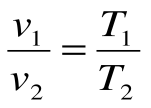


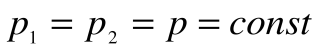
Работа расширения 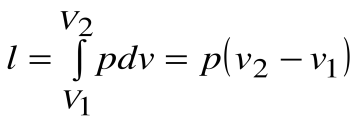
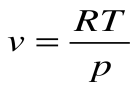
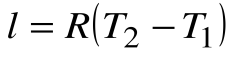
Следовательно, удельная газовая постоянная R— это работа, совершаемая 1кг газа в процессе p=const при его нагревании на один градус. Размерность R: Дж/кгК. Уравнение 1-го закона термодинамики в этом случае имеем вид:
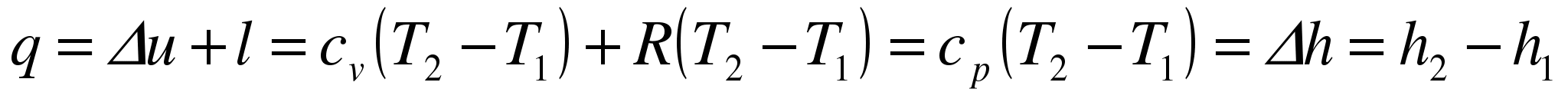
Таким образом, вся теплота, подведенная к газу в изобарном процессе, расходуется на увеличение его энтальпии.
Коэффициент распределения теплоты в процессе р=const равен:
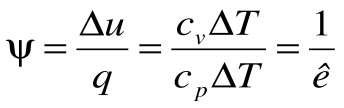
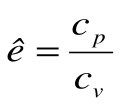
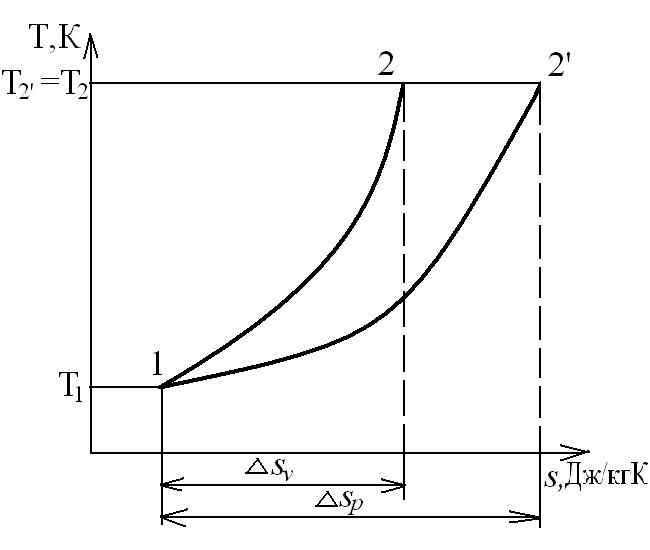
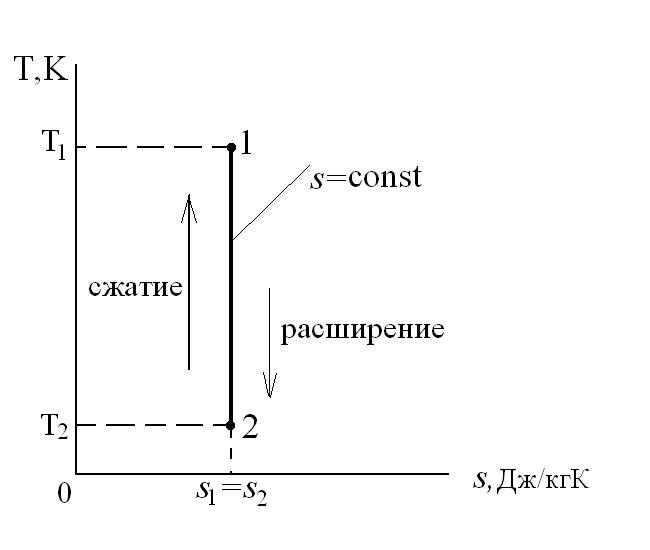
В T-s координатах взаимное положение изобары и изохоры имеет вид:
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
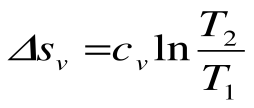
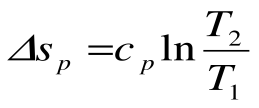
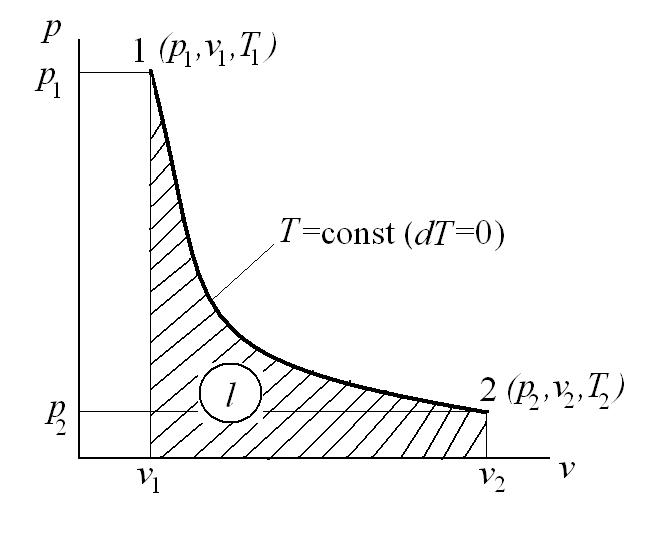
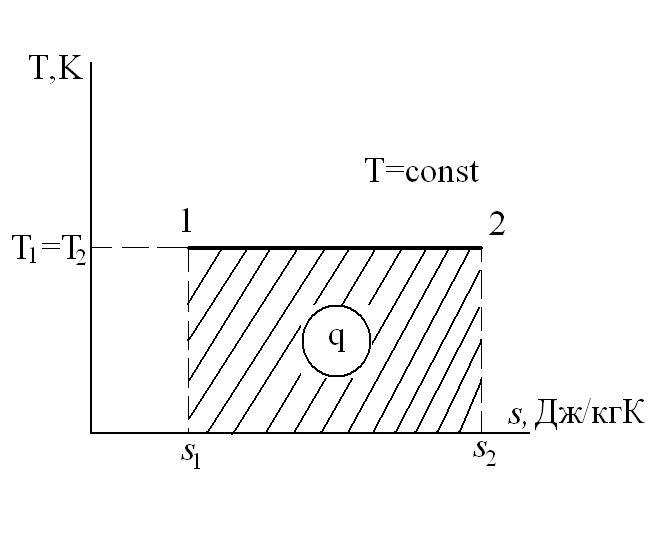
Изотермический процесс – это процесс сообщения или отнятия теплоты от газа при постоянной температуре
При Т=const из уравнения состояния 
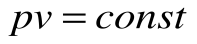
Тогда 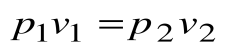
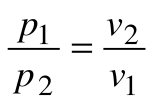
Из уравнения 1-го закона термодинамики 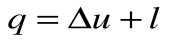
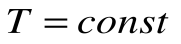
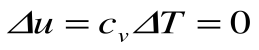
Изменение энтальпии в процессе T=const равно:
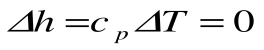
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
Работа расширения 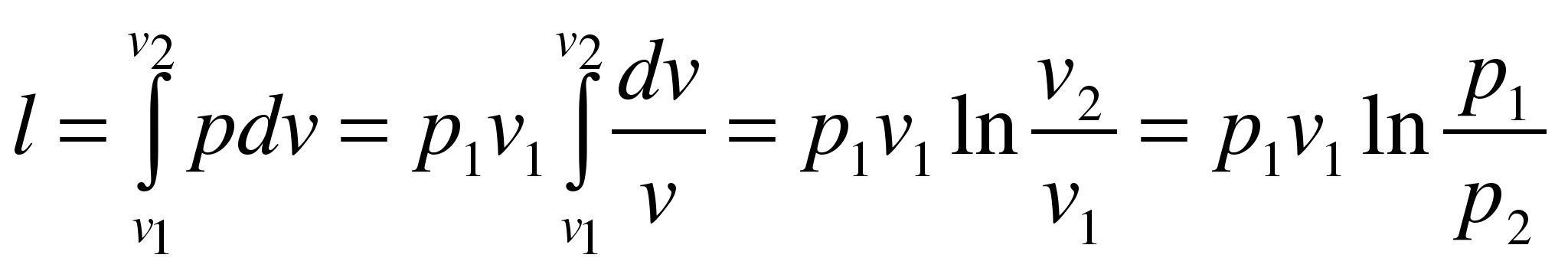
Коэффициент распределения теплоты
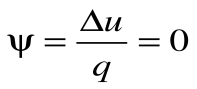
Тогда теплоемкость 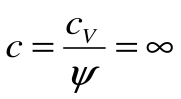
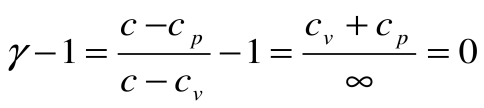
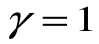
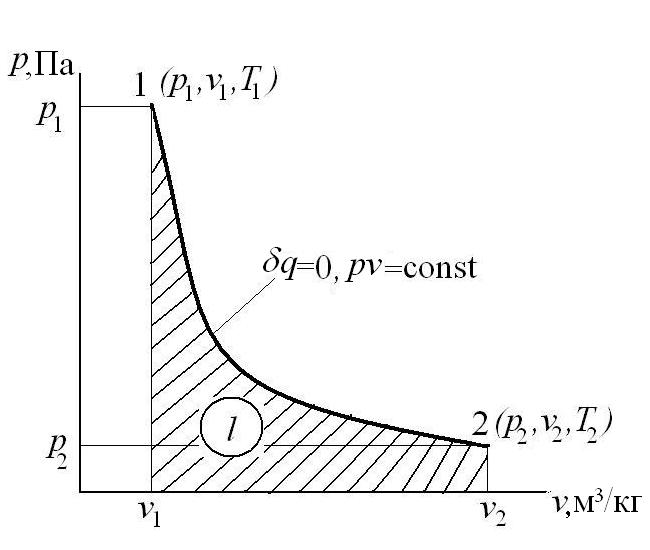
Адиабатный процесс – это процесс, протекающий без внешнего теплообмена, т.е. q=0 и 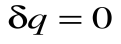
Если записать для этого случая уравнения 1-го закона термодинамики в виде:
1. 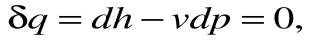
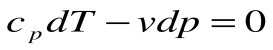
2. 
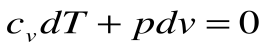

Тогда после интегрирования выражения 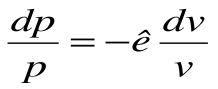

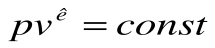
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
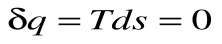
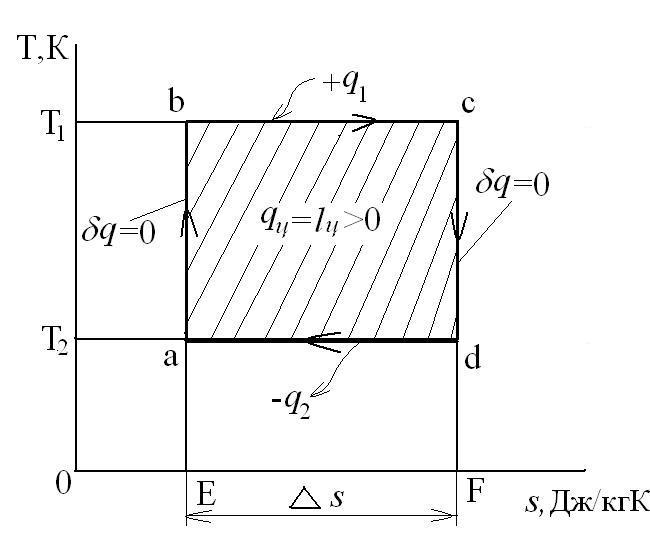
Для теплового двигателя цикл Карно – прямой цикл, состоящий из двух адиабат и двух изотерм, а для тепловых трансформаторов используется обратный цикл Карно. Тепловые машины, работающие по циклу Карно, имеют наибольшие значения термических кпд по сравнению с любым другим циклом при одинаковых предельных температурах цикла Т1 и Т2.
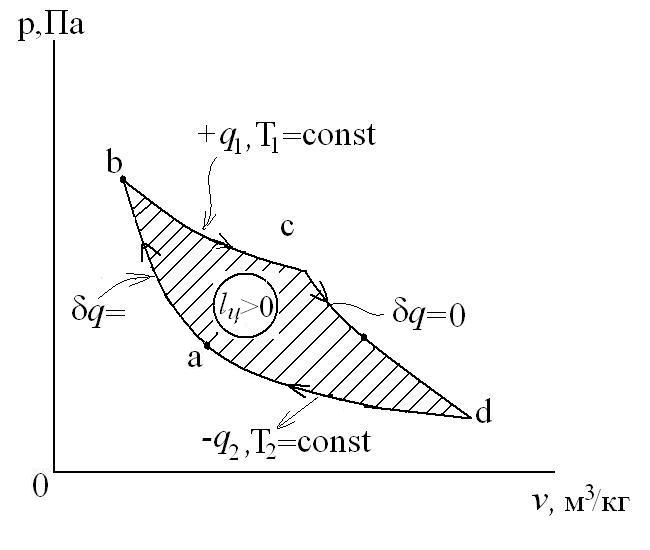
Рассмотрим прямой цикл Карно.
Графически в p-v и T-s координатах этот цикл можно представить в виде:
где ab – адиабатное сжатие ТРТ;
bc – подвод теплоты q1 в изотермическом процессе при Т1=const;
cd – адиабатное расширение ТРТ;
da – отвод теплоты 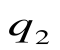
q1 = площадь bсFEb – теплота, затраченная на совершение цикла 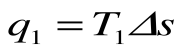
q2 = площадь adFЕa – теплота, отведенная в холодильник 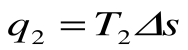
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
Тогда термический кпд прямого цикла Карно будет равен:
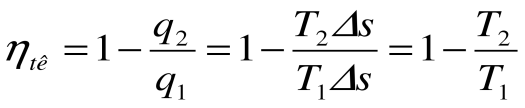
Таким образом, термический кпд цикла Карно зависит только от предельных температур источника и холодильника и не зависит от рода рабочего тела. (Первая теорема Карно). Температура Т1 и Т2 являются основными параметрами цикла Карно, которые полностью определяют этот цикл.
При Т1=Т2 термический кпд цикла Карно 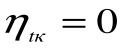
При Т2=0 или Т1= 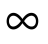
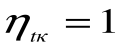
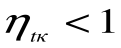
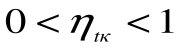
Любое заключение, вытекающее из анализа прямого цикла Карно, можно рассматривать как формулировку второго закона термодинамики.
В двух разобщенных между собой теплоизолированных сосудах А и В содержатся газы, в сосуде А – аргон, в сосуде В– водород, объем сосуда А– 150 л, сосуда В – 250 л. Давление и температура аргона – р1, t1, водорода – р2, t2. Определить давление и температуру, которые установятся после соединения сосудов и смешения газов. Теплообменом с окружающей средой пренебречь
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Уравнения состояния реальных газов
Реальные газы отличаются от идеальных тем, что их молекулы имеют конечные собственные объемы и связаны между собой силами взаимодействия, имеющими электромагнитную и квантовую природу. С увеличением расстояния между молекулами силы взаимодействия уменьшаются. При уменьшении расстояния между ними силы взаимодействия переходят в силы отталкивания, достигающие очень больших значений.
Таким образом, свойства реальных газов как в количественном, так и качественном отношениях значительно отличаются от свойств идеальных газов. Поэтому все результаты для реальных газов, полученные на основании законов для идеальных газов, будут приближенными и справедливыми лишь при очень больших разрежениях. В связи с этим возникла необходимость в разработке уравнения состояния, которое точно описывало бы состояние реального газа. Одно из таких уравнений было получено Боголюбовым и Ф. Майером:
где Bj — вириальные коэффициенты, выражающиеся через потенциальную энергию взаимодействия данного газа и его температуру.
Однако полученное уравнение в общем виде не может быть использовано для непосредственных расчетов реальных газов ввиду сложностей определения коэффициентов Bj. В отдельных частных случаях, когда известен закон изменения потенциальной энергии взаимодействия между двумя молекулами, в зависимости от расстояния между ними и при наличии определенного количества экспериментальных данных может быть получено расчетное уравнение какого-либо реального газа в достаточно широком диапазоне изменения параметров. Из-за сложности определения вириаль- ных коэффициентов обычно ограничиваются расчетом первых двух из них. В этом случае расчетное уравнение имеет вид
где Л и В — первый и второй вириальные коэффициенты, являющиеся функцией только температуры.
В настоящее время уравнения подобного вида получили широкое распространение при расчете свойств многих реальных газов. Наиболее простым и качественно верно отображающим изменение состояния реального газа является уравнение Ван-дер-Ваальса, которое является частным случаем общего уравнения состояния Майера—Боголюбова, если пренебречь в правой части всеми членами, содержащими 1/и во второй степени и выше. Уравнение Ван-дер-Ваальса было получено в 1873 г. и имеет вид
где b — наименьший объем, до которого можно сжать реальный газ.
Для каждого газа величина b имеет определенное числовое значение; а — коэффициент пропорциональности, имеющий определенное числовое значение для каждого отдельного газа, не зависящее от параметров состояния.
Уравнение Ван-дер-Ваальса качественно верно отражает состояние реальных веществ в жидком и газообразном состоянии. Для двухфазных состояний оно неприменимо. Для одного моля газа уравнение Ван-дер-Ваальса записывается в виде
Если в уравнении Ван-дер-Ваальса раскрыть скобки и расположить полученные величины по убывающим степеням v, то получим уравнение третьей степени относительно удельного объема газа
Из математики известно, что такое уравнение при заданных значениях р и Т должно иметь три корня. При этом возможны следующие три случая:
- • все три корня различны и действительны;
- • все три корня действительны и равны между собой;
- • один корень действительный и два мнимых (комплексных).
В последнем случае реальное значение имеет лишь один действительный корень, так как мнимые корни не имеют физического смысла.
Если на ра-диаграмме построить изотермы, соответствующие уравнению Ван-дер-Ваальса, то они будут иметь вид кривых, изображенных на рис. 1.3, а. Анализ этих кривых позволяет заключить, что при сравнительно низких температурах они имеют в средней части волнообразный характер с максимумом и минимумом. При этом чем выше температура, тем короче волнообразная часть изотермы. Изобара АВ, пересекающая изотерму, дает три действительных значения объема в точках A, D и В (три различных действительных корня).
Наибольший корень, равный удельному объему в точке В, относится к парообразному (газообразному) состоянию вещества, а наименьший (в точке А) — к жидкому состоянию. Участок кривой между точками А и В не имеет физического смысла, так как уравнение Ван-дер-Ваальса неверно описывает состояние двухфазных систем.
Действительный процесс перехода из жидкого состояния в газообразное изображается прямой линией (изобарой) АВ. При этом точка А соответствует состоянию кипящей жидкости, а точка В — состоянию сухого насыщенного пара.
При некоторой температуре, называемой критической, изотерма не будет иметь волнообразного участка. На этой изотерме есть лишь точка пере
а — изотермы, найденные по уравнению Ван-дер-Ваальса; 6 — МК — кривая кипящей
жидкости; NK — кривая сухого пара гиба, касательная к которой должна быть горизонтальной. Это соответствует второму случаю решения уравнения Ван-дер-Ваальса, когда все три корня действительные и равны между собой (точка К на рис. 1.3, а, 1.3, б).
При температурах выше критической изотермы будут иметь монотонно спадающий характер. Здесь будем иметь один действительный корень. Если соединить точки А, Аи А2 и т.д., то получим кривую, на которой жидкость находится в состоянии кипения (пограничная кривая жидкости — кривая А К). Кривая ВК называется пограничной кривой пара. Таким образом, для реального вещества pv-диаграмма условно разбивается на три характерные области.
- 1. Область жидкого состояния, расположенная левее кривой АК.
- 2. Область двухфазного состояния (влажного пара), расположенная между кривыми АК и ВК.
- 3. Область перегретого пара, расположенная правее кривой ВК и выше точки К.
Условно область жидкости ограничивают сверху линией СК, представляющей собой критическую изобару.
Критическое состояние вещества впервые было открыто Д. И. Менделеевым в 1861 г. Критическую температуру он назвал абсолютной температурой кипения, при которой поверхностное натяжение в жидкости становится равным нулю и исчезает различие между жидким и парообразным состояниями вещества. До открытия критического состояния вещества многие газы безуспешно пытались превращать в жидкость одним только увеличением давления. Однако, как это следует из рис. 1.3, б, при температурах, выше критических, жидкое состояние вещества отсутствует. Поэтому для превращения газа в жидкость путем увеличения давления необходимо этот газ охладить до температуры, ниже критической. Только после этого сжатием по изотерме любой газ можно превратить в жидкость.
При больших плотностях уравнение Ван-дер-Ваальса дает значительные ошибки, связанные с тем, что при его выводе не учитывались явления силовой ассоциации и диссоциации молекул под влиянием межмолекулярных сил взаимодействия. Кроме того, опытами было доказано, что коэффициенты а и б, входящие в уравнение Ван-дер-Ваальса, описываются достаточно сложными зависимостями от температуры и давления.
Русские ученые М. П. Вукалович и И. И. Новиков в 1939 г. предложили новое универсальное уравнение состояния реального газа, учитывающее явление силовой ассоциации молекул, которое имеет вид
где аиЬ — постоянные уравнения Ван-дер-Ваальса; С,т — постоянные, определяемые на основе опытов.
🎥 Видео
Уравнение состояния идеального газаСкачать

Реальный газ Уравнение Ван-Дер-ВаальсаСкачать

Уравнение состояния идеального газаСкачать

Урок 194. Уравнение Ван-дер-ВаальсаСкачать

Решение простых уравнений. Что значит решить уравнение? Как проверить решение уравнения?Скачать

Уравнение Ван-дер-Ваальса | Газы.Молекулярно-кинетическая теория | Химия (видео 8)Скачать

Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

Решение графических задач на тему Газовые законыСкачать

Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

идеальный газ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАСкачать

Лекция №2. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАСкачать

ЕГЭ. Физика. Уравнение состояния идеального газа. ПрактикаСкачать

ЕГЭ по физике. Теория #25. Идеальный газ. Уравнение состояния идеального газаСкачать