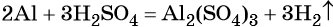Тест предназначен для аттестации учащихся 9 класса по химии за 1 полугодие. Работа расчитана на 40 минут, состоит из 3-х частей.
В части А необходимо выбрать один правильный ответ. . Ответом на задание части В будет некоторое пропущенное слово (запишите в нужном по смыслу падеже) или комбинация букв и чисел. В части С нужно написать развёрнутое решение предложенного задания(решить задачу и осуществить схему превращений).
- Просмотр содержимого документа «Тест для промежуточной аттестации учащихся 9 класса по химии_1 полугодие»
- Итоговый тест по химии для учащихся 9 класса
- Краткое описание документа:
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Химия: теория и методика преподавания в образовательной организации
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
- Тренировочные задания
- 🎬 Видео
Просмотр содержимого документа
«Тест для промежуточной аттестации учащихся 9 класса по химии_1 полугодие»
Тест для промежуточной аттестации учащихся 9 класса по химии.
Часть А. Выбери один правильный ответ:
А1. Электронное строение атома серы:
а) 1s 2 2s 2 2p 4 ; б) 1s 2 2s 2 2p 6 3s 2 3p 4 ; в) 1s 2 2s 2 2p 6 3s 2 3p 6 ; г) 1s 2 2s 2 2p 6
А2. Формула вещества с ковалентной неполярной связью: а) HCl; б) F2; в) Na2O; г) H2S
А3. Электролитом является: а) СО2 (газ); б) КОН (раствор); в) СаСО3; г) H2
А4. Формулы кислотных оксидов:
А5. Химическая реакция возможна между веществами:
А6. Ортофосфорная кислота не реагирует с: а) КОН; б) СО2; в) Mg; г) AgNO3
А7. Вещество, имеющее формулу Fe(OH)3, называется:
а) гидроксид железа (II); б) гидроксид железа (III);
в) железная окалина; г) оксид железа (III)
А8. Элементом «Э» в схеме превращений Э → Э2О5 → Н3ЭО4 может быть:
а) сера; б) кальций; в) фосфор; г) хлор
А9. Растворы сульфатов от других солей можно отличить при помощи:
а) раствора гидроксида натрия; б) раствора карбоната натрия;
в) растворимой соли бария; г) гидроксида меди(II)
А10. Сокращённое ионное уравнение реакции 2Н + + СО3 2─ = Н2О + СО2↑ соответствует
взаимодействию: а) азотной кислоты с карбонатом кальция;
б) соляной кислоты и раствором карбоната натрия;
в) серной кислоты с оксидом углерода (IV);
г) воды с оксидом углерода (IV)
А11. Сырьём для получения кислорода в промышленности служит:
а) бертолетова соль KClO3; б) перманганат калия KMnO4;
в) воздух; г) пероксид водорода Н2О2
А12. Реакция ионного обмена протекает в растворе до конца при смешивании:
А13. Сульфат цинка образуется при взаимодействии:
А14. Окислительно-восстановительной реакцией является:
А15. В реакции Н2 + Cl2 ↔ 2HCl увеличение концентрации Н2 смещает химическое
равновесие: а) вправо; б) не смещает; в) влево; г) не знаю
Часть В. Ответом на задание этой части будет некоторое пропущенное слово или словосочетание или комбинация букв и чисел.
В1. Сера отличается от кислорода тем, что:
а) имеет аллотропные модификации; б) при нормальных условиях твёрдое вещество;
в) имеет цвет; г) при определённых условиях взаимодействует с водородом
В3. Слабый электролит вода образуется при взаимодействии соляной кислоты с:
В4. В реакции 2SO2 + O2 ↔ 2SO3 + Q химическое равновесие сместится вправо при:
а) увеличении давления; б) повышении температуры;
в) использовании катализатора V2О5; г) увеличении концентрации SO3;
д) увеличении концентрации SO2; е) понижении температуры
В5. Укажите причину протекании реакции до конца, установив соответствия:
уравнение реакции признак
а) Al(OН)3 + HCl→ I выделяется газ
б) СаСО3 + НNO3 → II образуется осадок
в) CuCl2 + NaOН → III образуется малодиссоциирующее вещество
В6. Сложные вещества, при диссоциации которых в водных растворах отщепляются
катионы металла, катионы водорода и анионы кислотного остатка называются
В7. Состояние системы, при котором скорость прямой реакции равна скорости обратной
реакции, называют ____________ ____________.
В8. Какую окраску приобретает индикатор лакмус при добавлении его в раствор хлорида
Часть С. Напишите развёрнутое решение предложенного задания:
С1. Решите задачу: К 196 г 10%-го раствора серной кислоты прилили 108 г 20%-го раствора нитрата бария. Вычислите массу образовавшегося осадка.
С2. Осуществите цепочку превращений: Zn → ZnO → ZnSО4 → Zn(OН)2 → ZnO → Zn
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Итоговый тест по химии для учащихся 9 класса
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Тест для итоговой аттестации учащихся 9 класса по химии
Часть А. Выбери один правильный ответ:
А1. Электронное строение атома фосфора:
а ) 1s 2 2s 2 2p 4 ; б ) 1s 2 2s 2 2p 6 3s 2 3p 3 ; в ) 1s 2 2s 2 2p 6 3s 2 3p 6 ; г ) 1s 2 2s 2 2p 6
А2. Формула вещества с ковалентной неполярной связью: а) О2; б) HCl ; в) NaCl ; г) H 2 S
А3. Электролитом является: а) СО2 (газ); б) КОН (раствор); в) СаСО3; г) H 2
А4. Серная кислота не реагирует с: а) СО2; б) КОН; в) Mg ; г) AgNO 3
А5. Среди химических элементов: Mg , Be , B , Al – более ярко металлические свойства выражены у: а) бериллия; б) магния; в) алюминия; г) бора
А6. Реакция ионного обмена возможна между веществами, формулы которых:
а) H 2 SO 3 и HCl ; б) Cu ( OH )2 и Na 2 CO 3 ; в) Ba ( OH )2 и Na ОН; г) HCl и AgNO 3 .
А7. Кислую реакцию среды будет иметь раствор:
А8. Окислительно-восстановительной реакцией является:
А9. Сокращенное ионное уравнение реакции Cu 2+ + 2 OH – = Cu ( OH )2 ↓ соответствует взаимодействию:
Часть В. Ответом на задание этой части будет некоторое пропущенное слово или комбинация букв и чисел.
В1. Процесс разрушения металла под действием факторов окружающей среды называется ____________________________.
В2. Укажите причину протекания реакции до конца, установив соответствия:
уравнение реакции признак
а) Al ( O Н)3 + HCl → 1. выделяется газ
б) СаСО3 + Н NO 3 → 2. образуется осадок
в) CuCl 2 + NaO Н → 3. образуется малодиссоциирующее вещество
В3. Какую реакцию среды будет показывать раствор хлорида алюминия? _________________
Часть С. Напишите развёрнутое решение предложенного задания:
Вычислите объём газа (н.у.), который выделится при взаимодействии 100 г известняка, содержащего 20% примесей с раствором соляной кислоты.
С2. Осуществите цепочку превращений : K → KOH → KCl → K 2 SO 4
Тест для промежуточной аттестации учащихся 9 класса по химии
Часть А. Выбери один правильный ответ:
А1. Электронное строение атома хлора:
а ) 1s 2 2s 2 2p 5 ; б ) 1s 2 2s 2 2p 6 3s 2 3p 3 ; в ) 1s 2 2s 2 2p 6 3s 2 3p 5 ; г ) 1s 2 2s 2 2p 3
А2. Формула вещества с ионной связью: а) HCl ; б) О2; в) NaCl ; г) H 2 S
А3. Неэлектролитом является: а) S О2 (газ); б) Ва Cl 2 (раствор); в) NaO Н(расплав); г) HNO 3
А4. Гидроксид калия не реагирует с: а) CuS О4; б) SO 3 ; в) Са O ; г) HCl
А5. Среди химических элементов: Si , P , S , Cl – более ярко неметаллические свойства выражены у: а) кремния; б) фосфора; в) серы; г) хлора
А6. Реакция ионного обмена возможна между веществами, формулы которых:
а) AgNO 3 и KCl ; б) Ca ( OH )2 и NaCl ; в) Fe ( OH )2 и Na 2 SO 3 ; г) K 3 PO 4 и HCl .
А7. Щелочную реакцию среды имеет раствор:
А8. Окислительно-восстановительной реакцией является:
А9. Сокращенное ионное уравнение реакции Ba 2+ + CO 3 2- = BaCO 3 ↓ соответствует взаимодействию: а) BaCl 2(р-р) и CaCO 3 ; б) BaCl 2(р-р) и K 2 CO 3(р-р) ;
Часть В. Ответом на задание этой части будет некоторое пропущенное слово или комбинация букв и чисел.
В1. Процесс восстановления металлов из оксидов с помощью алюминия называется ____________________________.
В2. Укажите причину протекания реакции до конца, установив соответствия:
уравнение реакции признак
а) Na 2 CO 3 + HCl → 1. образуется осадок
б) NaCl + AgNO 3 → 2. выделяется газ
в) H 2 S О4 + KO Н → 3. образуется малодиссоциирующее вещество
В3. Какую реакцию среды будет показывать раствор карбоната натрия? __________________
Часть С. Напишите развёрнутое решение предложенного задания:
Какая масса осадка образуется при взаимодействии серной кислоты массой 150 грамм с массовой долей H 2 SO 4 в нём 49% с раствором нитрата бария.
С2. Осуществите цепочку превращений : Al → AlCl 3 → Al ( OH )3 → Al 2 O 3
Краткое описание документа:
Тест для проведения контрольной работы в конце 2 полугодия у учащихся 9-х классов, составлен в 2-х вариантах. Тест состоит из 3-х частей: в части А предполагается выбор 1 правильного ответа. Ответом на задание части В будет некоторое пропущенное слово или комбинация букв и чисел. В части С необходимо написать развёрнутое решение задачи и осуществить цепочку превращений. Работа рассчитана на 40 минут.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 861 человек из 78 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 51 человек из 23 регионов
Курс профессиональной переподготовки
Химия: теория и методика преподавания в образовательной организации
- Сейчас обучается 374 человека из 64 регионов
«Мотивация здорового образа жизни. Организация секций»
Свидетельство и скидка на обучение каждому участнику
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
«Как закрыть гештальт: практики и упражнения»
Свидетельство и скидка на обучение каждому участнику
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 841 609 материалов в базе
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 03.01.2021
- 269
- 2
- 03.01.2021
- 78
- 0
- 03.01.2021
- 216
- 4
- 03.01.2021
- 96
- 0
- 03.01.2021
- 91
- 0
- 03.01.2021
- 1315
- 20
- 03.01.2021
- 254
- 10
- 03.01.2021
- 180
- 5
«Учись, играя: эффективное обучение иностранным языкам дошкольников»
Свидетельство и скидка на обучение
каждому участнику
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 04.05.2020 226
- DOCX 51 кбайт
- 2 скачивания
- Оцените материал:
Настоящий материал опубликован пользователем Капанова Натали Юрьевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 1 год и 3 месяца
- Подписчики: 0
- Всего просмотров: 34001
- Всего материалов: 234
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минпросвещения рекомендует школьникам сдавать телефоны перед входом в школу
Время чтения: 1 минута
Инфофорум о буллинге в школе: итоги и ключевые идеи
Время чтения: 6 минут
Около 20% детей до 15 лет не воспринимают прочитанную информацию
Время чтения: 1 минута
С 1 сентября в российских школах будут исполнять гимн России
Время чтения: 1 минута
Российские школьники начнут изучать историю с первого класса
Время чтения: 1 минута
Онлайн-конференция о профессиональном имидже педагога
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
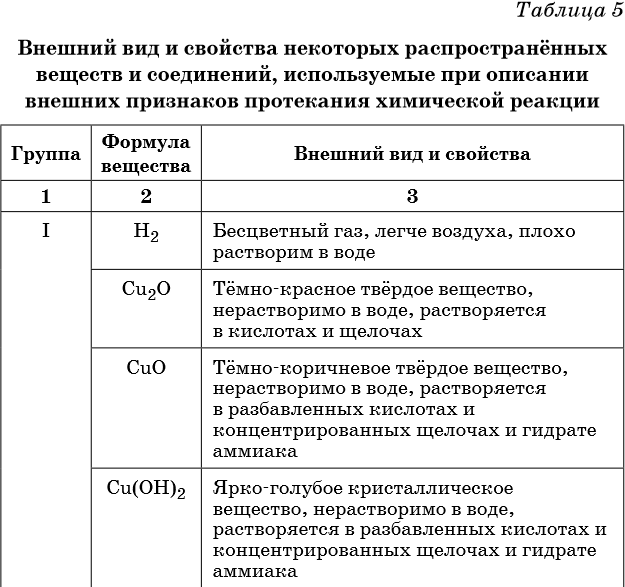
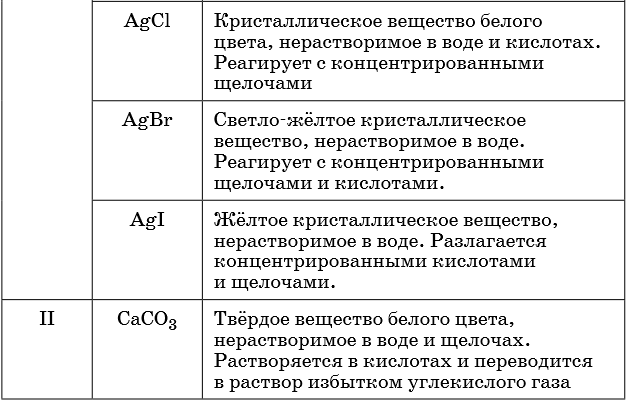
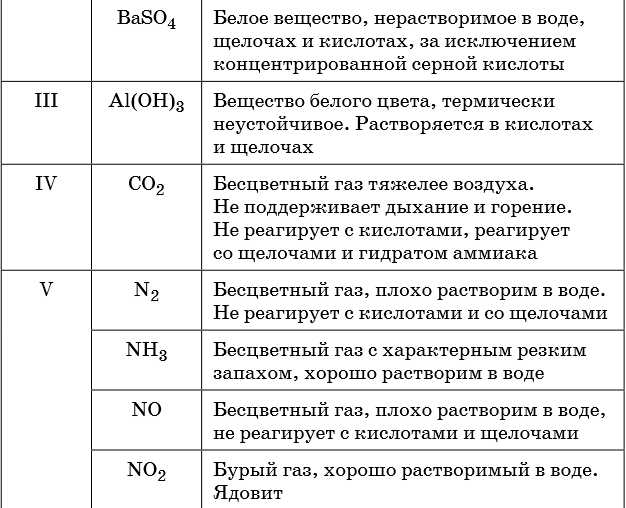
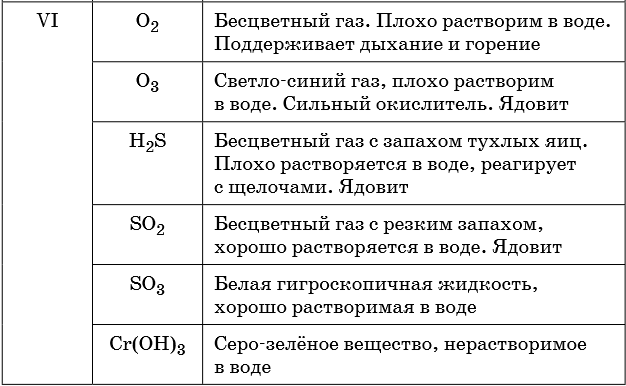
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Видео:Реакции ионного обмена. 9 класс.Скачать

Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
🎬 Видео
4. Химическая реакция и ее признакиСкачать

AlOH3 NaOH → NaAlOH4 Получение гидроксида алюминия и растворение его в иСкачать

8 класс - Химия - Химическая реакции. Признаки и условия протекания реакций. Закон сохранения массыСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Направление самопроизвольного протекания реакции | Задачи по химии ГлинкаСкачать

Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать

Реакции ионного обмена. 9 класс.Скачать

Подготовка к ОГЭ. Выпуск № 13 "Условия и признаки протекания химических реакций"Скачать

Реакции присоединения | Химия 10 класс | УмскулСкачать

Как уравнивать окислительно-восстановительные реакции?Скачать

Окислительно-восстановительные реакции. 3 часть. 11 класс.Скачать

Выход реакции | Химия ЕГЭ 10 класс | УмскулСкачать

25. Схема реакции и химическое уравнениеСкачать

Основы окислительно-восстановительных реакций | Химия ОГЭ 2023 | УмскулСкачать

Признак химических реакций - выпадение или растворение осадкаСкачать