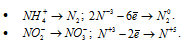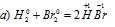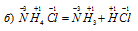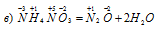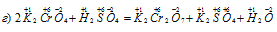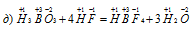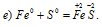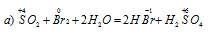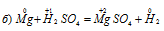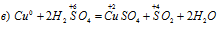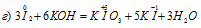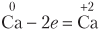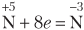Задача 611.
Указать, в каких из приведенных процессов происходит окисление азота, и в каких — восстановление, как изменяется в каждом случае степень окисленности азота:
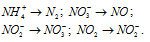
Решение:
Окисление – процесс, при котором происходит потеря элементом электронов и наблюдается повышение степени окисленности его. Восстановление – процесс, при котором эле-мент присоединяет электроны и наблюдается при этом понижение степени окисленности его.
а) Окисление азота происходит в следующих процессах:
б) Восстановление азота происходит в следующих процессах:
Задача 612.
Какие из следующих реакций относятся к окислительно-восстановительным?
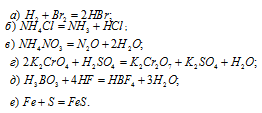
Решение:
Реакции, в к которых происходит изменение степеней окисленности элементов, называются окислительно-восстановительными.
В данной реакции водород повышает степень окисленности 0 до +1, т.е. отдаёт электроны, является восстановителем. Бром понижает свою степень окисленности от 0 до -1, т. е. принимает электроны, является окислителем.
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
Азот повышает степень окисленности от -3 до +1, т. е. является восстановителем. Азот иона нитрата понижает свою степень окисленности от +5 до +1, т. е. является окислителем. Данная реакция относится к окислительно-восстановительным.
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
Железо повышает свою степень окисленности от 0 до +2, является восстановителем; сера понижает свою степень окисленности от 0 до -2, т.е. является окислителем. Таким образом, данная реакция является окислительно-восстановительной.
Ответ: а), в), е).
Задача 613.
Для следующих реакций указать, какие вещества и за счет каких именно элементов играют роль окислителей и какие — восстановителей: 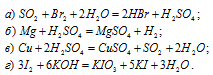
Решение:
Восстановитель 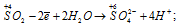
Окислитель 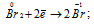
В данной реакции оксид серы (IV) SO2 является восстановителем за счёт серы, которая отдаёт электроны и меняет степень окисленности от +4 до +6. Окислителем является бром Br2, в котором атомы брома присоединяют по одному электрону, меняя степень окисленности от 0 до -1.
Восстановитель 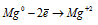
Окислитель 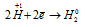
В данной реакции окислителем является H2SO4, в которой атомы водорода, присоединяя по одному электрону, изменяют степень окисленности от +1 до 0. Магний является восстановителем, потому что его атомы, отдавая по два электрона, изменяют степень окисленности от 0 до +2.
Восстановитель 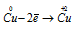
Окислитель 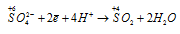
В данной реакции окислителем является H2SO4, в котором атом серы изменяет степень окисленности от +6 до +4. Восстановителем в данной реакции является медь, атомы которой отдают по два электрона, изменяя степень окисленности от 0 до +2.
Восстановитель 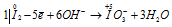
Окислитель 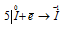
В данной реакции окислителем и восстановителем является иод I2, в котором атом иода, отдавая пять электронов, изменяет степень окисленности от 0 до +5, и, присоединяя один электрон, изменяет степень окисленности от 0 до -1. в этой реакции происходит одновременно и увеличение, и уменьшение степени окисленности атомов одного и того же элемента, значит, эта реакция относится к реакциям диспропорционирования (самоокисления-самовосстановления).
- Материал по теме «Окислительно-восстановительные реакции» (теория+тест)
- Просмотр содержимого документа « ⥮à¨ï»
- Просмотр содержимого документа « â¥á⮢ ï à ¡®â »
- Напишите уравнения реакций: а) азота с водородом (обозначьте степени окисления элементов и укажите окислитель и восстановитель); б) аммиака
- Ваш ответ
- решение вопроса
- Похожие вопросы
- 📸 Видео
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Материал по теме «Окислительно-восстановительные реакции» (теория+тест)
Цель применения данного материала на уроке химии — познакомить учащихся с новой классификацией химических реакций по признаку изменения степеней окислений элементов – окислительно-восстановительными реакциями, дать понятие “окислитель”, “восстановитель”, “окисление”, “восстановление”; охарактеризовать единство и неразрывность процессов окисления и восстановления; систематизировать знания о типах химических реакций, о степени окисления химических элементов.
Просмотр содержимого документа
« ⥮à¨ï»
Окислительно-восстановительными реакциями (ОВР) называются реакции, протекающие с изменением степени окисления атомов элементов. В результате этих реакций одни атомы отдают электроны, а другие их принимают.
Восстановитель — атом, ион, молекула или ФЕ, отдающий электроны, окислитель — атом, ион, молекула или ФЕ, принимающий электроны:
Процесс отдачи электронов называется окислением , а процесс принятия — восстановлением . В ОВР обязательно должны быть вещество восстановитель и вещество окислитель. Нет процесса окисления без процесса восстановления и нет процесса восстановления без процесса окисления.
Восстановитель отдает электроны и окисляется, а окислитель принимает электроны и восстанавливается
Процесс восстановления сопровождается понижением степени окисления атомов, а процесс окисления — повышением степени окисления атомов элементов. Сказанное удобно проиллюстрировать схемой (СО — степень окисления):
Конкретные примеры процессов окисления и восстановления (схемы электронного баланса) приведены в таблице:
Примеры схем электронного баланса
Схема электронного баланса
Атом кальция отдает электроны, повышает степень окисления, является восстановителем
Ион Cr +2 отдает электроны, повышает степень окисления, является восстановителем
Молекула хлора отдает электроны, атомы хлора повышают степень окисления от 0 до +1, хлор — восстановитель
Атом углерода принимает электроны, понижает степень окисления, является окислителем
Молекула кислорода принимает электроны, атомы кислорода понижают степень окисления от 0 до −2, молекула кислорода является окислителем
Ион 
Важнейшие восстановители : простые вещества металлы; водород; углерод в форме кокса; оксид углерода(II); соединения, содержащие атомы в низшей степени окисления (гидриды металлов КН, NaH , сульфиды H2S, иодиды KI, аммиак NH3); самый сильный восстановитель — электрический ток на катоде.
Важнейшие окислители : простые вещества — галогены, кислород, озон; концентрированная серная кислота; азотная кислота; ряд солей (KClO 3 , KMnO 4 , K 2 Cr 2 O 7 ); пероксид водорода H 2 O 2 ; наиболее сильный окислитель — электрический ток на аноде.
Просмотр содержимого документа
« â¥á⮢ ï à ¡®â »
1.Укажите электронные уравнения процессов восстановления:
4) 2S −1 − 10 e — = 2S +4 .
2.Отметьте электронные уравнения процессов окисления:
3.Укажите электронные уравнения, в которых атомы водорода или азота выполняют роль восстановителя:
4.Отметьте электронные уравнения, в которых атомы серы являются окислителями:
3) 2S −1 − 10 e — = 2S +4 ;
5.Укажите схему реакции, в которой степень окисления атома серы изменяется от −1 до +4:
4) KHS + HCl → KCl + H 2 S.
6.Отметьте схемы реакций, в которых степень окисления атома азота изменяется от −3 до 0:
7.Укажите схемы реакций, в которых степень окисления атома углерода повышается:
4) CO 2 + Mg → MgO + C.
8.Отметьте схемы реакций, в которых степень окисления атома хлора понижается:
9.Молекула кислорода в окислительно-восстановительных реакциях может максимально присоединить . электронов (-а):
10.Укажите формулу молекулы, которая в окислительно-восстановительной реакции может максимально отдать 10 электронов:
11.Укажите максимальное число электронов, которые может отдать молекула хлора в окислительно-восстановительных реакциях:
12.Укажите формулы молекул, которые в окислительно-восстановительных реакциях могут максимально присоединить два электрона:
13.Отметьте схемы процессов окисления:
14.Сера — окислитель, реагируя:
15.Фосфор — восстановитель, реагируя:
16.Окислительные свойства атомов галогенов увеличиваются слева направо в ряду:
17.Только восстановительные свойства в окислительно-восстановительных реакциях проявляют:
18.Самым сильным окислителем из простых веществ является:
19.Коэффициент 2 перед формулой SO 2 следует поставить в окислительно-восстановительной реакции, схема которой:
20.Окислительные свойства простых веществ слева направо возрастают в ряду:
1) углерод, сера, кислород;
2) кислород, сера, углерод;
3) кремний, фтор, иод;
4) фосфор, кислород, сера.
21.Коэффициент 4 перед формулой HNO 3 следует поставить в уравнениях окислительно-восстановительных реакций, схемы которых:
1) только окислитель;
2) только восстановитель;
3) окислитель и солеобразователь (этот термин означает, что вещество участвует в реакции образования соли);
4) восстановитель и солеобразователь.
23.В уравнении химической реакции 2KBr + Cl 2 = 2KCl + Br 2 атомы брома:
1) понижают степень окисления;
2) повышают степень окисления;
3) выступают в роли окислителя;
4) выступают в роли восстановителя.
24.Электронной схеме S −2 → S +4 соответствует уравнение химической реакции:
25.В процессе превращения S +6 → S −2 атомы серы:
1) отдают электроны, окисляются;
2) принимают электроны, окисляются;
3) отдают электроны, восстанавливаются;
4) принимают электроны, восстанавливаются.
26.Сущность превращения PbS → PbSO 4 отражается электронным уравнением:
27.Сущность химического превращения Cl 2 + KOH → KCl + KClO 3 + H 2 O отражают электронные уравнения реакций:
1) Cl 0 + e — = Cl −1 ; Cl 0 − 3 e — = Cl +3 ;
2) Cl 0 + e — = Cl −1 ; Cl 0 − 7 e — = Cl +7 ;
3) Cl 0 + e — = Cl −1 ; Cl 0 − 5 e — = Cl +5 ;
4) Cl 0 − e — = Cl −1 ; Cl 0 + 5 e — = Cl +5 .
28.Процесс восстановления имеет место:
1) когда нейтральные атомы превращаются в катионы;
2) нейтральные атомы превращаются в анионы;
3) положительный заряд простого иона возрастает;
4) положительный заряд простого иона уменьшается.
29.При окислении степень окисления атома элемента:
3) остается без изменения;
4) может как повышаться, так и понижаться.
30.При восстановлении степень окисления атома элемента:
3) остается без изменения;
4) может как повышаться, так и понижаться.
31.Процесс окисления имеет место:
1) когда нейтральные атомы превращаются в катионы;
2) нейтральные атомы превращаются в анионы;
3) положительный заряд простого иона уменьшается;
4) положительный заряд простого иона возрастает.
32.Укажите схемы реакций, в которых вода является окислителем:
33.Укажите уравнение реакции, в результате которой степень окисления атомов азота понижается с 0 до −2:
34.Отметьте схемы или уравнения, в которых пероксид водорода является восстановителем:
36.Окислительно-восстановительная реакция НЕ может протекать:
37.Свойства как окислителя, так и восстановителя в окислительно-восстановительных реакциях с другими веществами проявляют:
38.Только окислительные свойства в окислительно-восстановительных реакциях с другими веществами проявляют:
39.За счет атома азота только восстановительные свойства в окислительно-восстановительных реакциях с другими веществами проявляет:
40.Двойственные окислительно-восстановительные свойства могут проявлять:
41.Укажите схемы реакций, в которых водород — восстановитель:
42.Отметьте схемы реакций, в которых углерод — окислитель:
43.НЕВОЗМОЖНА окислительно-восстановительная реакция:
1) между KOH и HCl;
44.В реакции, схема которой HBr + KH → KBr + H 2 , бромоводородная кислота играет роль:
1) только восстановителя;
2) только окислителя;
3) восстановителя и солеобразователя;
4) окислителя и солеобразователя.
46.Переход NO → N 2 можно осуществить с помощью:
47.Переход HBr → Br 2 можно осуществить с помощью:
48.Найдите химическое количество (моль) азотной кислоты, расходуемой на солеобразование в реакции с участием 4 моль Ag, схема которой Ag + HNO 3 → AgNO 3 + NO + H 2 O :
49.Какая масса (г) азотной кислоты расходуется на солеобразование в реакции с участием 0,111 моль Fe, схема которой Fe + HNO 3 → Fe(NO 3 ) 2 + NH 4 NO 3 + H 2 O:
50.Отметьте схемы реакций, в которых роль окислителя и восстановителя выполняют атомы одного и того же элемента:
51.Укажите алгебраическую сумму степеней окисления атомов элемента окислителя до и после реакции (в восстановленной форме), протекающей по схеме Zn + H 2 SO 4 → ZnSO 4 + H 2 S + H 2 O:
52.Для окислительно-восстановительной реакции, протекающей по схеме Sn + HNO 3 → Sn ( NO 3 ) 2 + NH 4 NO 3 + H 2 O , укажите степени окисления атома элемента окислителя соответственно до и после реакции (в восстановленной форме):
53.Выберите ряд, в котором указаны символы элементов, атомы которых окисляются в реакции, протекающей по схеме
54.Какое количество (моль) электронов перейдет от атомов кислорода к атомам хлора при разложении бертолетовой соли массой 12,25 г по схеме KClO 3 → KCl + O 2 ?
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Напишите уравнения реакций: а) азота с водородом (обозначьте степени окисления элементов и укажите окислитель и восстановитель); б) аммиака
Видео:Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Ваш ответ
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

решение вопроса
Видео:Учимся составлять электронный баланс/овр/8классСкачать

Похожие вопросы
- Все категории
- экономические 43,408
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,025
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
📸 Видео
ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Все об ОВР за 5 часов | Химия ЕГЭ 2023 | УмскулСкачать

Окислительно-восстановительные реакцииСкачать

БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

Задание 20. ОВР и метод электронного баланса - пойми, как это работает | Химия ОГЭ 2023Скачать

Как уравнивать окислительно-восстановительные реакции?Скачать

ОВР и метод электронного баланса | Химия ОГЭ 2023 | УмскулСкачать

Химия| Элементарные частицы. Протоны. Нейтроны. Электроны.Скачать

Окислительно-восстановительные реакции (ОВР). Что надо знать и как их решатьСкачать

Химия, 9 класс, тема "Окислительно-восстановительные реакции" (учитель Швецова Елена Евгеньевна)Скачать

Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

8 класс. Степень окисления.Скачать