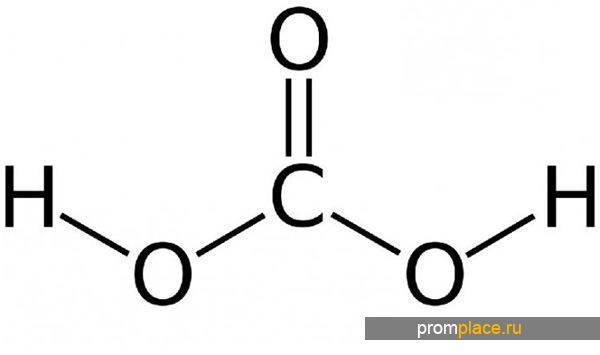
- Получение угольной кислоты.
- Угольная кислота и её соли — получение и применение
- Уравнение
- Структурная формула
- Особенности солей угольной кислоты
- Химические свойства
- Применение
- Производители
- Угольная кислота — свойства, получение и применение
- Физические и химические свойства
- Способы получения
- Особенности применения
- Использование в сельском хозяйстве
- Средняя стоимость
- 🌟 Видео
Видео:Угольная кислота. Соли угольной кислоты. Карбонаты. Гидрокарбонаты. Получение и свойстваСкачать

Получение угольной кислоты.
При растворении углекислого газа образуется угольная кислота, причем в растворе присутствует равновесие:
В природе не встречается, очень неустойчива и легко распадается.
Угольная кислота двухосновная и образует 2 типа солей: кислые (гидрокарбонаты) и средние (карбонаты).
Качественная реакция на присутствие H2CO3: воздействие сильных кислот на соли H2CO3, в результате чего улетучивается СО2:
При пропускании углекислого газа через известковую воду выпадает белый осадок:
Только карбонаты щелочных металлов и аммония, а также гидрокарбонаты, растворимы в воде.
Если через выпавший осадок пропустить углекислый газ, то из нерастворимого карбоната образуется растворимый гидрокарбонат:
Гидрокарбонаты при температуре разлагаются на СО3 2- , Н2О и газ:
Карбонаты (кроме щелочных металлов) при темпеатуре распадаются:
Основное значение из всех солей имеет сода, из которой получают различные кристаллогидраты: Na2CO3·10H2O (наиболее устойчив, называется кристаллической содой), Na2CO3·7H2O, Na2CO3·H2O.
Видео:Химия 9 класс (Урок№19 - Угольная кислота.)Скачать

Угольная кислота и её соли — получение и применение
Угольная кислота появляется в результате разложения углекислого газа в водной среде. Этим веществом искусственно насыщают минеральные воды. Формула угольной кислоты Н2СО3. Поэтому при открытии бутылки с газированной водой, можно увидеть активные пузырьки. Основное получение угольной кислоты происходит в воде.
Видео:9 класс. Угольная кислота и ее соли.Скачать

Уравнение
СО2 (г) + Н2О СО2 • Н2О (раствор) Н2СО3 Н+ + HCO3- 2H+ + CO32-.
Сама по себе угольная кислота представляет слабое непрочное соединение, которое невозможно выделить в свободном состоянии из воды.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Структурная формула
Но стоит отметить тот факт, что во время разложения гидрокарбоната аммония, формируются устойчивые соединения угольной кислоты. Такие крепкие химические связи образуются только в период, когда гидрокарбонат аммония вступает в газовую фазу реакции.
Вещество является интересным объектом для изучения. Его изучают австралийские ученые уже более 6 лет. В безводном состоянии эта кислота напоминает прозрачные кристаллы, которые имеют высокую стойкость к низким температурам, но при нагревании кристаллы угольной кислоты начинают разлагаться.
Данное вещество считается слабым по своей структуре, но в тоже время, угольная кислота является сильнее борной. Весь секрет заключается в количестве атомов водорода. В составе угольной кислоты имеется два атома водорода, поэтому она считается двухосновной, а борная кислота — одноосновная.
Видео:9-класс | Химия | Угольная кислота и её солиСкачать

Особенности солей угольной кислоты
Эта кислота считается двухосновной, поэтому может создавать соли двух видов:
- • карбонаты угольной кислоты – средние соли,
- • гидрокарбонаты – кислые соли.
Карбонатами угольной кислоты могут выступать в соединения: Na2СO3,(NH4)2CO3. Они не способны растворятся в водной среде. Кислые соли этого вещества включают в себя: бикарбонаты NaHCO3 , Ca(HCO3)2. Для получения гидрокарбонатов производят реакцию, в которой основными веществами являются: угольная кислота и натрий.
Соли угольной кислоты помогли человечеству в строительстве, медицине и даже кулинарии. Потому что они встречаются в составе:
- • мела,
- • пищевой, кальцинированной и кристаллической соды,
- • известняковой породы,
- • мраморного камня,
- • поташа.
Гидрокарбонаты и карбонаты кислоты могут вступать в реакции с кислотами, во время этих реакции возможно выделение углекислого газа. Также эти вещества могут быть взаимозаменяемыми, они способны разлагаться под воздействием температуры.
Реакции угольной кислоты:
2NaHCO3 → Na2CO3 +H2O +CO2
Na2CO3 + H2O + CO2 →2NaHCO3
Видео:угольная кислотаСкачать

Химические свойства
Данная кислота по своей структуре способна входить в реакции со многими веществами.
Свойства угольной кислоты раскрываются в реакциях:
- • диссоциации,
- • с металлами,
- • с основаниями,
- • с основными оксидами.
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
Угольная кислота представляет собой слабый электролит, так как слабая летучая кислота не может выступать в роли мощного электролита в отличие от, например, соляной кислоты. Этот факт можно увидеть в результате добавление лакмуса в раствор угольной кислоты. Изменение цвета будет незначительным. Поэтому можно утверждать, что угольная кислота может поддерживать 1 уровень диссоциации.
Видео:Получение угольной кислотыСкачать

Применение
Данное вещество можно увидеть в составе газированных вод. Но соли угольной кислоты широко применяют:
- • для строительной сферы,
- • в процессе производства стекла,
- • в процессе производства моющих и чистящих средств,
- • производства бумаги,
- • для некоторых подкормок и удобрений для растений,
- • в медицине.
Отечественный и мировой рынок предлагает в продаже различные препараты и химические вещества, в состав которых входит угольная кислота:
- • мочевина или карбамид,
- • литиевая соль угольной кислоты,
- • углекислый кальций (мел),
- • кальцинированная сода (натрий углекислый) и т.д.
Карбамид используют в качестве удобрения для плодовых и декоративных растений. Его средняя цена составляет 30-40 рублей за 1 кг. Фасуют готовую продукцию в полиэтиленовые пакеты и мешки, весом 1, 5,25,50 кг.
Литиевую соль угольной кислоты используют в составе керамических изделий, ситаллов. Этот материал используется для производства камер сгорания для реактивных двигателей, его добавляют в глазури, эмали, грунтовки для различных металлов. Литиевую соль добавляют в грунтовки для обработки алюминия, чугуна и стали.
Это химическое вещество добавляют в процессе стекловарения. Стекла, в состав которых была добавлена литиевая соль, имеют повышенную проницаемость светлового потока. Иногда литиевую соль угольной кислоты используют в процессе производства пиротехники.
Видео:Получение угольной кислотыСкачать

Производители
Средняя цена 1 кг такого вещества в России составляет 3900-4000 рублей. Главным заводом-изготовителем этого вещества считается московский завод ООО Компонент-Реактив. Также литиевую соль угольной кислоты производят в компаниях: ООО КурскХимПром, ООО ВитаХим, ООО Русхим, ЗАО Химпэк.
Мел производится для технических и кормовых целей. Средняя цена кормового мела составляет 1800 рублей за 1 тонну. Фасуется в основном по 50 кг, 32 кг. Производители: ООО Меловик, ООО МТ Ресурс, ООО Зооветснаб, ООО Агрохиминвест.
Кальцинированная сода применяется для стирки, удаления пятен и отбеливания. Средняя цена на этот продукт на розничном рынке варьируется в пределах 16-30 рублей за 1 кг. Производители: ООО Новэра, ЗАО ХимРеактив, ООО ХимПлюс, ООО СпецБурТехнологии, ООО СпецКомплект и др.
Видео:Получение угольной кислотыСкачать

Угольная кислота — свойства, получение и применение
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Физические и химические свойства
Угольная кислота способна существовать в равновесии с диоксидом углерода в водных растворах. Однако при изменении условий, в частности, температуры, этот карбонатный класс склонен распадаться, одновременно происходит окисление гидроксида. Также встречается безводная форма, которая представляет собой небольшие бесцветные кристаллы, образующиеся при температурах ниже минус 30 градусов. При ее нагревании происходит диссоциация угольной кислоты, при которой твёрдая форма полностью разлагается.
Соляный ангидрид свое название получил из-за формулы угольной кислоты, в которой содержится СО2. Газ может подвергаться обратному гидролизу, создавая устойчивую кислую среду. В растворах, содержащих эти элементы, возникает равновесная сложная система, которая сохраняет свою химическую формулу и физические свойства. При повышении температуры стабильность и равновесие такого раствора нарушается, а кислота начинает разлагаться. Полностью этот процесс завершается при кипячении водного раствора.
Угольная кислота, графическая формула которой выглядит как H2CO3, имеет нейтральную реакцию, образуя кислые и средние соли, в том числе гидрокарбонаты и карбонаты. На сегодняшний день это вещество отлично изучено, химикам известна степень, молярное уравнение, масса, константа и степень валентности. Такие соединения получили широкое распространение в пищевой промышленности, их используют в качестве консервантов и раскислителей, а также в бытовой химии для изготовления различных чистящих и моющих средств.
Видео:Опыты углекислый газ СО2, угольная кислота и карбонатыСкачать

Способы получения
Наибольшее распространение на сегодняшний день получила технология изготовления кислоты угольной путем растворения в воде структурной газовой формы диоксида углерода. Для производства этих соединений используют соответствующие установки, позволяющие увеличивать давление углекислоты, одновременно понижая температуру раствора. В подобных условиях концентрация угольной кислоты увеличивается и в последующем имеется возможность получения твердой формы за счёт понижения температуры до отметки -35 градусов и ниже.
Также в последние годы популярностью стала пользоваться технология производства солей путем взаимодействия гидрокарбонатов и карбонатов с еще более сильными кислотами. При этом лучшая часть полученных соединений разлагается на диоксид углерода и воду. Преимуществом такой технологии является простота используемого оборудования, не требуется одновременно охлаждать растворы и повышать давление CO2, но при этом отмечается большое количество отходов. Недостатком этой технологии является то, что требуется утилизировать углеродный диоксид, который превращается в пар.
Используемые сегодня высокотехнологичные установки позволяют получать чистую кислоту угольную, в особенности при применении технологии с экстремально низкими температурами. В последующем необходимо лишь обеспечить правильное хранение кристаллов, которые при температурах выше минус 30 градусов начинают растворяться, быстро теряя все свои свойства. Также возможно производство и последующее хранение различных солей на основе этого соединения, которые сохраняют свою форму и параметры даже при положительных температурах и доступе воздуха.
Видео:Неметаллы. Тема 25. Угольная кислота и ее соли. Видеоопыт «Взаимодействие карбонатов с кислотамиСкачать

Особенности применения
Угольная кислота и её соли сегодня активно используются в различных сферах жизнедеятельности человека. Они применяются в медицине, строительстве и кулинарии. Без этих микроэлементов невозможно было бы получение и возникновение следующих составов и материалов:
- мраморный камень;
- известняковые породы;
- кристаллическая и пищевая сода;
- мел;
- поташ.
Также из кислоты угольной получают углекислый газ, который требуется для изготовления газированной воды. Свойства этих соединений изменять показатели давления в зависимости от содержания ионов и кислотности позволяют на их основе выпускать хладагенты для морозильников и солнечных генераторов.
Такие кислоты и соли широко используются в пищевой промышленности, они полностью безопасны для организма человека. Из нее делаются разнообразные консерванты, которые не ухудшают свойства продуктов питания, существенно продлевая их срок хранения. Это соединение используется в качестве антиокислителя, его добавляют в кофе, чай и сыры. С открытием этой кислоты появилась возможность изготавливать разнообразные шипучие напитки, в том числе минералку, Coca- Cola и даже шампанское.
В последние годы широкое распространение получила литиевая соль, которую изготавливают из этой кислоты. Она применяется для производства керамических изделий, также ее добавляют в топливо для реактивных двигателей. Сегодня это химическое соединение активно применяется в стекловарении. На его основе выполняют специальные добавки, которые повышают прочность и эксплуатационные характеристики конечного материала. Силикатное стекло, в которое была добавлена литиевая соль, отличается не только прочностью, но и великолепными показателями проницаемости светового потока.
Кислоту угольную активно используют пожарные бригады, что позволяет им эффективно бороться с огнём. В жидком виде такие соединения содержат в специальных емкостях, после чего под высоким давлением направляют в распылители, смешивая со специальными химикатами, образующими густую пену. Это позволяет не только бороться с открытым пламенем, но и быстро тушить горящую нефть и различные нефтепродукты.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Использование в сельском хозяйстве
Кислота угольная сегодня широко используется в сельском хозяйстве для производства различных качественных минеральных удобрений. Это экологически чистые компоненты, которые применяются для подкормки различных овощных, фруктовых и плодовых культур, позволяя существенно повысить показатели урожайности.
На основе кислоты угольной выполняются следующие минеральные удобрения:
- кальцинированная сода;
- литиевая соль;
- карбамид или мочевина.
Наибольшее распространение сегодня получила мочевина или как она стала сегодня называться карбамид. Это простое в использовании эффективное удобрение, которое отличается универсальностью. С одинаковым успехом его можно вносить под плодовые деревья, фрукты и овощи, различные декоративные растения.
Несомненным преимуществом таких удобрений на основе угольной кислоты является доступная стоимость минеральных составов, их простота использования, эффективность и полная экологичность.
Видео:Урок химии, 9 класс, тема "Соли угольной кислоты" (учитель Швецова Елена Евгеньевна)Скачать

Средняя стоимость
На сегодняшний день в России имеется несколько крупных производителей кислоты угольной, которые изготавливают как соли, так и чистые вещества. В среднем стоимость одного килограмма такого соединения составляет 3−4 тысячи рублей.
Также востребован мел, который изготавливают с использованием этой кислоты, он применяется в кормовых и технических целях. За одну тонну мела обычно просят 1200 рублей.
В редких случаях используется так называемый угольный снег, то есть кристаллы твердой формы этой кислоты. Они имеют крайне высокую стоимость, доходящую до 10000 рублей за килограмм и более. При этом необходимо обеспечить соответствующие условия хранения, в том числе поддержание температуры на уровне минус 30−35 градусов, что предупреждает его разложение. Это соединение применяется в химической промышленности, а также при производстве разнообразных продуктов питания.
🌟 Видео
КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

11 класс. Химия. Оксиды углерода. Угольная кислота, карбонаты и гидрокарбонатыСкачать

№ 240. Неорганическая химия. Тема 29. Углерод и его соединения. Часть 9. Угольная кислота и ее солиСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать