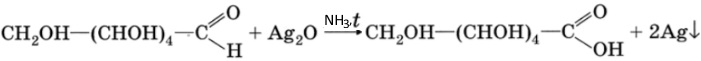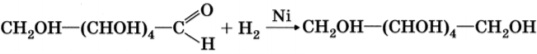FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие вещества называют углеводами?
Углеводы ― органические соединения, состоящие из одной или нескольких молекул простых сахаров (многоатомных альдегидо- или кетоноспиртов).
Углеводы ― органические соединения с общей формулой Cm(H2O)n, где m, n ≥ 3.
Предложите признак, на основании которого этот тип веществ можно разделить на классы. Назовите эти классы и приведите примеры представителей каждого из них.
По числу остатков моносахаридов в молекуле углеводы разделяют на моносахариды (глюкоза C6H12O6 , фруктоза C6H12O6 , галактоза C6H12O6 , рибоза C5H10O5 , дезоксирибоза C5H10O4 ), олигосахариды (сахароза, мальтоза, лактоза), полисахариды (крахмал, целлюлоза, гликоген).
По способности гидролизоваться углеводы разделяют на моносахариды (глюкоза, фруктоза, галактоза), дисахариды (сахароза, мальтоза, лактоза), полисахариды (крахмал, целлюлоза, гликоген, хитин).
Моносахариды содержат 1 моносахаридный остаток, олигосахариды ― от 2 до 10 моносахаридных остатков, а полисахариды ― от 10 до 5000 моносахаридных остатков.
Задание 2
Почему глюкозу относят к соединениям с двойственной функцией?
Глюкоза проявляет характерные свойства двух разных класов органических соединений, т.к. является одновременно и многоатомным спиртом, и альдегидом, то есть альдегидоспиртом.
Ответ подтвердите уравнениями химических реакций.
Глюкоза, как многоатомный спирт, взаимодействует со свежеполученным осадком гидроксида меди (II) с растворением осадка и образованием ярко-синего раствора сахарата меди (II).
Глюкоза, как альдегид, при нагревании со свежеполученным осадком гидроксида меди (II) дает осадок красного цвета оксида меди (I):
Глюкоза, как альдегид, с аммиачным раствором оксида серебра (I) при небольшом нагревании дает реакцию «серебряного зеркала»:
Задание 3
Какие вещества называют дисахаридами?
Дисахариды ― углеводы, состоящие из двух остатков моносахаридов.
Приведите примеры. Cахароза, лактоза, мальтоза.
Задание 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) крахмал ⟶ глюкоза ⟶ сорбит;
(C6H10O5)n + nH2O ⟶ nC6H12O6
б) глюкоза ⟶ глюконовая кислота ⟶ глюконат кальция;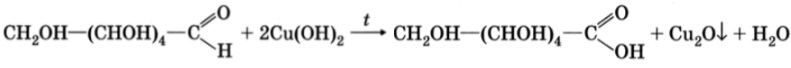
2CH2OH―(CHOH)4 ― COOH + Ca(OH)2 ⟶ (CH2OH ― (CHOH)4 ― COO)2Ca + 2H2O
в) глюкоза ⟶ этиловый спирт ⟶ этиловый эфир уксусной кислоты.
C6H12O6 дрожжи ⟶ 2C2H5OH + 2CO2↑
CH3COOH + C2H5OH ⇄ CH3COOC2H5 + H2O
Задание 5
Сравните состав, строение, физические и химические свойства крахмала и целлюлозы.
Крахмал и целлюлоза состоят из полисахаридов, и имеют одинаковую молекулярную формулу (C6H10O5)n.
Молекулы крахмала имеют как линейное, так и разветвленное строение, а целлюлозы ― только линейное строение. Степень полимеризации макромолекул крахмала меньше, чем у целлюлозы.
Крахмал ― порошок белого цвета, зёрна которого набухают в горячей воде с образованием крахмального клейстера, а целлюлоза ― порошок белого цвета, не растворяется в воде и не набухает даже в горячей.
В отличие от целлюлозы крахмал дает синюю окраску при взаимодействии с иодом (качественная реакция на крахмал) .
Целлюлоза значительно труднее подвергается гидролизу, чем крахмал.
(C6H10O5)n + nH2O → nC6H12O6
Задание 6
Рассчитайте объём углекислого газа (н.у.), который выделяется при спиртовом брожении 200 кг 9%-ного раствора глюкозы. Какая масса этилового спирта при этом получится?
Дано: m(раствора)=200 кг, ω(C6H12O6)=9%
Найти: V(CO2)-?, m(C2H5OH)-?
Решение
1-й способ
1. Рассчитываем массу глюкозы в растворе:
m( C6H12O6 )=ω( C6H12O6 )•m(раствора):100%=9%•200 кг:100%=18 кг
2. Вычисляем к оличество вещества глюкозы массой 18 кг по формуле: n=m/M, где M ― молярная масса.
Mr(C6H12O6)=180, поэтому M( C6H12O6 )=180 кг/кмоль
n( C6H12O6 )=m( C6H12O6 )/M( C6H12O6 )=18 кг : 180 кг/кмоль=0,1 кмоль
3. Составим химическое уравнение:
C6H12O6 ⟶ 2C2H5OH + 2CO2↑
По уравнению реакции n( C6H12O6 ):n( C2H5OH ) :n( CO2 ) =1:2:2 , поэтому
n( C2H5OH )= n( CO2 )=2 • n( C6H12O6 )=2 •0 ,1 кмоль=0,2 кмоль
4. Вычисляем объём углекислого газа количеством вещества 0,2 кмоль по формуле: V=n•VM, где VM=22,4 м 3 /кмоль ― молярный объём.
V ( CO2 )=n ( CO2 )•VM=0,2 кмоль • 22,4 м 3 /кмоль=4,48 м 3
5. Вычисляем массу этилового спирта к оличеством вещества 0,2 кмоль по формуле: m= n • M, где M ― молярная масса.
M(C2H5OH)=46 кг/кмоль
m ( C2H5OH )= n ( C2H5OH ) • M( C2H5OH )=0,2 кмоль • 46 кг/кмоль=9,2 кг
2-й способ
1. Рассчитываем массу глюкозы в растворе:
m( C6H12O6 )=ω( C6H12O6 )•m(раствора):100%=9%•200 кг:100%=18 кг
2. Составим химическое уравнение:
18 кг х кг у м 3
C6H12O6⟶ 2C2H5OH + 2CO2↑
180 кг 92 кг 44,8 м 3
Над формулами соединений C6H12O6, C2H5OH и CO2 записываем вычисленную массу глюкозы (18 кг) и неизвестные массы этилового спирта и объём углекислого газа (х кг и у м 3 соответственно), а под формулами соединений ― массу и объём соответствующего количества вещества согласно коэффициентам в химическом уравнении. Для этого вычисляем молярную массу веществ и, соответственно, массу 1 кмоль глюкозы и массу 2 кмоль этилового спирта, так как с 1 кмоль глюкозы C6H12O6 образуется 2 кмоль этилового спирта C2H5OH и 2 кмоль углекислого газа CO2 (1 кмоль любого газа при н.у. занимает объем 22,4 м 3 , а 2 кмоль ― в 2 раза больший объём, т.е. 44,8 м 3 ).
M(C6H12O6)=180 кг/кмоль, масса 1 кмоль=180 кг
M(C2H5OH)=46 кг/кмоль, масса 1 кмоль=46 кг, а масса 2 кмоль=92 кг
х= m ( C2H5OH )=92 кг • 18 кг : 180 кг=9,2 кг
у=V(CO 2 )=18 кг • 44,8 м 3 : 180 кг=4,48 м 3
Ответ: при спиртовом брожении 200 кг 9%-ного раствора глюкозы получилось 18 кг этилового спирта и выделилось 4,48 м 3 углекислого газа .
Задание 7 Целлюлоза используется в пищевой промышленности как добавка, препятствующая слёживанию и комкованию порошкообразных продуктов (код E460). Под действием соляной кислоты в желудке человека примерно 5% целлюлозы гидролизуется. Какая масса глюкозы получится при гидролизе из 8,1 г полисахарида?
Дано: mпракт.((C6H10O5)n)=8,1 г, η( (C6H10O5)n )=5%
Найти: m(C6H12O6)-?
Решение
1-й способ
1. Рассчитываем массу целлюлозы, которая практически гидролизуется:
m( (C6H10O5)n )=ω( (C6H10O5)n )•mпракт.( (C6H10O5)n ):100%=5%•8,1 г:100%=0,405 г
2. Вычисляем к оличество вещества целлюлозы массой 0,405 г по формуле: n=m/M, где M ― молярная масса.
Mr((C6H10O5)n)=162n, поэтому M(( C6H10O5 )n)=162n г/моль
n( (C6H10O5)n )=m( (C6H10O5)n )/M( (C6H10O5)n )=0,405 г : 162n г/моль=0,0025/n моль
3. Составим химическое уравнение:
(C6H10O5)n + nH2O → nC6H12O6 ↑
По уравнению реакции n( (C6H10O5)n ):n( C6H12O6 )=1:n , поэтому
n( C6H12O6 )=n • n( (C6H10O5)n )=n • 0 ,0025/n моль=0,0025 моль
4. Вычисляем массу глюкозы к оличеством вещества 0,0025 моль по формуле: m= n • M, где M ― молярная масса.
M(C6H12O6)=180 г/моль
m ( C6H12O6 )= n ( C6H12O6 ) • M( C6H12O6 )=0,0025 моль • 180 г/моль=0,45 г
2-й способ
Рассчитываем массу целлюлозы, которая практически гидролизуется:
m( (C6H10O5)n )=ω( (C6H10O5)n )•mпракт.( (C6H10O5)n ):100%=5%•8,1 г:100%=0,405 г
2. Составим химическое уравнение:
0,405 г х г
(C6H10O5)n + nH2O → nC6H12O6 ↑
162n г 180n г
Над формулами соединений (C6H10O5)n и C6H12O6 записываем вычисленную массу целлюлозы (0,405 г) и неизвестную массу глюкозы (х г), а под формулами соединений ― массу соответствующего количества вещества согласно коэффициентам в химическом уравнении. Для этого вычисляем молярную массу веществ и, соответственно, массу 1 моль целлюлозы и массу n моль глюкозы, так как с 1 моль целлюлозы (C6H10O5)n образуется n моль глюкозы C6H12O6.
M((C6H10O5)n)=162n г/моль, м асса 1 моль=162n г
M(C6H12O6)=180 г/моль, масса 1 моль=180 г, а масса n моль=180n г
х= m ( C6H12O6 )=0,405 г • 180n г : 162n г=0,45 г
Ответ: 0,45 г C6H12O6
- Химические свойства глюкозы методическая разработка по химии (10 класс)
- Скачать:
- Предварительный просмотр:
- Подписи к слайдам:
- Предварительный просмотр:
- Углеводы
- Классификация углеводов
- По числу структурных звеньев
- По числу атомов углерода в молекуле
- По размеру кольца в циклической форме молекулы
- Химические свойства, общие для всех углеводов
- 1. Горение
- 2. Взаимодействие с концентрированной серной кислотой
- Моносахариды
- Глюкоза
- Химические свойства глюкозы
- Водный раствор глюкозы
- Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
- Реакции на карбонильную группу — CH=O
- Получение глюкозы
- Гидролиз крахмала
- Синтез из формальдегида
- Фотосинтез
- Фруктоза
- Дисахариды
- Сахароза (свекловичный или тростниковый сахар) С12Н22О11
- Мальтоза С12Н22О11
- Полисахариды
- Крахмал
- Свойства крахмала
- Целлюлоза
- Свойства целлюлозы
Видео:Химия 10 класс (Урок№10 - Углеводы. Глюкоза. Олигосахариды. Сахароза.)Скачать

Химические свойства глюкозы
методическая разработка по химии (10 класс)
Химические свойства глюкозы
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Скачать:
| Вложение | Размер |
|---|---|
| himicheskie_svoystva_glyukozy.pptx | 919.47 КБ |
| himicheskie_svoystva_glyukozy.docx | 663.28 КБ |
Предварительный просмотр:
Видео:Опыты по химии. Обнаружение глюкозы в виноградном соке и медеСкачать

Подписи к слайдам:
Химические свойства глюкозы 1 Бикеева Кристина Анатольевна
Тема урока: «Химические свойства глюкозы». Тип урока: урок – рефлексия. Цель урока: повторение, закрепление знаний о химических свойствах глюкозы, а также при необходимости коррекция изученного материала. 2
Задачи урока Образовательные Развивающие Воспитывающие повторить изученный материал по теме углеводы, закрепить знания учащихся о химических свойствах глюкозы; сформировать умения составлять уравнения соответствующих реакций; сформировать умения решать задачи. совершенствовать умения извлекать информацию из наблюдаемых процессов, устного сообщения, справочных материалов; продолжить формирование умений анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы. продолжить формирование научного мировоззрения учащихся, формируя убеждения в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире. 3
Планируемые результаты 4 Предметные: знать химические свойства глюкозы; уметь характеризовать химические свойства глюкозы; составлять уравнения реакций, решать задачи. Личностные: умение соотносить свои действия с планируемыми результатами; осуществлять контроль своей деятельности в процессе достижения результата; корректировать свои действия в соответствии с изменяющейся ситуацией. Метапредметные: Познавательные: умение определять понятия, умение работать с информацией, выделять главное, устанавливать причинно-следственные связи, строить логичные рассуждения и делать выводы; высказывать суждения; использовать знаки, символы, схемы, алгоритм для выполнения заданий; осуществлять поиск информации в соответствии с поставленной задачей, используя различные ресурсы информационной среды. Регулятивные: умение переносить имеющиеся знания на новый изучаемый объект, умение осуществлять контроль, самоконтроль, взаимопомощь. Коммуникативные: готовность получать необходимую информацию, выдвигать гипотезу, доказательства, продуктивно взаимодействовать со своими партнерами.
Методы обучения и формы организации учебной деятельности 5 Общелогические Общепедагогические Специфические Анализ, обобщение, систематизация Беседа, повествование, самостоятельная работа Химический эксперимент Средства обучения Учебно-материальные (+УМК) Дидактико-методические Психолого-педагогические Оборудование кабинета химии: Проектор, доска, презентация, химическая посуда, реактивы, учебник Химия 10 класс под редакцией Н.Е. Кузнецовой (профильный уровень) 1) химический язык 2) дидактические материалы: карточки 3) Химический эксперимент 1) вопросы 2) задачи 3) тесты Форма организации учебной деятельности: фронтальная, индивидуальная, коллективная.
Мотивационно-целевой этап (2 мин.) Интересные факты 6 А знаете ли вы, что… • Выполняя функцию источника энергии для многочисленных процессов, протекающих в клетках организма, глюкоза является компонентом крови, концентрация которого должна сохраняться на строго определенном уровне (80-120 мг в 100 мл крови). Превышение такого уровня ведет к нарушению углеводного обмена и развитию сахарного диабета – распространенный сегодня даже среди молодежи болезни. Итак, в клетках и тканях организма человека глюкоза многофункциональна; оперативно окисляется кислородом в процессе клеточного дыхания, при избытке ее в крови складывается в печени в виде гликогена. • Некоторые лягушки нашли применение глюкозе в своём организме — любопытное, хотя и гораздо менее важное. В зимние время иногда можно найти лягушек, вмёрзших в ледяные глыбы, но после оттаивания земноводные оживают. Как же они ухитряются не замёрзнуть насмерть? Оказывается, с наступлением холодов в крови лягушки в 60 раз увеличивается количество глюкозы. Это мешает образованию внутри организма кристалликов льда.
Этап включения в систему знаний и повторения (3 мин.) 7 Блиц-опрос — какие соединения называют углеводами? — какие химические элементы входят в состав углеводов? — охарактеризуйте строение глюкозы, перечислите какие функциональные группы входят в состав глюкозы? — как классифицируют углеводы в зависимости от их строения и способности к гидролизу? — охарактеризуйте физические свойства глюкозы?
Этап актуализации знаний и фиксации затруднений в индивидуальной деятельности (7 мин.) Корзина идей 8 В течение двух минут каждому ученику необходимо самостоятельно записать все в тетрадях, что ему известно по теме «Химические свойства глюкозы». Далее по парам учащиеся делятся знаниями, обмениваются информацией. На следующем этапе (коллективном) каждый называет одно сведение, факт по теме (без повторов!). Все сведения записываются на листочках и прикрепляются к корзине без комментирования. Сразу видно, кто активно «наполняет корзину», а кому требуется помощь.
Локализация индивидуальных затруднений (15 мин.) 9 Цель данного этапа — научить детей шаг за шагом анализировать свои действия и понять, почему именно это упражнение вызвало затруднения. Удобнее всего работать по вопросам: Какое задание я выполнял? Какое знание я использовал / каким способом решал задачу? Что делал сначала? Потом? Где возникло затруднение? Почему? Чего мне хватает для правильного решения?
Локализация индивидуальных затруднений 10 Карточки 1) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) углекислый газ → глюкоза→ сорбит; б) глюкоза → глюконовая кислота→ глюконат натрия (натриевая соль глюконовой кислоты); в) глюкоза → этиловый спирт→ этилен ↓ молочная кислота 2) В результате спиртового брожения глюкозы получен этанол, который окислили до кислоты. При действии избытка гидрокарбоната калия на всю полученную кислоту выделился газ объемом 8,96 л ( н.у .). Определите массу глюкозы, подвергшуюся брожению. 3) При нагревании раствора глюкозы с голубым осадком гидроксида меди (II) цвет осадка изменился на красный. Составьте уравнение реакции и вычислите массу полученного осадка, если глюкоза взята массой 18 г.
Локализация индивидуальных затруднений Ответы 11
Локализация индивидуальных затруднений Ответы 12 Решение для задачи №1: реакции: С 6 Н 12 О 6 = 2С 2 Н 5 ОН + 2СО 2 С 2 Н 5 ОН + [O] = CH 3 COOH CH 3 COOH +NaHCO 3 = CH 3 COONa + CO 2 +H 2 O n (СО 2 )=8.96/22.4 = 0.4моль тогда n (CH 3 COOH) = 0.4 моль тогда n (С 2 Н 5 ОН) = 0.4 моль по первому уравнению n(С 6 Н 12 О 6 ) = 0.4/2=0.2 моль m(С 6 Н 12 О 6 )=0.2*180=36 г. Ответ: m(С 6 Н 12 О 6 ) = 36 г. Решение для задачи №2: С 6 Н 12 О 6 +Cu(OH) 2 = С 6 Н 12 О 7 + С u 2 О↓+ Н 2 О n (С 6 Н 12 О 6 ) = m / M = 18/180=0,1моль; n (С u 2 О)=0,1моль ; m (С u 2 О)= n * M =0,1*160=16г. Ответ: m (С u 2 О)=16 г.
Демонстрация эксперимента (5 мин.) 13
Контрольно-оценочный этап (самостоятельная работа-тест с взаимопроверкой) (7 мин.) 14
Контрольно-оценочный этап (самостоятельная работа-тест с взаимопроверкой) 15
Контрольно-оценочный этап (самостоятельная работа-тест с взаимопроверкой) 16
Контрольно-оценочный этап (самостоятельная работа-тест с взаимопроверкой) 17
Этап информации о домашнем задании (1 мин.) 18 Параграф 42, стр. 253 ответить на вопросы
Рефлексия учебной деятельности на уроке (3 мин.) 19 Какими свойствами обладает глюкоза? Какие типы реакций характерны для глюкозы? Ваши главные результаты сегодня? Благодаря чему вам удалось их достичь? Какие трудности встретились во время выполнения задания, как вы их преодолевали? Какие идеи возникли во время выполнения задания? Вопросы и пожелания, возникшие в связи с темой урока. Выставление оценок за урок.
Видео:Свойства глюкозы. 11 класс.Скачать
Предварительный просмотр:
- Тема урока: Химические свойства глюкозы
- Тип урока: урок-рефлексия
- Вид урока: комбинированный
- Цель урока: повторение, закрепление знаний о химических свойствах глюкозы, а также при необходимости коррекция изученного материала.
- Задачи урока:
повторить изученный материал по теме углеводы, закрепить знания учащихся о химических свойствах глюкозы; сформировать умения составлять уравнения соответствующих реакций; сформировать умения решать задачи.
совершенствовать умения извлекать информацию из наблюдаемых процессов, устного сообщения, справочных материалов; продолжить формирование умений анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы.
продолжить формирование научного мировоззрения учащихся, формируя убеждения в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире.
знать химические свойства глюкозы; уметь характеризовать химические свойства глюкозы; составлять уравнения реакций, решать задачи.
умение соотносить свои действия с планируемыми результатами; осуществлять контроль своей деятельности в процессе достижения результата; корректировать свои действия в соответствии с изменяющейся ситуацией.
Познавательные: умение определять понятия, умение работать с информацией, выделять главное, устанавливать причинно-следственные связи, строить логичные рассуждения и делать выводы; высказывать суждения; использовать знаки, символы, схемы, алгоритм для выполнения заданий; осуществлять поиск информации в соответствии с поставленной задачей, используя различные ресурсы информационной среды.
Регулятивные: умение переносить имеющиеся знания на новый изучаемый объект, умение осуществлять контроль, самоконтроль, взаимопомощь.
Коммуникативные: готовность получать необходимую информацию, выдвигать гипотезу, доказательства, продуктивно взаимодействовать со своими партнерами.
Видео:51. Углеводы. Глюкоза. Фруктоза (чась 2)Скачать

Углеводы
Теория по теме Углеводы. Краткие конспект по углеводам. Классификация углеводов, химические свойства углеводов, способы получения углеводов. Свойства и получение моносахаридов (глюкоза, фруктоза), олигосахаридов (сахароза и др.), полисахаридов.
| Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. |
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
Видео:10 класс § 60 "Химические свойства моносахаридов"Скачать

Классификация углеводов
Видео:Углеводы. Глюкоза. Олигоса- хариды. СахарозаСкачать

По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6 Дезоксирибоза С5Н10О4 | Сахароза С12Н22О11 Целлобиоза С12Н22О11 | Целлюлоза (С6Н10О5)n Крахмал(С6Н10О5)n |
Видео:ХИМИЧЕСКИЕ СВОЙСТВА ГЛЮКОЗЫСкачать

По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
Видео:Углеводы. Тема 33. Химические свойства глюкозыСкачать

По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
Видео:Моносахариды. Глюкоза. 11 класс.Скачать

Химические свойства, общие для всех углеводов
Видео:Углеводы. ГлюкозаСкачать

1. Горение
Все углеводы горят до углекислого газа и воды.
| Например, при горении глюкозы образуются вода и углекислый газ |
Видео:Химия 10 класс (Урок№11 - Полисахариды. Крахмал. Целлюлоза.)Скачать

2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
| Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода |
Видео:Моносахариды на примере глюкозы. Строение глюкозы. Видеоурок по химии 10 классСкачать

Моносахариды
| Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных. |
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза C6H12O6 | Фруктоза C6H12O6 | Рибоза C5H10O5 |
| Структурная формула |  |  |  |
| Классификация |
|
|
|
Видео:Лекция 4.2 Аэробный этап гликолиза. Декарбоксилирование пировиноградной кислоты. Цикл Кребса.Скачать

Глюкоза
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
| α-глюкоза | β-глюкоза |
 |  |
Видео:Глюкоза строение, свойства, применение | Химия 10 класс #38 | ИнфоурокСкачать

Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
| Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи. |
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:
Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
| Простые эфиры глюкозы получили название гликозидов. |
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
| Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы): |
Видео:Моносахариды за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать

Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
Видео:97. Глюкоза (структурные формулы)Скачать

Фруктоза
| Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы). |
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
| Фруктоза | α-D-фруктоза | β-D-фруктоза |
 |  |  |
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Видео:Решение цепочек реакций. Урок 26. Химия 10 классСкачать

Дисахариды
| Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). |
Видео:Биохимия. Лекция 50. Углеводы. Глюкозо-лактатный цикл (Кори). Глюконеогенез. Пентозофосфатный путь.Скачать

Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
| Поэтому сахароза не вступает в реакции альдегидной группы – с аммиачным раствором оксида серебра с гидроксидом меди при нагревании. Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться. |
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
Видео:Полный разбор одного варианта ЕНТ ХИМИЯ за 40 минСкачать

Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
| Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов. |
При гидролизе мальтозы образуется глюкоза.
Полисахариды
| Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. |
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:
Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Свойства целлюлозы
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.
- Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.