РЕАКЦИЯ АНТИПИРИНА И АМИДОПИРИНА С ХЛОРИДОМ ЖЕЛЕЗА (III)
В пробирку поместите несколько кристаллов антипирина, прибавьте 2 капли воды и каплю 1% раствора хлорида железа (III). Появляется интенсивное и стойкое оранжево-красное окрашивание, не исчезающее при стоянии. Для сравнения поместите в другую пробирку несколько капель амидопирина, добавьте 2 капли воды и I каплю 1% раствора хлорида железа (III). Появляется фиолетовое окрашивание, быстро исчезающее. Добавьте еще сразу 3 капли хлорида железа. Окраска вновь появляется, сохраняется несколько дольше, но постепенно бледнеет.
Окрашивание амидопирина с хлоридом железа (III) обусловлено образованием комплексного соединения ферропирина, амидопирина — образованием продуктов окисления.
Реакция с хлоридом железа (III) является качественной, позволяющей отличить амидопирин от аспирина.
Какое практическое значение имеет реакция антипирина и амидопирина с хлоридом железа (III)?
РЕАКЦИЯ АМИДОПИРИНА И АНТИПИРИНА С АЗОТИСТОЙ КИСЛОТОЙ
В пробирку поместите несколько кристаллов антипирина, добавьте 2 капли воды, 1 каплю 10% раствора серной кислоты и 1 каплю 5% раствора нитрита натрия. Появляется изумрудно-зеленое окрашивание, постепенно исчезающее, особенно при избытке нитрита натрия. Для сравнения поместите в другую пробирку несколько кристаллов амидопирина. Добавьте 2 капли воды, 1 каплю 10%раствора серной кислоты и 1 каплю 5 % раствора нитрита натрия. Появляется нестойкое фиолетовое окрашивание. Если окрашивание исчезает слишком быстро, добавьте еще немного амидопирина.
С амидопирином образуются окрашенные продукты окисления.
Подобно приведенным реакциям с хлоридом железа (III), реакция с азотистой кислотой применяется в фармацевтической практике для распознавания антипирина и амидопирина и отличая их друг от друга.
Напишите схему взаимодействия антипирина с азотистой кислотой.
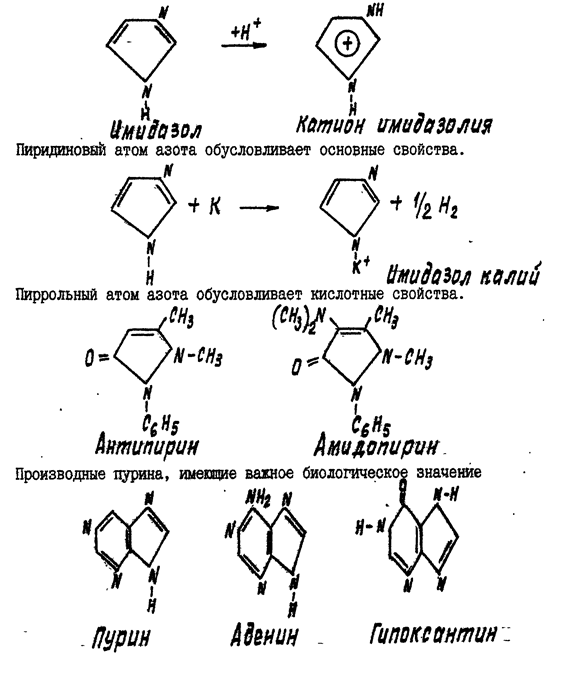
РАСТВОРИМОСТЬ ПИРИДИНА В ВОДЕ И ЕГО ОСНОВНОЙ ХАРАКТЕР
В пробирку поместите 1 каплю пиридина. Обратите внимание на eгo характерный запах (запах денатурата). Добавьте 1 каплю воды, сразу получается прозрачный раствор. Добавьте еще .4 капли воды. Пиридин хорошо растворим в воде и смешивается с ней во всех отношениях.
Пинцетом возьмите узкую полоску красной лакмусовой бумажки и смочите ее раствором пиридина, для чего наклоните пробирку с раствором. Можно заметить только слабое посинение лакмусовой бумажки, точнее — переход от красного цвета к фиолетовому,чтоуказывает на слабоосновный характер пиридина.
Почему пиридин проявляет основный характер?
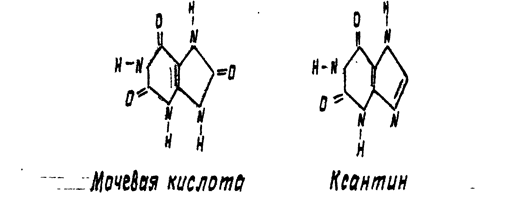
РАСТВОРИМОСТЬ МОЧЕВОЙ КИСЛОТЫ И ЕЕ НАТРИЕВОЙ СОЛИ В ВОДЕ
В пробирку поместите небольшое количество (на кончике лопаточки) мочевой кислоты. Прибавьте по каплям воду, каждый развстряхивая пробирку. Обратите внимание на плохую растворимость мочевой кислоты в воде. В холодной воде мочевая кислота почти нерастворима: 1 часть ее растворяется в 39 000 частях воды.
После добавления 8 капель воды растворения все еще не заметно. Стоит, однако, добавить всего 1 каплю 10 % раствора гидроксида натрия, как мутный раствор моментально просветляется вследствие образования относительно легко растворимой двузамещенной соли натрия. Полученный раствор сохраните для последующего опыта.
Напишите схему взаимодействия мочевой кислоты с гидроксидом натрия.
ОТКРЫТИЕ МОЧЕВОЙ КИСЛОТЫ (МУРЕКСИДНАЯ ПРОБА)
На предметное стекло с помощью пипетки поместите 1 каплю концентрированной азотной кислоты и осторожно выпаривайте, держа стекло над пламенем горелки на некотором расстоянии (примерно 10 см). Как только раствор выпарится и начнется слабое покраснение пятна на месте бывшей капли, прекратите нагревание. Когда стекло остынет, сбоку от пятна поместите 1 каплю 10 % раствора аммиака. На месте соприкосновения наблюдается появление полоски пурпурно-фиолетового цвета (мурексидная проба).
При окислении азотной кислоты мочевая кислота, как прочие пуриновые основания (например, кофеин), образует аллоксантин. При смачивании образовавшегося аллоксантина аммиаком, получается аммониевая соль, очень неустойчивой в свободном виде пурпурной кислоты – мурексин. Мурексидная проба применяется при анализе мочевых камней. Применяется эта проба также при открытии кофеина, теобромина и других пуриновых оснований.
Объясните причины возникновения окрашивания в мурексидной пробе.
Результаты наблюдений и уравнения реакций запишите в таблицу 10.
Видео:Взаимодействие хлорида железа (III) с гидроксидом натрия FeCl3 + 3NaOH = Fe(OH)3 + 3NaClСкачать

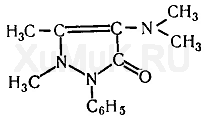
§ 30. АМИДОПИРИН
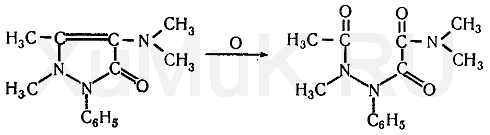
Амидопирин (пирамидон, аминофеназон, аминопирин и др.) — 1-фенил-2,3-диметил-4-диметиламинопиразолон-5 — мелкие бесцветные кристаллы, слегка горьковатого вкуса. При действии окислителей на амидо пирин образуется ряд окрашенных промежуточных продуктов. При дальнейшем окислении этих продуктов образуется бесцветное вещество диоксиамидопирин:
Промежуточные продукты окисления амидопирина имеют синюю или сине-фиолетовую окраску. Окраска возникает при взаимодействии амидопирина с растворами хлорида железа (III), азотной и азотистой кислот, нитрата серебра, оксидом свинца (IV) и другими окислителями. Амидопирин растворяется в хлороформе (1:1), этиловом спирте (1:2), диэтиловом эфире (1 : 13), в воде (1 :20).
Амидопирин экстрагируется органическими растворителями из кислых и щелочных водных растворов.
Применение. Действие на организм. Амидопирин оказывает жаропонижающее, болеутоляющее и противовоспалительное действие. Применяется при головных болях, невралгии, миозите, остром суставном ревматизме, артритах и т. д. При длительном применении амидопирина в отдельных случаях наблюдается угнетение кроветворения, кожные сыпи и т. д.
Метаболизм. Амидопирин подвергается метаболизму путем деметилирования и ацетилирования. Метаболитами амидопирина являются 4-аминоантипирин, метиламиноантипирин, рубазоновая и метилрубазоновая кислоты. Эти кислоты имеют красноватую окраску. Из-за наличия указанных кислот в моче лиц, принимающих большие дозы амидопирина, она может иметь красновато-буроватую окраску.
Для обнаружения амидопирина применяют цветные реакции, реакции осаждения, хроматографический и спектроскопический методы.
Амидопирин с реактивами группового осаждения алкалоидов (таннин, пикриновая кислота, реактив Майера и др.) дает осадки.
Реакция с хлоридом железа (III). На предметное стекло наносят раствор исследуемого вещества и выпаривают досуха. К сухому остатку прибавляют каплю 1 %-го раствора хлорида железа. В присутствии амидопирина появляется фиолетовая окраска, исчезающая от избытка реактива.
Реакция с нитратом серебра. В пробирку вносят 2—4 капли водного раствора исследуемого вещества, прибавляют 3—5 капель 1 %-го раствора нитрата серебра и нагревают на водяной бане в течение 3—5 мин. Появление фиолетовой окраски указывает на наличие амидопирина в растворе. При больших количествах амидопирина может выпадать черный осадок металлического серебра.
Реакция с азотистой кислотой. На предметное стекло наносят несколько капель раствора исследуемого вещества и выпаривают досуха. К сухому остатку прибавляют 1 каплю воды, 1 каплю 10%-го раствора серной кислоты и несколько капель насыщенного раствора нитрита натрия. При наличии амидопирина появляется фиолетовая окраска, исчезающая от избытка реактива.
Обнаружение амидопирина и антипирина при их совместном присутствии. Для этой цели применяют описанную выше реакцию с азотистой кислотой. Вначале появляется фиолетовая окраска, которую дает амидопирин. Затем под влиянием избытка реактива эта окраска исчезает, а появляется зеленая (нитрозоантипирин).
Реакция с серной и хромотроповой кислотами. От прибавления к амидопирину концентрированной серной кислоты, а затем хромотроповой кислоты появляется фиолетовая окраска. При этой реакции в результате взаимодействия концентрированной серной кислоты с амидопирином выделяется формальдегид, который с хромотроповой кислотой дает фиолетовую окраску (см. гл. IV , § 7).
Обнаружение амидопирина по УФ- и ИК-спектрам. УФ-спектр амидопирина в 0,1 н. растворе серной кислоты имеет максимум поглощения при длине волны, равной 256 нм, и минимум — при 228 нм, а также изгиб при 242 нм. В ИК-области спектра амидопирин (диск с бромидом калия) имеет основные пики при 1660, 1315 и 1126 см -1 .
Обнаружение амидопирина методом хроматографии. Для обнаружения амидопирина методом хроматографии используется методика, которая применяется для обнаружения ноксирона (см. гл. V, § 27). Пластинку опрыскивают реактивом Драгендор-фа, модифицированным по Мунье. Пятна амидопирина на хроматограмме имеют бурую окраску (Rf = 0,15. 0,17).
Видео:Качественная реакция на фенол (С ХЛОРИДОМ ЖЕЛЕЗА 3)Скачать

Анализ лекарственной формы состава: амидопирина 0,3; дибазола 0,02
Амидопирин — белые кристаллы или белый кристаллический порошок без запаха, слабогорького вкуса. Температура плавления 110 — 113 С. Медленно растворяется в воде, легко — в спирте и в хлороформе.
Водные растворы имеют щелочную реакцию среды. Проявляет свойства восстановителя, с ионами тяжёлых металлов образует устойчивые комплексы.
Реакции подлинности на амидопирин основаны на его способности окисляться с образованием окрашенных продуктов:
Реакция с нитратом серебра (ГФ Х): к раствору амидопирина прибавляют 1-2 капли раствора нитрата серебра; появляется сине-фиолетовое окрашивание, затем выпадает серый осадок восстановленного серебра.
Реакция с хлоридом окисного железа (ГФ Х): к раствору амидопирина прибавляют раствор окисного железа, при этом появляется быстро исчезающее сине-фиолетовое окрашивание, затем выпадает бурый осадок. После подкисления несколькими каплями разведённой соляной кислоты появляется интенсивное сине-фиолетовое окрашивание.
Реакция образования берлинской лазури (ГФ Х):к раствору 0,01-0,02 г амидопирина в 1-2 мл воды прибавляют 2 мл свежеприготовленного раствора феррицианида калия, 1 каплю раствора хлорида окисного железа. Появляется тёмно-синее окрашивание:

Методы количественного определения
Титрование в неводных растворителях (ГФ Х) проводят в среде безводной уксусной кислоты 0,1 н. раствором хлорной кислоты (индикатор — раствор тропеолина 00 в метиловом спирте). Э= М.м.

Титрование соляной кислотой. Препарат растворяют в воде, прибавляют 2 капли раствора метилового оранжевого, 1 каплю раствора метиленового синего и титруют 0,1 н. раствором соляной кислоты до появления красно-фиолетовой окраски:
Э= М.м., 1 мл 0,1 н. раствора соляной кислоты соответствует 0,02313 г амидопирина.
Цериметрическое определение. К 0,02 г препарата прибавляют 2-3 мл разведённой серной кислоты, 1 каплю раствора о-фенантролина (ферроина) и титруют 0,1 н. раствором сульфата церия (IV) до исчезновения красного окрашивания:
Э= М.м. /4, 1 мл 0,1 н. раствора сульфата церия соответствует 0,00587 г амидопирина.
Дибазол — белый или белый со слегка сероватым или желтоватым оттенком кристаллический порошок, горько-соленого вкуса. Гигроскопичен. Температура плавления 182-186 °С. Трудно растворим в воде, легко — в спирте, трудно или практически нерастворим в других органических растворителях.
Проверка подлинности дибазола
Образование полийодида. В 3-5 мл воды растворяют 0,01-0,02 г препарата, прибавляют 3 капли разведённой соляной кислоты, 2-3 капли 0,1 н. раствора йода и взбалтывают. Образуется красно-серебристый осадок полийодида состава:
Образование серебряной соли. В 1 мл спирта растворяют 0,01-0,02 г препарата, прибавляют 1 мл концентрированного раствора аммиака и 2-3 капли раствора нитрата серебра; образуется белый осадок серебряной соли дибазола:
Реакция окисления ванадатом аммония. В 1 мл хлороформа растворяют 0,01-0,02 г препарата, прибавляют 3-5 капель 1% раствора ванадата аммония в концентрированной серной кислоте и встряхивают. Слой хлороформа постепенно окрашивается в вишнёвый цвет.
Реакция с нитратом кобальта. К 0,01 г препарата прибавляют 3 капли 3% спиртового раствора нитрата кобальта. Образуется голубое окрашивание.
Реакция с концентрированной серной кислотой. К нескольким крупинкам препарата прибавляют 5-6 капель концентрированной серной кислоты. При этом образуется оксониевая соль, что вызывает появление ярко-жёлтого окрашивания, постепенно переходящего в кирпично-красное. От прибавления нескольких капель воды окраска исчезает.
Реакция с серной и азотной кислотами. Несколько крупинок препарата помещают в пробирку и прибавляют 2 мл смеси, состоящей из 1 мл концентрированной азотной кислоты и 9 мл концентрированной серной кислоты. Появляется красное окрашивание. Прибавляют по каплям при постоянном помешивании и охлаждении 5 мл воды. Окраска переходит в коричневую, жёлтую, а затем в оранжевую. При взбалтывании полученного раствора с 3 мл хлороформа хлороформный слой окрашивается в фиолетовый цвет.
Реакция с сульфатом меди и роданидом аммония. Крупинку препарата растворяют в капле воды и прибавляют по 1 капле 0,1н. раствора соляной кислоты, 3% раствора сульфата меди и 2% раствора роданида аммония. Появляется коричневый осадок.
Реакция образования серебряной соли. Около 0,015-0,03 г препарата растворяют в 1 мл воды (при анализе дибазола в жидких лекарственных формах объём раствора, содержащий 0,015-0,03 г препарата, упаривают на водяной бане до 1-1,5 мл), добавляют 5 мл 95% спирта, 1 мл 25% раствора аммиака, взбалтывают и оставляют стоять в течении 10-15 минут. Фильтруют через небольшой фильтр, колбу и осадок промывают водой (по 1-2 мл на каждое промывание) до отрицательной реакции фильтрата на ион серебра (обычно на промывание расходуется 15 20 мл воды, большое количество воды может привести к частичному растворению осадка). Затем осадок с фильтром переносят в ту же колбу, прибавляют 1-2 мл азотной кислоты (плотность 1,2), слегка подогревают до растворения осадка, охлаждают, прибавляют 30 мл воды и титруют из полумикропипетки 0,1 н. раствором роданида аммония (индикатор — железоаммониевые квасцы):
Э=М.м., 1 мл 0,1 н. раствора роданида аммония соответствует 0,02445 г дибазола.
Ацидиметрическое определение дибазола после выделения основания. К точной навеске одного порошка прибавляют 2 мл 0,1 н. раствора серной кислоты и по каплям 3% раствор перманганата калия в 0,5 н. растворе серной кислоты до стойкого розового окрашивания (на водяной бане при температуре 60 °C). Избыток перманганата калия разлагают путём прибавления 1-2 капель 5% раствора щавелевой кислоты. Раствор количественно переносят в делительную воронку, добавляют небольшими порциями гидрокарбонат натрия до щелочной реакции на лакмус и основание дибазола извлекают хлороформом (3 раза по 15 мл). хлороформные извлечения фильтруют через безводный сульфат натрия, хлороформ удаляют, остаток растворяют в 2-3 мл спирта, добавляют 20 мл воды и титруют из полумикропипетки 0,1 н. раствором соляной кислоты до розового окрашивания, индикатор — метиловый оранжевый (V1 мл); 1 мл 0,1 н. раствора соляной кислоты соответствует 0,02447 г дибазола.
Прямая аргентометрия. К массе лекарственной формы, содержащей 0,001 г дибазола, прибавляют 0,5 мл ацетона и 1% раствора ацетата натрия, приготовленного на 1% растворе крахмала, 2 капли 5% раствора хромата калия и титруют 0,01 н. раствором нитрата серебра (в конце медленно, взбалтывая после прибавления каждой капли титранта) до устойчивого буроватого окрашивания:
Э= М.м. / 2, 1 мл 0,01 н. раствора нитрата серебра соответствует 0,001223 г дибазола.
Прямое алкалиметрическое определение дибазола. 0,15 г препарата (точная навеска) растворяют в 10 мл предварительно нейтрализованного по фенолфталеину спирта и титруют с тем же индикатором 0,1 н. раствором едкого натра до слабо-розового окрашивания.
1 мл 0,1 н. раствора едкого натра соответствует 0,2447 г дибазола, которого в препарате должно быть не менее 99,0% в пересчёте на сухое вещество:
физический амидопирин дибазол лекарственный навеска
Для анализа данного препарата применимы следующие методы:
Образование полийодида (химизм см. реакцию 3.1).
Реакция образования берлинской лазури (химизм см. реакцию 1.3).
Прямое алкалиметрическое определение дибазола (методика и химизм см. 4.4).
Титрование соляной кислотой (методика и химизм см. 2.2).
- 1. Н.П. Максютина, Ф.Е. Каган, Л.А. Кириченко, Ф.А. Митченко — «Методы анализа лекарств».
- 2. В.Г. Беликов — «Фармацевтическая химия».
- 3. Государственная фармакопея СССР. — 10-е издание. — М.: Медицина, 1968 г.
🎦 Видео
Взаимодействие хлорида железа III с роданидом калияСкачать

Качественная реакция на ион трехвалентного железаСкачать

Взаимодействие хлорида железа (III) с сульфидом натрия в растворе FeCl3 + Na2SСкачать

Получение ФТОРИДА ЖЕЛЕЗА(3) - FeF3. Реакция Фторида Натрия и Хлорида Железа. Реакция NaF и FeCl3.Скачать

Равновесие в растворе роданида железаСкачать

Реакция ФЕНОЛА и ХЛОРИДА ЖЕЛЕЗА. Качественная реакция на ФЕНОЛ. Опыты по химии. Эксперименты домаСкачать

ХЛОРИД ЖЕЛЕЗА. FeCl₃Скачать

Подлинность АНАЛЬГИНА. Реакция с ХЛОРИДОМ ЖЕЛЕЗА. Опыты по химии. Химические домашние экспериментыСкачать

Реакция хлорида железа и роданида аммонияСкачать

ПОЛУЧЕНИЕ ОКСОХЛОРИДА ЖЕЛЕЗА - FeOCl. Реакция Оксида Железа - Fe2O3 и Хлорида Железа - FeCl3.Скачать

Взаимодействие хлора с железомСкачать

Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Опыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать

Получение хлорида железа 3Скачать

Качественная реакция на фенолСкачать

ПОЛУЧЕНИЕ хлоридов железа (II и III)Скачать

Взаимодействие хлора с железомСкачать