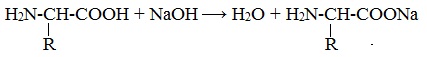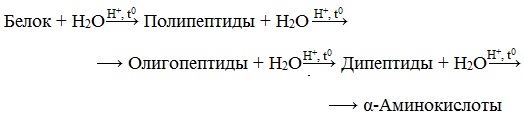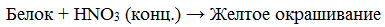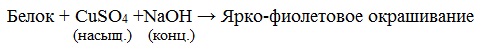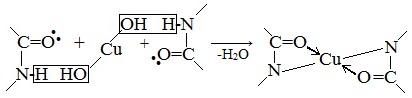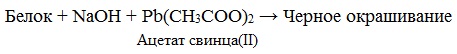История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
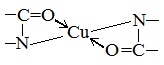
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Описание опыта. 2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
- РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911))
a -Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a -аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Описание опыта. В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
- Реакция Сакагучи
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a -нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a -нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a -нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
- РЕАКЦИЯ ФОЛЯ
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
- РЕАКЦИЯ С ФОРМАЛЬДЕГИДОМ
При взаимодействии a -аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a -аминокислот методом формального титрования (метод Сёренсена).
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
- РЕАКЦИЯ Циммермана
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
- ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ
a -Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
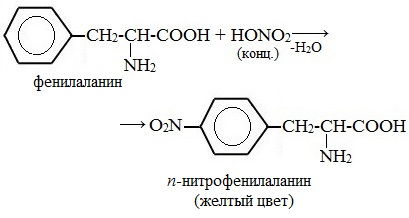
Эта реакция используется для обнаружения a -аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a -аминокислот дают соли, окрашенные в оранжевый цвет.
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
- ОСАЖДЕНИЕ БЕЛКА СОЛЯМИ ТЯЖеЛЫХ МЕТАЛЛОВ
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца. Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
- Открытие аминного азота в белках
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают. Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
- Открытие серы в белках
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин. Появление темного окрашивания указывает на образование сульфида свинца.
- РЕАКЦИЯ НА ПРИСУТСТВИЕ СЕРОСОДЕРЖАЩИХ a -АМИНОКИСЛОТ В БЕЛКЕ
Качественной реакцией на серосодержащие a -аминокислоты является реакция Фоля. Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь. Наблюдается появление серо-черного осадка.
- РЕАКЦИЯ НА ТРИПТОФАН
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
Видео:Реакция Фоля на цистеин и цистинСкачать

Цистеиновая реакция на белки уравнение реакции
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
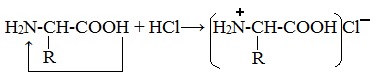
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
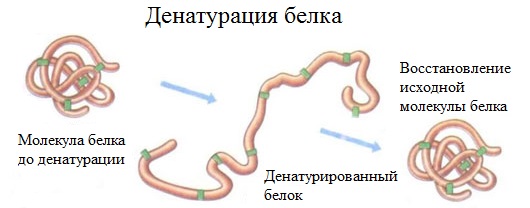
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg 2+ , Pb 2+ , Си 2+ ).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70 0 С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом:
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Видео:Ксантопротеиновая реакция на белкиСкачать

Специфические цветные реакции
3. Ксантопротеиновая реакция.
Эта реакция используется для обнаружения ароматических и гетероциклических аминокислот — фенилаланина, тирозина, гистидина, триптофана.
Реакция основана на способности ароматических соединений легко нитроваться, с образованием окрашенных нитропроизводных.
Тирозин и триптофан при нагревании с концентрированной азотной кислотой образуют нитропроизводные, окрашенные в желтый цвет.
Эта реакция характерна также и для белков, содержащих тирозин и триптофан.
Например, при действии концентрированной азотной кислоты на тирозин образуется нитропроизводное, окрашенное в желтый цвет. В щелочной среде окраска становится оранжевой в связи с ионизацией фенольной гидроксильной группы и увеличением вклада аниона в сопряжение.
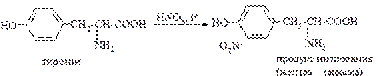
Реакция Фоля (Цистеиновая проба)
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия.
При добавлении ацетата свинца (II) образуется осадок сульфида свинца(II) серо-черного цвета; при добавлении раствора нитропруссида сульфид дает красно-коричневое окрашивание.
(на остатки аминокислот, содержащих S — цистеин и цистин):

ПРИМЕНЕНИЕ
Аминокислоты широко используются в современной медицине в качестве лекарственных средств. К таким аминокислотам относится глутаминовая кислота, метионин, гистидин, глицин, цистеин.
· Глицин является нейромедиатором тормозного типа действия. Он улучшает метаболические процессы в мозге.
· Цистеин (2-амино-3-тиопропановая) В медицинской практике цистеин используется как средство для задержки развития катаракты и просветления хрусталика.
· Глутаминовая кислота (2- аминопентан диовая) используется для лечения заболеваний центральной нервной системы: эпилепсии, психозов, депрессий.
Усилители вкуса и аромата пищи: Е-620 –глутаминовая кислота и Е-621-625 (соли глутаминовой кислоты. Для тех же целей применяют глицин (Е640) и лейцин (Е641).
· 4-аминобутановая кислота (γ-аминомасляная кислота) ГАМК.
Используется в медицине под названием аминалон или гаминалон, применяется при психических заболеваниях, обладает ноотропным действием, т.е. влияет на процессы мышления. На основе ГАМК созданы многие ноотропные средства.
Важное значение для медицины имеют производные «циклической формы ГАМК» — ее лактама (γ-бутиролактам, или пирролидон-2).
Производное пирролидона-2 под названием пирацетам(или ноотропил)рассматривается как первый представитель ноотропных средств.
Полимер N-винилпирролидона-2 — поливинилпирролидонв виде водного раствора применяется в качестве заменителя синовиальной жидкости.
· Парааминобензойная кислота (ПАБК)
Сложные эфиры ПАБК – анестезин, новокаин, используется в качестве местных анестезирующих средств.
(этиловый эфир ПАБК) (гидрохлорид 2-диэтил-аминоэтилового эфира ПАБК)
Белки и Пептиды
Пептиды и белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями.
Деление между ними условное: принято считать, что пептиды построены из остатков менее 100 аминокислот, белки – более 100 аминокислот.
Классификация белков
По составу:
1) протеины (простые белки), состоящие только из аминокислот и при гидролизе почти не образующие других продуктов, и
2) протеиды (сложные белки), состоящие из собственно белковой части, построенной из α-аминокислот, и из соединенной с ней небелковой части, иначе называемой простетической группой. При гидролизе протеиды кроме α-аминокислот образуют и другие вещества, например, фосфорную кислоту, глюкозу, гетероциклические соединения и т. д.
По форме их молекул:
1) фибриллярные (волокнистые) белки, молекулы которых имеют нитевидную форму; к ним относят фиброин шелка, кератин шерсти;
2) глобулярные белки, молекулы которых имеют округлую форму; к ним относятся, например, альбумины, глобулины и ряд других, в том числе и сложные белки.
Формально образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
При взаимодействии двух молекул α-аминокислот происходит реакция между аминогруппой одной молекулы и карбоксильной группы — другой. Это приводит к образованию дипептида,например:
Аналогично происходит образование тетра-, пента- и полипептидов.
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела).
В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой
Молекулярные массы различных белков (полипептидов) составляют от 5тыс. до нескольких миллионов.
Mr белков от неск. тысяч до миллионов углеродных единиц: Mr (белка куриного яйца) – 36 000,
Mr (белка мышц) = 1 500 000.
Mr (инсулина) = 5700. (Его молекула состоит из двух полипептидных цепей, в каждой 21 аминокислотный остаток)
Макромолекулы белков имеют стеререгулярное строение, исключительно важное для проявления ими определенных биологических свойств.
Выделяют 4 уровня структурной организации белков.
Первичная структура – цепочка из α-аминокислот, связанных пептидной связью (сильной, ковалентной).
Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке.
Первичную структуру белка принято записывать начиная с N-концевого остатка аминокислоты в направлении к карбоксильному концу (C)
Вторичная структура – спираль. Удерживается водородными связями (слабыми)
Третичная структура («глобула»)- это конфигурация, которую принимает в пространстве закрученная спираль полипептидной цепи (клубок).
Она поддерживается за счет:
а) дисульфидных мостиков – между атомами серы: — S – S –
б) солевых мостиков – между карбоксильной и аминогруппой.
в) сложноэфирных мостиков –между карбоксильной и гидроксильной группой.
г) водородных связей
Четвертичная структура – имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.)
Например гемоглобин представляет комплекс из четырех макромолекул: (С738Н1166О208N203S2Fe)4
Физические свойства белков весьма разнообразны и определяютсяих строением.
По физическим свойствам белки делят на два класса:
— глобулярные белки растворяются в воде или образуют коллоидные растворы,
— фибриллярные белкив воде нерастворимы.
Химические свойства.
Амфотерность.
· Белок + HCl — свойства оснований (по – NH2)
· Белок + NaOH — свойства кислот (по – СООН)
2. Денатурация —разрушение вторичной и третичной структуры белка с сохранением первичной структуры.
Она происходит при нагревании, изменении кислотности среды, действии излучения.
Пример денатурации — свертывание яичных белков при варке яиц.
Денатурация бывает обратимой и необратимой.
- Если воздействия на белок слабые (изменение температуры на 1°), то происходит обратимая денатурация.
- Если воздействие сильное (100°), то денатурация необратимая. При этом разрушаются все структуры, кроме первичной.
Необратимая денатурация может быть вызвана образованием нерастворимых веществ, при действии на белки солей тяжелых металлов — свинца или ртути.
3. Гидролиз белков —это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Гидролиз белков сводится к гидролизу полипептидных связей.
К этому же сводится переваривание пищи:
белок→ полипептиды→ олигопептиды→дипептиды→ α -аминокислоты → кровь во все клетки и ткани организма.
4. Цветные реакции белков — качественные реакции(см. лекцию аминокислоты)
Цветные реакции на белки являются реакциями на пептидную связь и функциональные группы радикалов аминокислот, входящих в состав белка.
| Наименование реакции | Реактивы | Окрашивание | Чем обусловлена реакция |
| Биуретовая | сульфат меди | фиолетовое | пептидная связь |
| Нингидриновая | 0,1% водный р-р нингидрина | сине-фиолетовое | свободные α-аминокислоты |
| Ксантопротеиновая | азотная кислота р-р аммиака | желтое | ароматические аминокислоты |
| Р-ция Фоля | 30%NaOH 5%р-р ацетата свинца | черное | цистеин |
Функции белков
- Ферментативная (каталитическая) – белки-ферменты ускоряют химические реакции, регулирующие процессы пищеварения (гастрин, холецистокинин, вазоинтес-тинальный пептид, желудочный ингибирующий пептид и др.);
· Строительная (структурная) – клетка, если не считать воду, состоит в основном из белков (кератин шерсти, фиброин шелка, коллаген);.
· Защитная – антитела борются с возбудителями болезней (иммунитет).
· Гормональная (инсулин, окситоцин, вазопрессин
· Обезболивающее (энкефалины и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
· Регуляторнаяв биохимических процессах, связанных с механизмами сна, обучения, памяти, и т.д.
· Двигательные (миозин);
· Транспортные (гемоглобин);
· Запасные (казеин, яичный альбумин);
Биосинтез
Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в генах.
Каждый белок состоит из уникальной последовательности аминокислотных остатков, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок.
Генетический код представляет собой способ перевода нуклеотидной последовательности ДНК (через РНК) в аминокислотную последовательность полипептидной цепи. Этот код определяет соответствие трёхнуклеотидных участков РНК, называемых кодонами, и определённых аминокислот, которые включаются в состав белка: например, последовательность нуклеотидов АУГ соответствует метионину.
Поскольку ДНК состоит из четырёх типов нуклеотидов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более чем одним кодоном.
Жиры. Строение.
Вопросы экзамена:
1.Жиры. Классификация. Номенклатура. Общая характеристика строения жиров.
2.Физические свойства жиров. Химические свойства. Биологическая роль жиров. Применение в фармации.
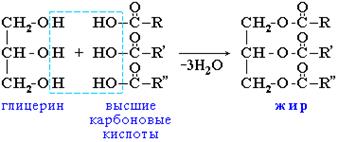
Жиры или триглицериды – сложные эфиры глицерина и высших одноосновных карбоновых кислот (так называемых ЖИРНЫХ кислот). Общая формула: С3Н5 (СОО R)3
Общее название таких соединений – триглицеридыилитриацилглицерины, где ацил – остаток карбоновой кислоты –
Номенклатура
По тривиальной номенклатуре глицериды называют, добавляя окончание -ид к сокращенному названию кислоты и приставку, показывающую, сколько гидроксильных групп в молекуле глицерина проэтерифицировано.
Классификация
Чем больше в жирах содержание ненасыщенных кислот, тем ниже температура плавления жиров.
| Агрегатное состояние жиров | Различия в химическом строении | Происхождение жиров | Исключения |
| Твёрдые жиры | Содержат остатки насыщенных ВКК (стеариновой и пальмитиновой) | Животные жиры | Рыбий жир(жидк. при н/у) |
| Смешаные жиры | Содержат остатки насыщенных и ненасыщенных ВКК | ||
| Жидкие жиры(масла) | Содержат остатки ненасыщенных ВКК (олеиновой, линолевой) | Растительные жиры | Кокосовое масло, какао масло(твёрд. при н/у) |
Жиры растворимы в органических растворителях и нерастворимы в воде.
Жирные кислоты
| Предельные ВКК: | Непредельные ВКК: |
| 1. Масляная С3Н7-СООН 2. Пальмитиновая С15Н31-СООН 3. Стеариновая С17Н35-СООН | 5. Олеиновая кислота С17Н33СООН(1 = связь) СН3—(СН2)7—СН=СН—(СН2)7—СООН 6. Линолевая кислота С17Н31СООН(2 = связи) СН3-(СН2)4-СН=СН-СН2-СН=СН-СООН 7. Линоленовая кислота С17Н29СООН(3 = связи) СН3СН2СН=CHCH2CH=CHCH2CH=СН(СН2)4СООН |
Функции жиров
1.Энергетическая — при полном расщеплении 1г жира до СО2 и Н2О освобождается 38,9 кДж энергии. Жиры являются одним из основных источников энергии для млекопитающих. Эмульгирование жиров в кишечнике (необходимое условие их всасывания) осуществляется при участии солей жёлчных кислот. Энергетическая ценность жиров примерно в 2 раза выше, чем углеводов, при условии их биологической доступности и здорового усвоения организмом.
2.Структурная – жиры – важный компонент каждой клетки. Насыщенные жиры расщепляются в организме на 25—30 %, а ненасыщенные жиры расщепляются полностью.
3.Защитная жиры накапливаются в подкожных тканях и тканях, окружающих внутренние органы. Благодаря крайне низкой теплопроводности жир, откладываемый в подкожной жировой клетчатке, служит термоизолятором, предохраняющим организм от потери тепла (у китов, тюленей и др.).
🎥 Видео
Качественные реакции на белкиСкачать

Биуретовая реакция белковСкачать

Опыты по химии. Цветные реакции белка: биуретовая; ксантопротеиноваяСкачать

Видеоурок: Практическая работа № 4. Цветные реакции на белкиСкачать

Реакция Фоля на цистеин и цистинСкачать

10 класс Качественные реакции на белкиСкачать

Биуретовая реакцияСкачать

Ксантопротеиновая реакция на белкиСкачать

Зачем МИД России преследует Би-2. Чичваркин о Надеждине. Шустер — что с ЗалужнымСкачать

Качественные реакции на белки в сравнении с реакциями на аминокислоты. Химический опытСкачать

Качественная реакция на белки I ЕГЭ по химииСкачать

НШ | Химия. Химические свойства белков и качественные реакции на белкиСкачать

Биуретовая реакцияСкачать

Качественная реакция на белкиСкачать

Денатурация БЕЛКА. Реакция со СПИРТОМ и АЦЕТОНОМ. Реакции с белком. Опыты по химии дома.Скачать

Ксантопротеиновая реакцияСкачать

Понятно и просто: биосинтез белка для ЕГЭ по биологииСкачать

Ксантопротеиновая реакцияСкачать