- Ваш ответ
- решение вопроса
- Похожие вопросы
- Теория и практика для составления ОВР окисления алкенов перманганатом калия
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Некоторые окислительно-восстановительные реакции алкенов: первое знакомство с методом электронно-ионного баланса в органической химии
- Презентация к уроку
- 🎥 Видео
Видео:Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

Ваш ответ
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

решение вопроса
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:HCl+KMnO4=MnCl2+Cl2+KCl+H2O Расстановка коэффициентов методом электронного баланса в ОВР 10.47бСкачать

Теория и практика для составления ОВР окисления алкенов перманганатом калия
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Табл. 1 Закономерности окисления алкенов
В нейтральной/щелочной среде (нагревание)
В нейтральной/щелочной среде (н.у.)
Мягкое окисление –реакция Вагнера
Разрыв σ- и π- связи
Разрыв σ- и π- связи
кислоты, СО 2 , кетоны
А) Жесткое окисление — в кислой, нейтральной/щелочной среде (при нагревании)
Табл. 2 Продукты окисления алкенов при жестком окислении
(КИСЛОТА, СО 2 , КЕТОНЫ)
Б) Мягкое окисление в нейтральной/щелочной среде (0 °С, н.у.)
Табл. 3. Продукты окисления алкенов при мягком окислении (реакция Вагнера)
Продукт окисления – ДИОЛ (ГЛИКОЛЬ)
Примеры для практической работы:
Табл. 4. Практическая часть «Окисление алкенов»
КЛЮЧ к правой части уравнения
Табл. 5. Окисление алкенов, алкинов
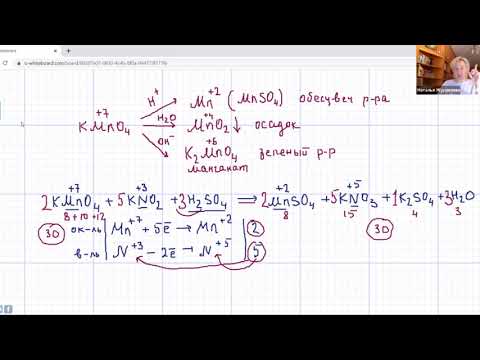
КЛЮЧ к электронному балансу и уравнению:
2 С -2 -12 е →2 С +4
Mn +7 + 5 e → Mn +2
Mn +7 + 5 e → Mn +2
2С -2 — 4 е →2С + 2
Mn +7 + 3 e → Mn +4
Mn +7 + 2 e → Mn +6
Mn +7 + 1 e → Mn +6
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 956 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 51 человек из 29 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Видео:2 KMnO4 + H2O2 → 2 MnO2 + 2 O2 + 2 KOHСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 571 043 материала в базе
Материал подходит для УМК
«Химия. Углубленный уровень», Габриелян О.С.
Другие материалы
- 30.10.2017
- 5065
- 18
- 29.10.2017
- 1116
- 0
- 18.10.2017
- 643
- 11
- 17.10.2017
- 1426
- 72
- 17.10.2017
- 8669
- 94
- 17.10.2017
- 9262
- 48
- 15.10.2017
- 583
- 0
- 15.10.2017
- 853
- 3
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 31.10.2017 7934
- DOCX 113.5 кбайт
- 130 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Вотинцева Татьяна Андреевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет
- Подписчики: 0
- Всего просмотров: 106866
- Всего материалов: 24
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
В школах Хабаровского края введут уроки спортивной борьбы
Время чтения: 1 минута
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
Рособрнадзор не планирует переносить досрочный период ЕГЭ
Время чтения: 0 минут
Количество бюджетных мест в вузах по IT-программам вырастет до 160 тыс.
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

Некоторые окислительно-восстановительные реакции алкенов: первое знакомство с методом электронно-ионного баланса в органической химии
Презентация к уроку
Тема “ОВР в органической химии” достаточно широко освящена на страницах журнала “Химия в школе” методистами, учителями (“Химия в школе”. 1998. №1. С.29-38, 2000. №2. С.61-69, 2004. №2. С.55-61 и др.).
В данной статье хочется представить свой опыт по использованию метода полуреакций при уравнивании схем на начальном этапе обучения органической химии: знакомство с некоторыми реакциями окисления непредельных углеводородов.
| Red – восстановитель (от англ. “Redintegrator” – восстановитель); Ох – окислитель (от англ. “Oxidant” — окислитель). |
Первая возможность показать метод электронно-ионного баланса появляется при изучении химических свойств алкенов. Здесь очень важно грамотно сформировать навыки составления полуреакций. Для этого с учащимися записываем памятку:
| кислотная среда содержит H + и H2O => поэтому кислород забираем катионами водорода: [O] + 2H + = H2O щелочная среда содержит OH – и H2O => поэтому кислород забираем водой: [O] + H2O = 2OH – |
В качестве примеров можно привести реакции взаимодействия алкенов с водным раствором KMnO4 (реакция Вагнера) и раствором KMnO4 в серной кислоте при tºC.
При взаимодействии алкенов с водным раствором KMnO4 происходит одновременно окисление и гидратация по месту разрыва π-связи вне зависимости от места расположения двойной связи (на краю или в центре молекулы):
При наличии в молекуле 2-х двойных связей образуются тетраолы:
Напомним, что при действии KMnO4 в H2SO4 при t º C двойная связь разрывается:
а) если двойная связь находится на конце молекулы, то образуется кислота и углекислый газ:
б) если двойная связь находится не на краю, то образуется смесь кислот:

в) если двойная связь находится при атоме углерода с двумя радикалами, то образуется кетон и карбоновая кислота или углекислый газ:
Если в молекуле 2 двойных связи, то при равных условиях они обе будут подвержены разрыву с образованием смеси веществ одно- и двухосновной кислот, углекислого газа или кетона:

Данные реакции используются для определения строения непредельных углеводородов (местонахождения кратных связей).
Обычно для усвоения учащимися материала урока вполне достаточно проработать по 2 примера ОВР алкенов в различных средах (работа проводится по памятке). Причем целесообразно брать одно вещество и составлять УХР его взаимодействия с KMnO4 в различных средах.
| C5H10 + 2OH — — 2e — → C5H12O2 MnO4 — + 2H2O + 3e — → MnO2↓ + 4OH — | 3 Red, окисляется 2 Ох, восстанавливается |
Сокращаем одинаковые частицы в левой и правой частях схемы и получаем:
Записываем УХР в молекулярном виде:
| C5H10 + 3H2O — 6e — → C3H6O + C2H4O2 +6H + MnO4 — + 8H + + 5e — → Mn 2+ + 4H2O | 5 Red, окисляется 6 Ох, восстанавливается |
Сокращаем одинаковые частицы в левой и правой частях схемы и получаем:
Записываем УХР в молекулярном виде:
| C3H6 + 2OH — — 2e — → C3H8O2 MnO4 — + 2H2O + 3e — → MnO2↓ + 4OH — | 3 Red, окисляется 2 Ох, восстанавливается |
Сокращаем одинаковые частицы в левой и правой частях схемы и получаем:
Записываем УХР в молекулярном виде:
| C3H6 + 4H2O — 10e — → C2H4O2 + CO2 +10H + MnO4 – + 8H + + 5e — → Mn 2+ + 4H2O | 1 Red, окисляется 2 Ох, восстанавливается |
Сокращаем одинаковые частицы в левой и правой частях схемы и получаем:
Записываем УХР в молекулярном виде:
C3H6 + 2KMnO4 + 3H2SO4 
Для закрепления изученного материала можно дать учащимся задания, подобные следующему: алкен с брутто-формулой С6Н12 подвергли окислению KMnO4 в присутствии H2SO4 при tºC. Определите строение алкена, если продуктами реакции являются 3-метилбутановая кислота и CO2.
Ответ: Так как продукт СО2, двойная связь находилась на конце молекулы, тогда
искомый алкен – 4-метилпентен-1.
После отработки навыков использования метода электронно-ионного баланса в ОВР алкенов можно провести самостоятельную работу по вариантам.
Задание: Составить и уравнять методом электронно-ионного баланса схемы реакций взаимодействия алкена с водным и сернокислым (при tºC) раствором перманганата калия:
| Вариант | Название алкена (исходного вещества) |
| I | 2-метилбутен-1 |
| II | 2-метилпентен-1 |
| III | бутен-1 |
| IV | пентен-1 |
| V | 3-метилпентен-1 |
| VI | 3-метилпентен-2 |
Использование метода полуреакций при изучении реакций окисления алкенов позволяет учащимся в дальнейшем легче усвоить реакции окисления алкадиенов, алкинов, спиртов, альдегидов, кетонов, гомологов бензола и других органических соединений.
Преимущества использования электронно-ионного баланса в органической химии по сравнению с электронным очевидны:
большая часть реакций окисления органических веществ протекает в растворе;
практически все органические вещества являются неэлектролитами (кроме солей), а значит, при составлении полуреакции учащиеся меньше будут допускать ошибки, т.к. в полуреакциях следует записывать брутто-формулы органических веществ, а не продукты их диссоциации;
метод полуреакций более “элегантный” (при уравнивании схемы реакции окисления органического вещества электронным балансом приходится записывать большее число полуреакций, что может привести к ошибкам).
Например, для составления уравнения реакции 2-метилбутена-2 с водным раствором KMnO4 схема будет иметь следующий вид:
| C 0 – 1e — → C +I C -I – 1e — → C 0 Mn +VII + 3e — → Mn +IV | — 2е- + 3е- | 3 Red, окисляется 3 Red, окисляется 2 Ox, восстанавливается |
Таким образом, метод электронного баланса не позволяет сразу определить коэффициенты в схеме реакции перед “побочными” веществами (в данном случае перед формулами Н2О и КОН).
🎥 Видео
Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Решение окислительно-восстановительной реакции/ 2017-ый годСкачать

ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

КАК НАПИСАТЬ РЕАКЦИЮ KMnO4 + MnSO4 + H2O и УРАВНЯТЬ ЕЁ / Реакция перманганата и сульфата марганцаСкачать

Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O ХИМИЯ ЕГЭ Окислительно-восстановительные реакции УрокСкачать

Понятие ОВР. Метод электронного баланса.(на примере реакции: KMnO4 + HCl = KCl + MnCl2 + Cl2 + H2O)Скачать

Na2S+KMnO4+H2O=S+MnO2+NaOH+KOH расстановка коэффициентов методом электронного баланса 10.47аСкачать

KMnO4+H2O2+H2SO4=MnSO4+K2SO4+O2+H2OСкачать

ОВР с перманганатом калия.Скачать
Взаимодействие перманганата калия с сульфитом натрия в щелочной среде KMnO4 + KOH + Na2SO3Скачать

Химия | Схемы ОВР для перманганат и дихромат ионовСкачать








































