Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать  Циклогексен + KMnO4 + H2SO4?Химия | 5 — 9 классы Циклогексен + KMnO4 + H2SO4. Циклогексен разрывается и получается гексановая кислота, сульфат марганца, сульфат калия и вода. Если вам необходимо получить ответ на вопрос Циклогексен + KMnO4 + H2SO4?, относящийся к уровню подготовки учащихся 5 — 9 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы. Zn(OH)2 — записати як кислоту. H2ZnO2 3, 96 г х H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O 99 143 Складаємо пропорцію : 99 г цинкгідроксиду — 143 г солі 3, 96 х х = 143 х 3, 96 / 99 = 5, 72 г — солі утворилось. V = m / p v = 28 / 1. 250(p азота) v = 22. 4 л. M(CH3 — CH2 — CH2 — CH — Cl) = 40 г нью(Cl) = 40 / 35. 5 = 1. 12моль объём(Cl) = 1. 12 * 22. 4 = 25. 088 л m(Cl) = 1. 12 * 40 = 35. 5 г / моль. 1. а)N2(0) + H2(0) = N( — 3)H( + )3N2(0) + 6e = 2N( — 3)|1 окислитель, в — еH2(0) — 2e = 2H( + ) |3 восстановитель, ок — еN2 + 3H2 = 2NH3 б)С ( + 2) — 2ē = > С ( + 4) | 2 | восстановитель, окисление 2О (0) + 4ē = > 2O ( — 2) | 1| окислитель, восстано.. 2Al + 3S →Al2S3 1. Mr(Al2S3) = 2 * 27 + 3 * 32 = 150 г / моль n(Al2S3) = m / Mr = 127г / 150г / моль = 0. 847моль 2. N(AL) = 0. 847х2 = 1. 693моль 3. M(AL) = nxMr = 27г / моль х 1. 693моль = 45. 72г Если помог, нажми кнопку Спасибо)). 2H₂O →2H₂ + O₂ (при t) С + O₂ →CO₂↑ CO₂ + H₂O⇄ H₂CO₃ H₂CO₃ + Ca →CaCO₃ + H₂↑ H₂ + O₂→ H₂O. 100 г Х г, Х моль 2Ca + O2 — > 2CaO n = 2 моль n = 1 моль n = 1 моль М = 40 г / моль М = 32 г / моль Vm = 22, 4 л / моль m = 80 г m = 32 г V = 22, 4 л 100 г Са — Х г О2 80 г Са — 32 г О2 m(O2) = 100 * 32 / 80 = 40 г 100 г Са — Хл О2 80 г Са — 22, 4 л.. Сa + O2 = CaO2 xмоль Ca — — — — — — — — — — — 5 моль O2 1 моль Ca — — — — — — — — — 1 моль O2 x = 5 * 1 / 1 = 5моль. 250 : 50 = 5 вот ответ (не умею писать на Укроиннском. ). Видео:FeSO4+KMnO4+H2SO4=Fe2(SO4)3+MnSO4+K2SO4+H2O расстановка коэффициентов методом электронного балансаСкачать 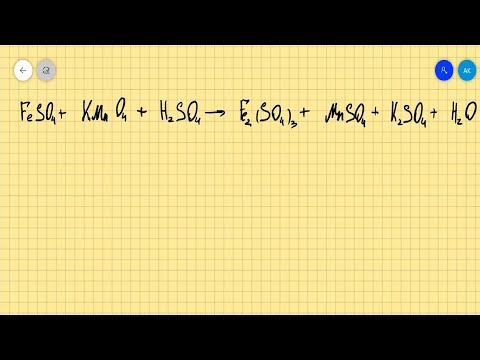 Некоторые окислительно-восстановительные реакции алкенов: первое знакомство с методом электронно-ионного баланса в органической химииПрезентация к урокуТема “ОВР в органической химии” достаточно широко освящена на страницах журнала “Химия в школе” методистами, учителями (“Химия в школе”. 1998. №1. С.29-38, 2000. №2. С.61-69, 2004. №2. С.55-61 и др.). В данной статье хочется представить свой опыт по использованию метода полуреакций при уравнивании схем на начальном этапе обучения органической химии: знакомство с некоторыми реакциями окисления непредельных углеводородов.
Первая возможность показать метод электронно-ионного баланса появляется при изучении химических свойств алкенов. Здесь очень важно грамотно сформировать навыки составления полуреакций. Для этого с учащимися записываем памятку:
В качестве примеров можно привести реакции взаимодействия алкенов с водным раствором KMnO4 (реакция Вагнера) и раствором KMnO4 в серной кислоте при tºC. При взаимодействии алкенов с водным раствором KMnO4 происходит одновременно окисление и гидратация по месту разрыва π-связи вне зависимости от места расположения двойной связи (на краю или в центре молекулы): При наличии в молекуле 2-х двойных связей образуются тетраолы: Напомним, что при действии KMnO4 в H2SO4 при t º C двойная связь разрывается: а) если двойная связь находится на конце молекулы, то образуется кислота и углекислый газ: б) если двойная связь находится не на краю, то образуется смесь кислот:
в) если двойная связь находится при атоме углерода с двумя радикалами, то образуется кетон и карбоновая кислота или углекислый газ: Если в молекуле 2 двойных связи, то при равных условиях они обе будут подвержены разрыву с образованием смеси веществ одно- и двухосновной кислот, углекислого газа или кетона:
Данные реакции используются для определения строения непредельных углеводородов (местонахождения кратных связей). Обычно для усвоения учащимися материала урока вполне достаточно проработать по 2 примера ОВР алкенов в различных средах (работа проводится по памятке). Причем целесообразно брать одно вещество и составлять УХР его взаимодействия с KMnO4 в различных средах.
Сокращаем одинаковые частицы в левой и правой частях схемы и получаем: Записываем УХР в молекулярном виде:
Сокращаем одинаковые частицы в левой и правой частях схемы и получаем: Записываем УХР в молекулярном виде:
Сокращаем одинаковые частицы в левой и правой частях схемы и получаем: Записываем УХР в молекулярном виде:
Сокращаем одинаковые частицы в левой и правой частях схемы и получаем: Записываем УХР в молекулярном виде: C3H6 + 2KMnO4 + 3H2SO4 Для закрепления изученного материала можно дать учащимся задания, подобные следующему: алкен с брутто-формулой С6Н12 подвергли окислению KMnO4 в присутствии H2SO4 при tºC. Определите строение алкена, если продуктами реакции являются 3-метилбутановая кислота и CO2. Ответ: Так как продукт СО2, двойная связь находилась на конце молекулы, тогда искомый алкен – 4-метилпентен-1. После отработки навыков использования метода электронно-ионного баланса в ОВР алкенов можно провести самостоятельную работу по вариантам. Задание: Составить и уравнять методом электронно-ионного баланса схемы реакций взаимодействия алкена с водным и сернокислым (при tºC) раствором перманганата калия:
Использование метода полуреакций при изучении реакций окисления алкенов позволяет учащимся в дальнейшем легче усвоить реакции окисления алкадиенов, алкинов, спиртов, альдегидов, кетонов, гомологов бензола и других органических соединений. Преимущества использования электронно-ионного баланса в органической химии по сравнению с электронным очевидны: большая часть реакций окисления органических веществ протекает в растворе; практически все органические вещества являются неэлектролитами (кроме солей), а значит, при составлении полуреакции учащиеся меньше будут допускать ошибки, т.к. в полуреакциях следует записывать брутто-формулы органических веществ, а не продукты их диссоциации; метод полуреакций более “элегантный” (при уравнивании схемы реакции окисления органического вещества электронным балансом приходится записывать большее число полуреакций, что может привести к ошибкам). Например, для составления уравнения реакции 2-метилбутена-2 с водным раствором KMnO4 схема будет иметь следующий вид:
Таким образом, метод электронного баланса не позволяет сразу определить коэффициенты в схеме реакции перед “побочными” веществами (в данном случае перед формулами Н2О и КОН). 📽️ Видео89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать  Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать  Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать  NaNO2+KMnO4+H2SO4=NaNO3+MnSO4+K2SO4+H2OСкачать  KI+KMnO4+H2SO4=I2+MnSO4+K2SO4+H2OСкачать  Химическая реакция FeSO4 с KMnO4 и H2SO4Скачать  Химическая реакция KMnO4 с H2SO4 и H2O2Скачать  Решение цепочек превращений по химииСкачать  Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать  Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать  Окисление органических соединений перманганатом калияСкачать  2 KMnO4 + H2O2 → 2 MnO2 + 2 O2 + 2 KOHСкачать  HCl+KMnO4=MnCl2+Cl2+KCl+H2O Расстановка коэффициентов методом электронного баланса в ОВР 10.47бСкачать  Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать  Химическая реакция KMnO4 с H2SO4 и NaNO2Скачать  Серная кислота. Химические свойства. Реакции с металлами.Скачать  Химическая реакция KI с H2SO4 и H2O2Скачать  |








































 C2H4O2 + CO2 + 2MnSO4 + 4H2O + K2SO4
C2H4O2 + CO2 + 2MnSO4 + 4H2O + K2SO4






