- Цикл трикарбоновых кислот Кребса: последовательность реакций, суммарное уравнение, регуляция работы цикла и его биологическая роль
- Реакции цикла Кребса
- Цикл трикарбоновых кислот
- Цикл Кребса
- Функции цикла Кребса
- ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (ЦИКЛ КРЕБСА)
- Цикл трикарбоновых кислот
- ВВЕДЕНИЕ
- ИСТОРИЯ ОТКРЫТИЯ ЦТК
- ЦИКЛ КРЕБСА
- Углеводы
- Липиды
- Белки
- Этанол
- Кетоновые тела
- СТАДИИ ЦТК
- I стадия — образование цитрата
- II стадия — образование изоцитрата через цис-аконитат
- III стадия — окисление изоцитрата до α-кетоглутарата
- IV стадия — окисление α-кетоглутарата до сукцинил-КоА
- V стадия — превращение сукцинил-КоА в сукцинат
- VI стадия — окисление сукцината до фумарата
- VII стадия — гидратация фумарата до малата
- VIII стадия — окисление малата до оксалоацетата
- ЭНЕРГЕТИЧЕСКАЯ РОЛЬ ЦТК
- РОЛЬ ЦТК В МЕТАБОЛИЗМЕ
- РЕГУЛЯЦИЯ ЦТК
- Основные пути регуляции экспрессии генов, кодирующих ферменты ЦТК
- КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ЦТК И ВОЗМОЖНОСТИ ЕГО ФАРМАКОЛОГИЧЕСКОГО КОНТРОЛЯ
- Применение сукцината (янтарной кислоты) и витамина B2 в терапии
- Онкология, митохондриальные заболевания и иммунитет
Видео:Цикл Кребса - схема - meduniver.comСкачать

Цикл трикарбоновых кислот Кребса: последовательность реакций, суммарное уравнение, регуляция работы цикла и его биологическая роль
Цикл трикарбоновых кислот Кребса — это высокоорганизованная циклическая система взаимопревращений ди- и трикарбоновых кислот, катализируемых мультиферментным комплексом. Он составляет основу клеточного метаболизма.
Этот метаболический путь является замкнутым его началом считается цитратсинтазная реакция в ходе которой конденсация Ацетил-КоА и оксалоацитата дает цитрат. Далее следует реакция отщепление воды катализируемая ферментом аконитазой продуктом реакции является цис-аконитовая кислота. Этот же фермент (аконитаза) катализирует реакцию гидратации в итоге образуется изомер изоцитрат.
Окислител. реакция кот катализируется ферментом изоцитратдегидрогиназа дает а-кетоглутаровую кислоту. В ходе реакции отщепляется СО2, Е окислительного превращения аккумулируется в восстановленном НАД. Далее а-кетоглютаровая кислота под действием а-кетоглюторатдегидрогиназного комплекса превращается в сукценил-КоА. Сукцинил-КоА-Фермент катализирует реакцию в ходе которой из ГДФ и фосфорной кислоты образуется ГТФ(АТФ)и отщепляется фермент сукцинаттиокиназа.
В итоге образуется янтарная кислота – сукцинат. Сукцинат далее вступает вновь в реакцию окисления с участием фермента сукцинатдегидрогиназы. Это ФАД зависимый фермент. сукцинат окисляется с образованием фумаровой кислоты. Происходит немедленное присоединение воды с участием фермента фумаразы и образуется малат (яблочная кислота).
Малат, с участием малатдегидрогиназы содержащий НАД, окисляется в итоге образуется ЩУК т е происходит регенерация первого продукта ЩУК может снова вступать в реакцию конденсации с ацетил-КоА с образованием лимонной. СНЗ-С + ЗНАД + ФАД + ГДФ + НЗРО4 + 2Н2О -> 2СО2 + ЗНАДН+Н* + ФАДН2 + ГТФ + HSKoA
Главная роль ЦТК – образование большого количества АТФ.
1. ЦТК — главный источник АТФ. Е, образ. большим количеством, АТФ дает полный распад Ацетил-КоА до СО2 и Н2О.
2. ЦТК — это универсальный терминальный этап катаболизма веществ всех классов.
3. ЦТК играет важную роль в процессах анаболизма (промежуточные продукты ЦТК): — из цитрата -> синтез жирных кислот; — из aльфа-кетоглутарата и ЩУК —> синтез аминокислот; — из ЩУК -> синтез углеводов; — из сукцинил-КоА —> синтез гема гемоглобина
Биологическое окисление как главный путь расщепления питательных веществ в организме, его функции в клетке. Особенности биологического окисления в сравнении с окислительными процессами в небиологических объектах. Способы окисления веществ в клетках; ферменты, катализирующие окислительные реакции в организме.
Биол. окисление как главный путь расщепления питательных веществ. Его функции в клетке. Ферменты, катализирующие окислительные реакции в организме.
Биологическое окисление(БО) — это совокупность окислит. процессов в живом организме, протекающих с обязательным участием кислорода. Синоним – тканевое дыхание. Окисление одного вещества невозможно без восстановления другого вещества.
Важнейшей функцией БО является высвобождение Е, заключенной в хим. связях питательных веществ. Выделяющееся Е используется для осущ-ния энергозависимых процессов, протекающ. в клетках, а также для поддержания температуры тела. Второй функцией БО является пластическая: в ходе расщепления питательных веществ образуются низкомолекулярные промежуточные продукты, используемые в дальнейшем для биосинтезов.
Например, при окислительном распаде глюкозы образуется ацетилКоА, который далее может пойти на синтез холестерола или высших жирных кислот. Третьей функцией БО является генерация восстановительных потенциалов, которые в дальнейшем используются в восстановительных биосинтезах.
Главным источником восстановительных потенциалов в биосинтетических реакциях клеточного метаболизма является НАДФН+Н+, образующийся из НАДФ+ за счет атомов водорода, переносимых на него в ходе некоторых реакций дегидрирования. Четвертая функция БО участие в процессах детоксикации,т.е. обезвреживания ядовитых соединений или поступающих из внешней среды, или образующихся в организме.
Различные соединения в клетках могут окисляться тремя способами:
1. путем дегидрирования. Принято различать два вида дегидрирования: аэробное и анаэробное. если первичным акцептором отщепляемых атомов водорода служит кислород, дегидрирование является аэробным; если же первичным акцептором отщепляемых атомов водорода служит какое-либо другое соединение, дегидрирование является анаэробным. Примерами таких соединений акцепторов водорода могут служить НАД , НАДФ , ФМН, ФАД, окисленный глутатион ( ГSSГ ), дегидроаскорбиновая кислота и др.
2. Путем присоединения к молекулам окисляемого вещества кислорода, т.е. путем оксигенирования.
3. Путем отдачи электронов. Все живые организмы принято делить на организмы аэробные и организмы анаэробные. Аэробные организмы нуждаются в кислороде, который ,во-первых, используется в реакциях оксигенирования, во-вторых, служит конечным акцептором атомов водорода, отщепленных от окисляемого субстрата. Причем, около 95% всего поглощаемого кислорода служит конечным акцептором атомов водорода, отщепленных в ходе окисления от различных субстратов, и лишь 5% поглощаемого кислорода участвует в реакциях оксигенации.
Все ферменты, участвующие в катализе ОВР в организме относятся к классу оксидоредуктаз. В свою очередь, все ферменты этого класса могут быть разделены на 4 группы:
1. Ферменты, катализир. реакции дегидрирования или дегидрогеназы.
а). Аэробные дегидрогеназы или оксидазы. б). Анаэробные дегидрогеназы с типовой реакцией:
2.Ферменты, катализир. реакции оксигенирования или оксигеназы. а). Монооксигеназы б). Диоксигеназы
3. Ферменты, катализирующие отщепление электронов от окисляемых субстратов. называются цитохромы. 4.К оксидоредуктазам относится также группа вспомогательных ферментов, таких как каталаза или пероксидаза. Они играют защитную роль в клетке, разрушая перекись водорода или органические гидроперекиси, образующиеся в ходе окислительных процессов и представляющие собой достаточно агрессивные соединения, способные повреждать клеточные структуры.
НАД- и ФАД- зависимые анаэробные дегидрогеназы, их важнейшие субстраты. Главная цепь дыхательных ферментов в митохондриях, ее структурная организация. Разность редокс-потенциалов окисляемых субстратов и кислорода как движущая сила для перемещения электронов в дыхательной цепи. Энергетика переноса электронов в дыхательной цепи.
Главная цепь дыхательных ферментов в митохондриях, ее структурная организация и биологическая роль. Цитохромы, цитохромоксидаза, химическая природа и роль в окислительных процессах.
В ходе многочисленных реакций дегидрирования, происходящих как во второй фазе катаболизма, так и в цикле Кребса, образуются восстановленные формы коферментов:НАДН+Н+ и ФАДН2. Эти реакции катализируются многочисленными пиридинзависимыми и флавинзависимыми дегидрогеназами.
В то же время пул коферментов в клетке ограничен, поэтому восстановленные формы коферментов должны «разряжаться», т.е. передавать полученные атомы водорода на другие соединения с тем, чтобы в конечном итоге они были переданы у аэробных организмов на свой конечный акцептор кислород. Этот процесс «разрядки» или окисления восстановленных НАДН+Н+ и ФАДН2 выполняет метаболический путь, известный под названием главная цепь дыхательных ферментов. Она локализована во внутренней мембране митохондрий.
Главная цепь дыхательных ферментов состоит из 3 сложных надмолекулярнных белковых комплексов, катализирующих последовательную передачу электронов и протонов с восстановленного НАДН+Н на кислород:
Первый надмолекулярный комплекс катализирует перенос 2 электронов и 2 протонов с восстановленного НАДН+Н+ на КоQ с образованием восстановленной формы последнего КоQH2. В состав надмолекулярного комплекса входит около 20 полипептидных цепей, в качестве простетических групп некоторых из них входит молекула фламинмононуклеотида(ФМН) и один или несколько так называемых железосерных центров (FeS)n. Электроны и протоны с НАДН+Н+вначале переносятся на ФМН с образованием ФМНН2, затем электроны с ФМНН2 переносятся через железосерные центры на КоQ, после чего к КоQ присоединяются протоны с образованием его восстановленной формы:
Следующий надмолекулярный комплекс также состоит из нескольких белков: цитохрома b, белка, имеющего в своем составе железосерный центр и цитохрома С1. В состав любого цитохрома входит геминовая группировка с входящим в неё атомом железа элемента с переменной валентностью, способного и принимать электрон, и отдавать его. Начиная с КоQН2 пути электронов и протонов расходятся. Электроны с КоQН2 передаются по цепи цитохромов, причем одновременно по цепи передается по 1 электрону, а протоны с КоQН2 уходят в окружающую среду.
Цитохром С оксидазный комплекс состоит из двух цитохромов:цитохрома а и цитохрома а3. Цитохром а имеет в своем составе геминовую группировку, а цитохром а3 кроме геминовой группировки в своем составе содержит еще и атом Cu. Электрон при участии этого комплекса переносится с цитохрома С на кислород.
НАД+ , КоQ и цитохром С не входят в состав ни одного из описанных комплексов. НАД+ служит коллектором-переносчиком протонов и электронов с большого ряда окисляемых в клетках субстратов. Функцию коллектора электронов и протонов выполняет также КоQ, принимая их с некоторых окисляемых субстратов (например, с сукцината или ацилКоА) и передавая электроны на систему цитохромов с выводом протоны в окружающую среду. Цитохром С также может принимать электроны непосредственно с окисляемых субстратов и передавать их далее на четвертый комплекс ЦДФ. Так, при окислении сукцината работает сукцинат-КоQ-оксидаредуктазный комплекс (Комплекс II), передающий протоны и электроны с сукцината непосредственно на КоQ, минуя НАД+:
Для того, чтобы молекула кислорода превратилась в 2 иона О2, на нее должны быть перенесены 4 электрона. Принято считать, что по цепи переносчиков электронов последовательно переносится 4 электрона с двух молекул НАДН+Н+ и до принятия всех четырех электронов молекула кислорода остается связанной в активном центре цитохрома а3. После принятия 4 электронов два иона О2 связывают по два протона каждый, образуя таким образом 2 молекулы воды.
В цепи дыхательных ферментов используется основная масса поступающего в организм кислорода до 95%. Мерой интенсивности процессов аэробного окисления в той или иной ткани служит дыхательный коэффициент ( QO2 ), который обычно выражается в количестве микролитров кислорода, поглощенных тканью за 1 час в расчете на 1 мг сухого веса ткани ( мкл.час1.мг1 ). Для миокарда он равен 5, для ткани надпочечников 10, для ткани коркового вещества почек 23, для печени 17, для кожи 0,8. Поглощение кислорода тканями сопровождается одновременным образованием в них углекислоты и воды. Этот процесс поглощения тканями О2 с одновременным выделением СО2 получил название тканевое дыхание.
Окислительное фосфорилирование как механизм аккумуляции энергии в клетке. Окислительное фосфорилирование в цепи дыхательных ферментов. Коэффициент Р/О. Окислительное фосфорилирование на уровне субстрата, его значение для клетки. Ксенобиотики-ингибиторы и разобщители окисления и фосфорилирования.
Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры и углеводы.
Однако чащевсего в качестве субстрата используются углеводы. Так, клетки головного мозга не способны использовать для дыхания никакой другой субстрат, кроме углеводов.
Предварительно сложные углеводы расщепляются до простых, вплоть до образования глюкозы. Глюкоза является универсальным субстратом в процессе клеточного дыхания.
Окисление глюкозы подразделяется на 3 этапа:
1.гликолиз;
2.окислительное декарбоксилирование или цикл Кребса;
3.окислительное фосфорилирование.
При этом гликолиз является общей фазой для аэробного и анаэробного дыхания.
Мерой эффективности процесса окислительного фосфорилирования в цепи дыхательных ферментов служит коэффициент Р/О; количество атомов фосфора, включенных из неорганического фосфата в состав АТФ, в расчете на 1 связанный атом кислорода, пошедший на образование воды в ходе работы дыхательной цепи. При окислении НАДН+Н+ он равен 3, при окислении ФАДН2( КоQН2) он составляет 2 и при окислении восстановленного цитохрома С он равен 1.
Ингибиторы окислительного фосфорилирования.Ингибиторы блокируют V комплекс:
1.Олигомицин — блокируют протонные каналы АТФ-синтазы.
2.Атрактилозид, циклофиллин — блокируют транслоказы.
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов.
В дальнейшем было показано, что цикл трикарбоновых кислот является «фокусом», в котором сходятся практически все метаболические пути.
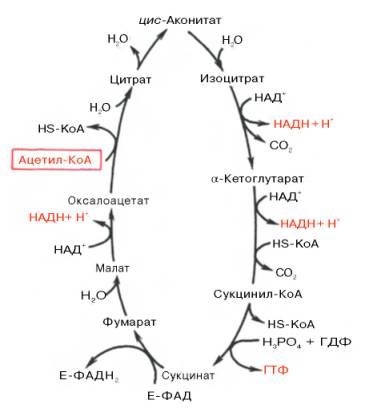
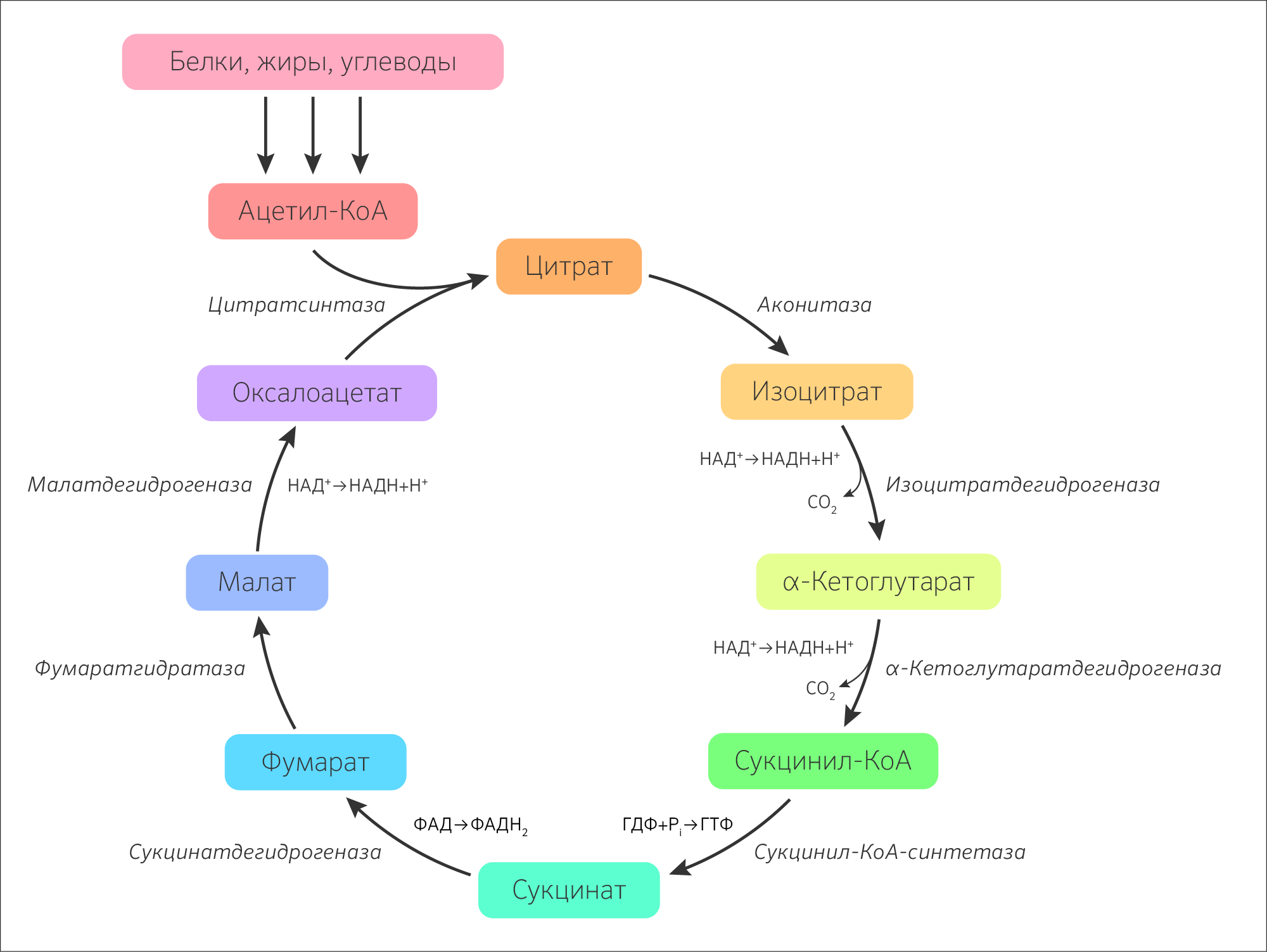
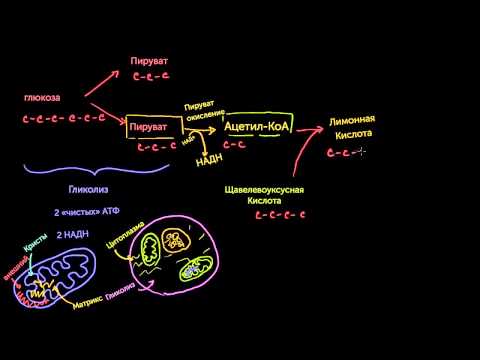
Итак, образовавшийся в результате окислительного декарбоксилирования пирувата ацетил-КоА вступает в цикл Кребса. Данный цикл состоит из восьми последовательных реакций (рис.
91). Начинается цикл с конденсации ацетил-КоА с оксалоацетатом и образования лимонной кислоты. (Как будет видно ниже, в цикле окислению подвергается собственно не ацетил-КоА, а более сложное соединение — лимонная кислота (трикарбоновая кислота).)
Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и дскарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса появляется оксалоацетат (четырехуглеродное соединение), т. е. в результате полного оборота цикла молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула оксалоацетата регенерируется. Ниже приводятся все восемь последовательных реакций (этапов) цикла Кребса.
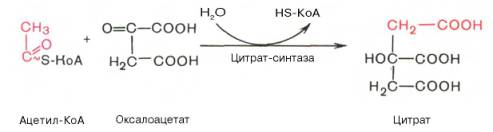
В первой реакции, катализируемой ферментом цитратсинтазой, ацетил-КоА конденсируется с оксалоацетатом.
В результате образуется лимонная кислота:
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
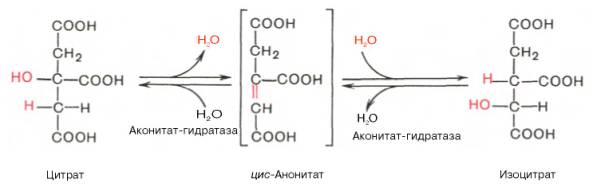
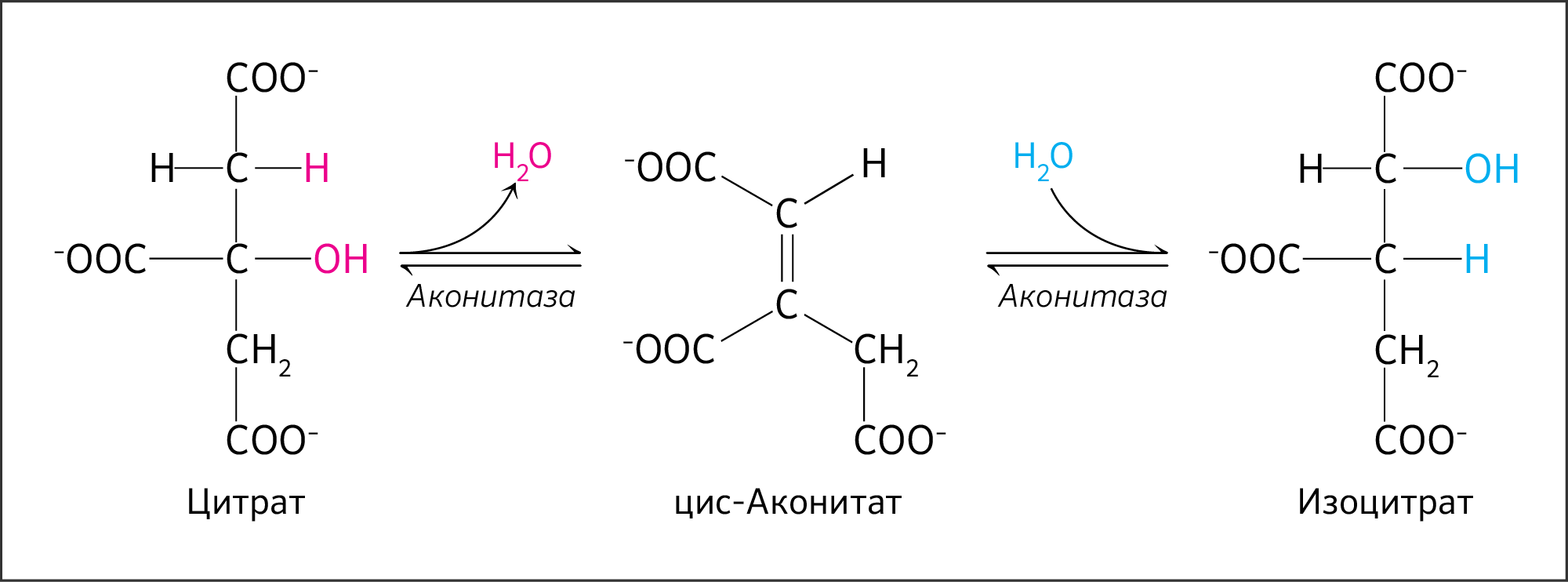
Во второй реакции цикла образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту.
Катализирует эти обратимые реакции гидратации-дегидратации фермент аконитат-гидратаза:
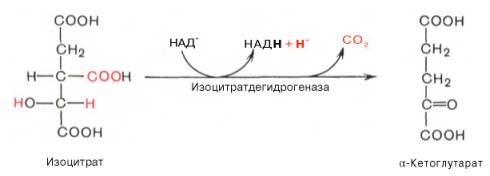
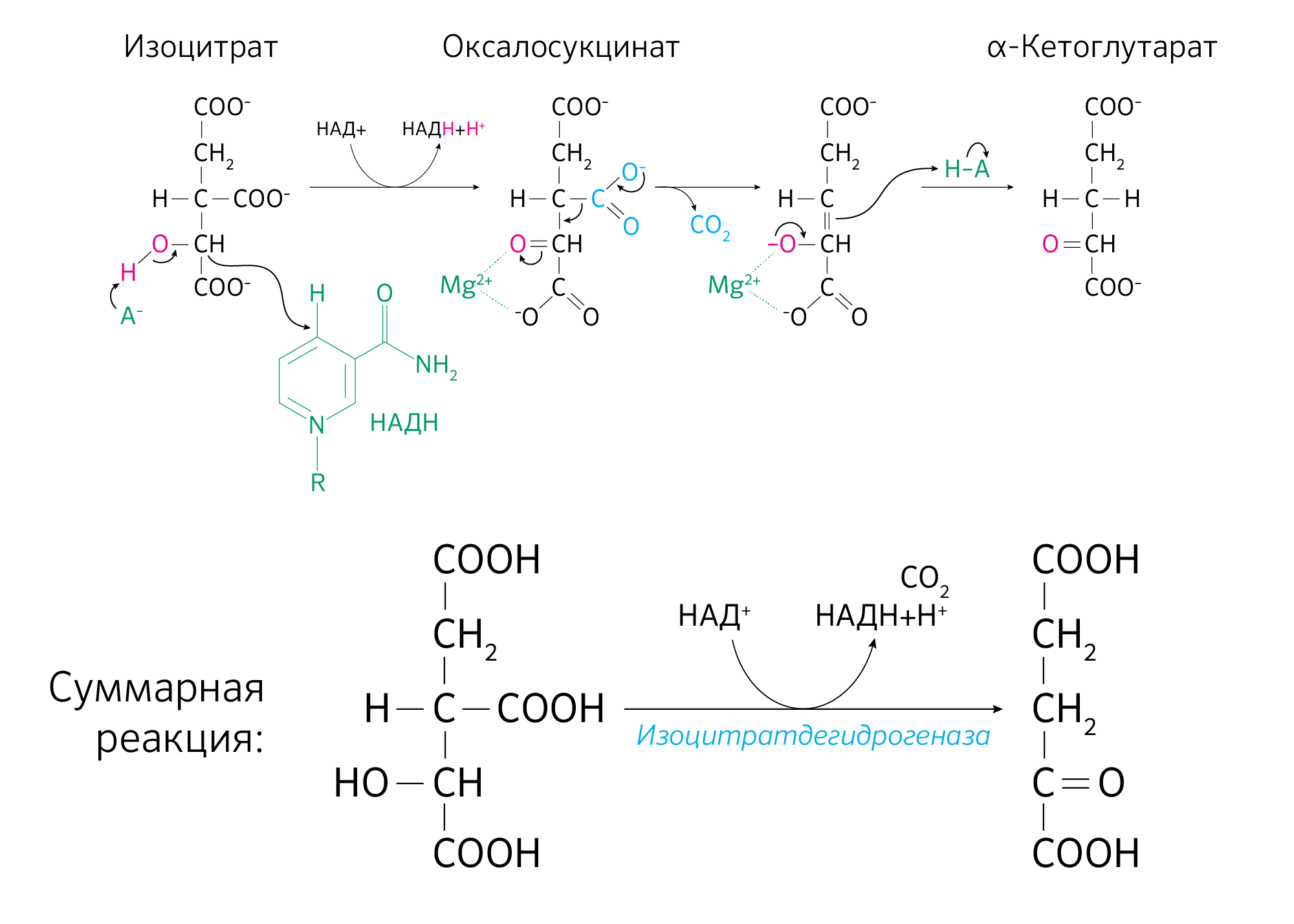
В третьей реакции, которая, по-видимому, лимитирует скорость цикла Кребса, изолимонная кислота дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы:
(В тканях существует два типа изоцитратдегидрогеназ: НАД- и НАДФ-зависимые.
Установлено, что роль основного катализатора окисления изолимонной кислоты в цикле Кребса выполняет НАД-зависимая изоцитратдегидрогеназа.)
В ходе изоцитратдегидрогеназной реакции изолимонная кислота декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+ или Мn2+.
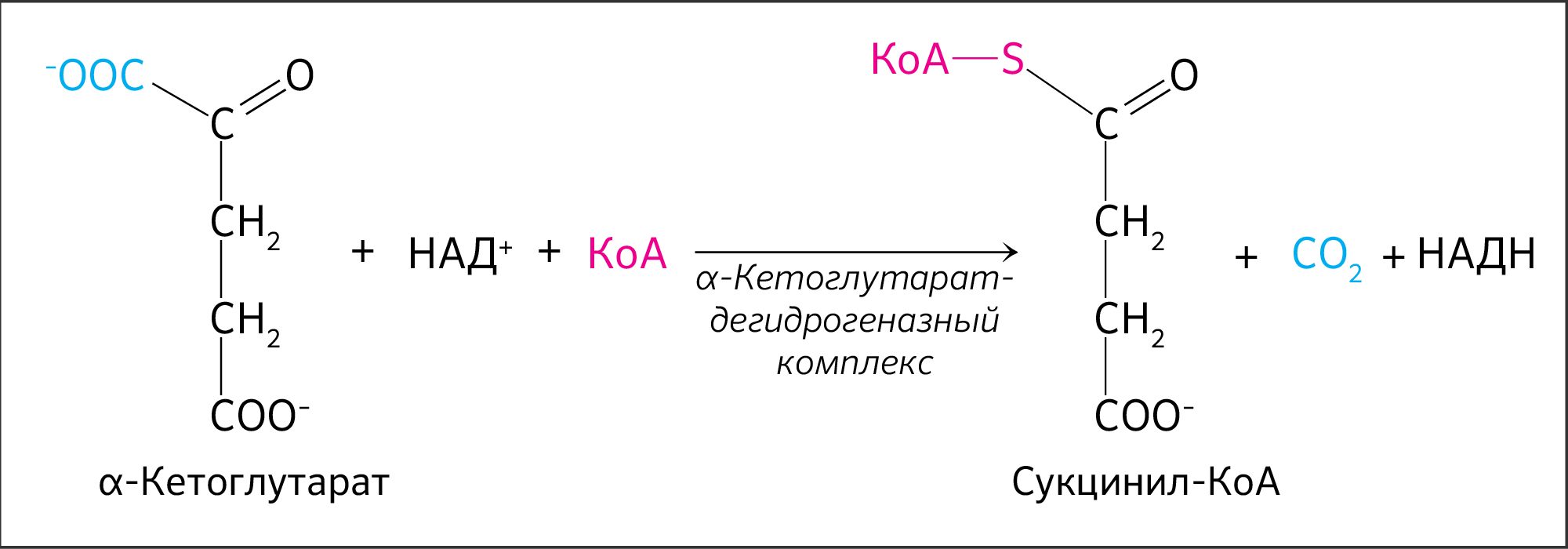
В четвертой реакции происходит окислительное декарбоксилирование α-кетоглутаровой кислоты до сукцинил-КоА. Механизм этой реакции сходен с реакцией окислительного декарбоксилирования пирувата до ацетил-КоА. α-Кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в ходе реакции принимают участие пять коферментов: TДФ, амид липоевой кислоты, HS-KoA, ФАД и НАД.
Суммарно данную реакцию можно написать так:
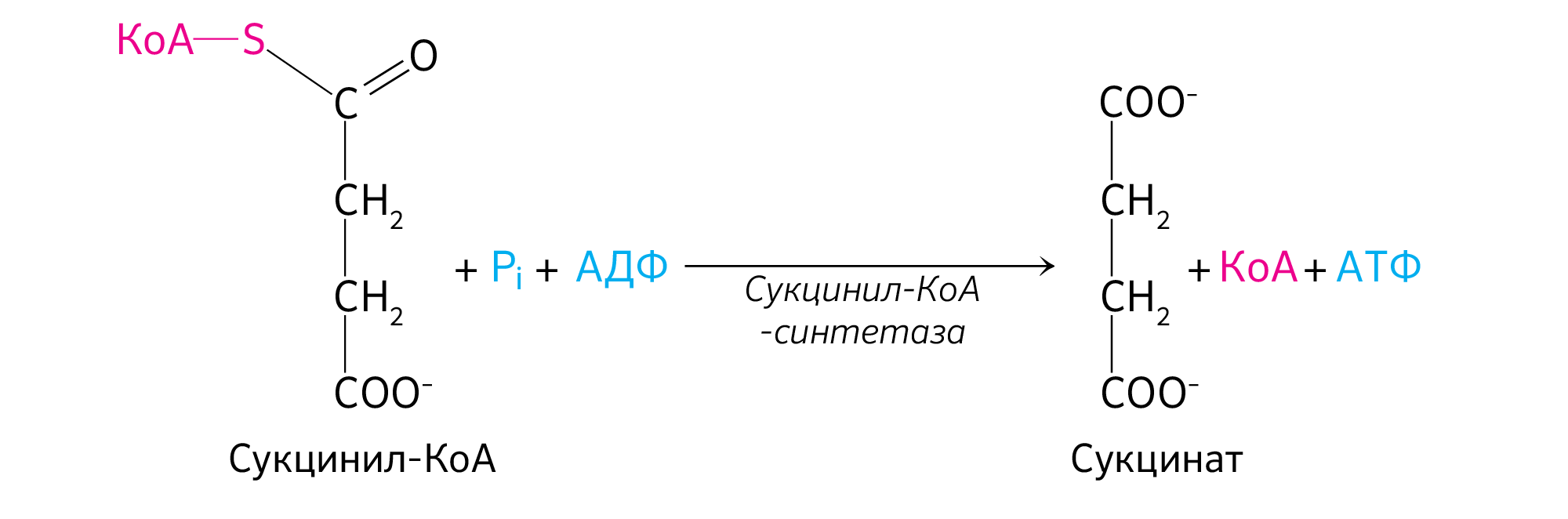
Пятая реакция катализируется ферментом сукцинил-КоА-синтетазой. В ходе этой реакции сукцинил-КоА при участии ГДФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ1 за счет высокоэргической тиоэфирной связи сукцинил-КоА:
(Образовавшийся ГТФ отдает затем свою концевую фосфатную группу на АДФ, вследствие чего образуется АТФ.
Образование высокоэргического нуклеозидтрифосфата в ходе сукцинил-КоА-синтетазной реакции — пример фосфорилирования на уровне субстрата.)
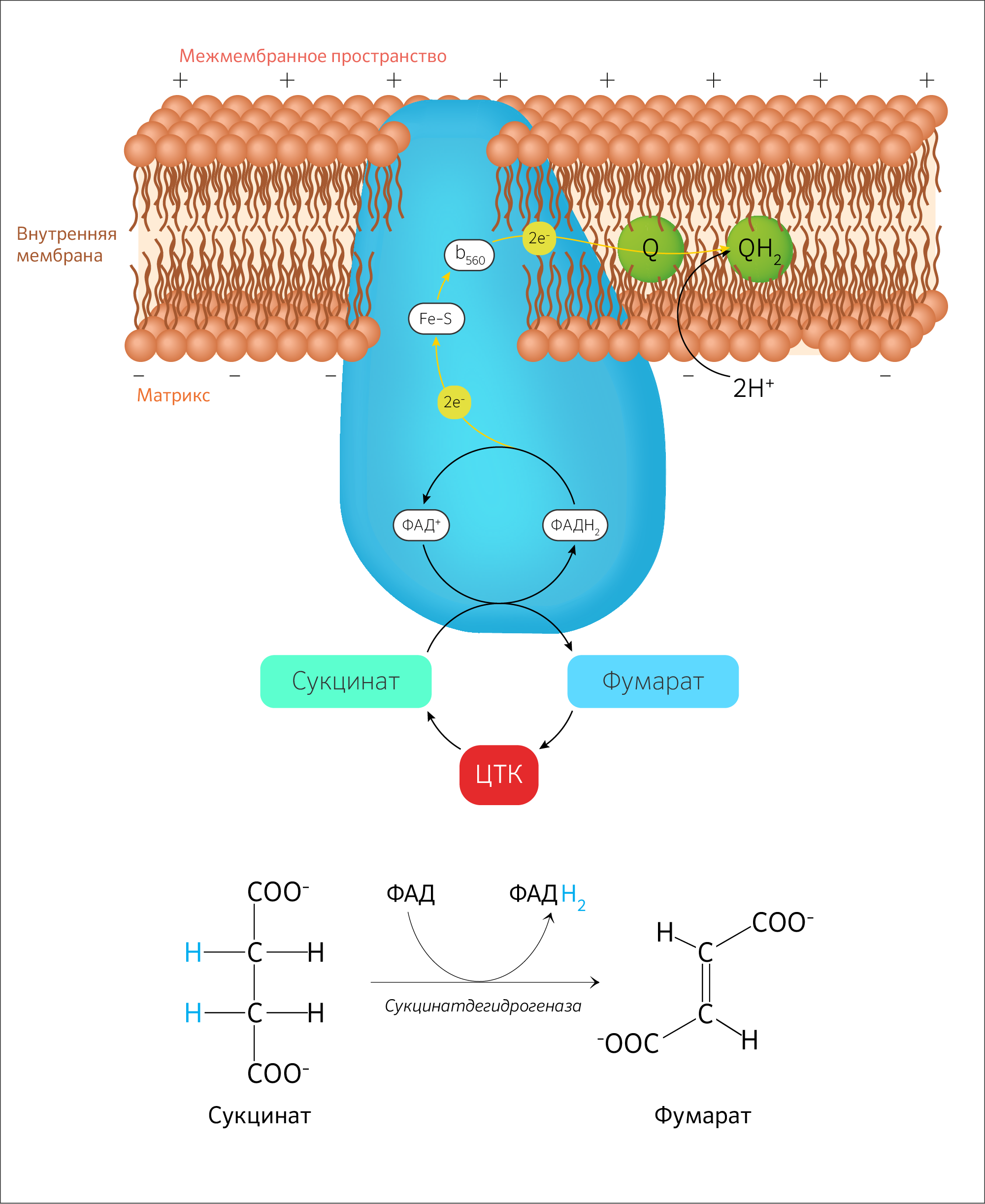
В шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком ковалентно связан кофермент ФАД:
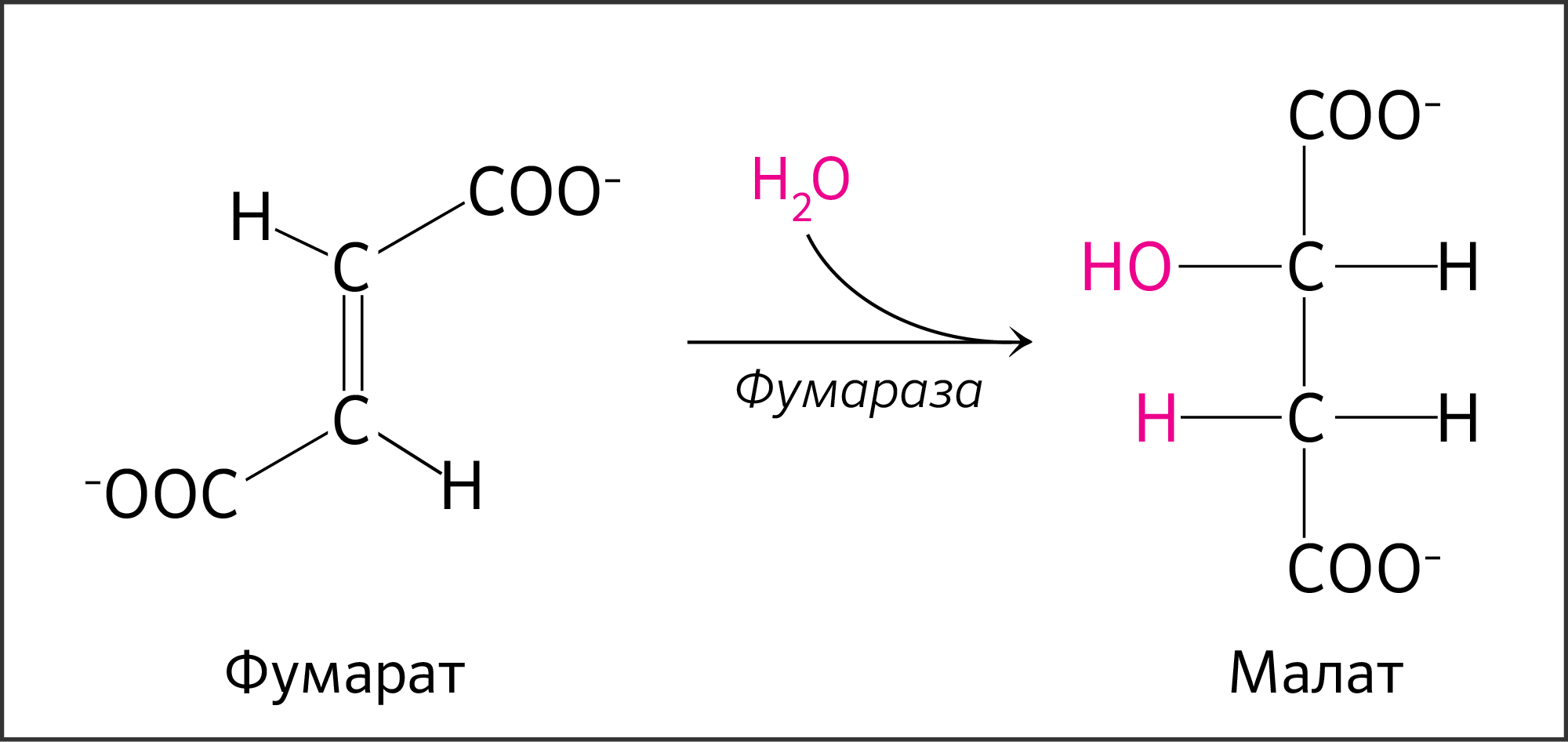
В седьмой реакции образовавшаяся фумаровая кислота гидратируется под влиянием фермента фумаратгидратазы.
Продуктом данной реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью, — в ходе данной реакции образуется L-яблочная кислота:
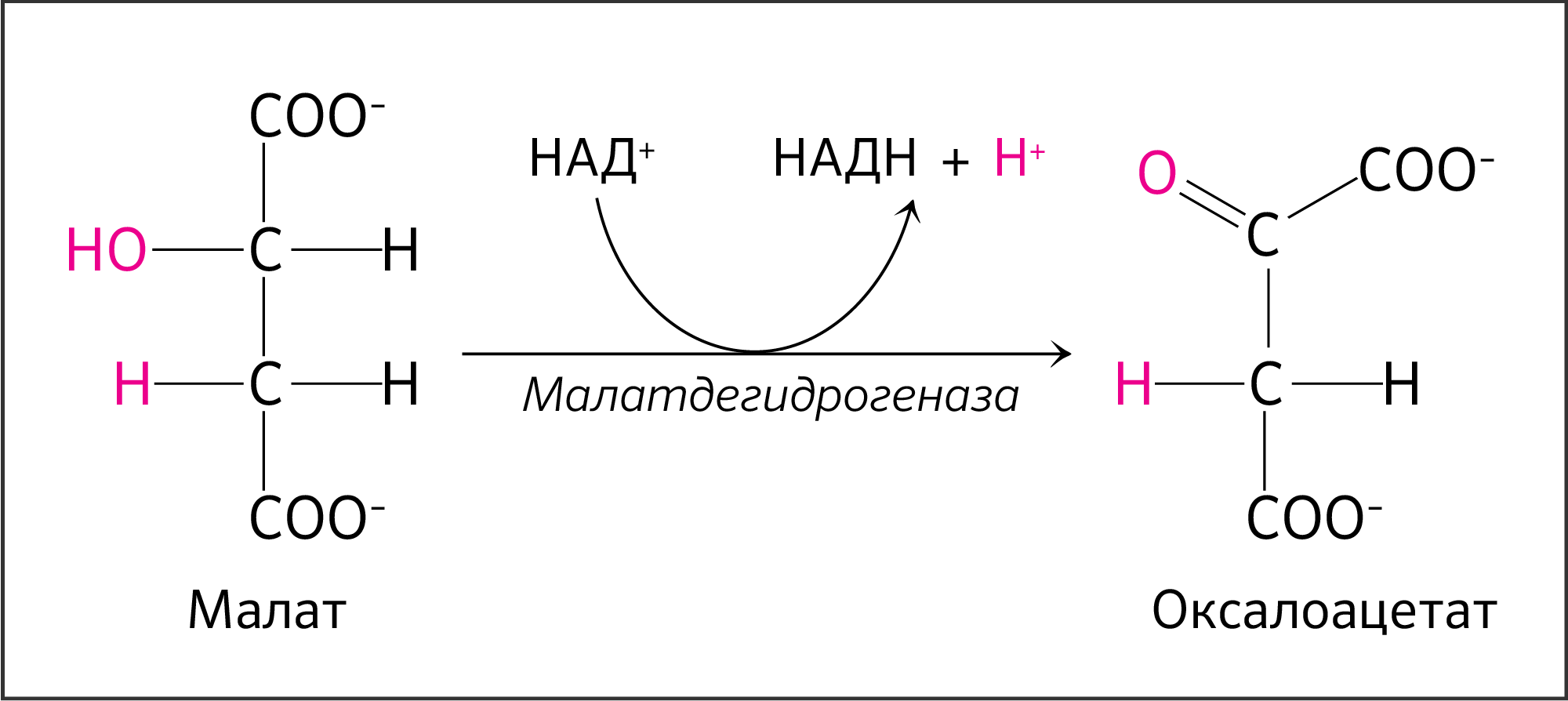
Наконец, в восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА.
Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов (или в цепи дыхательных ферментов), локализованной в митохондриях.
Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ.
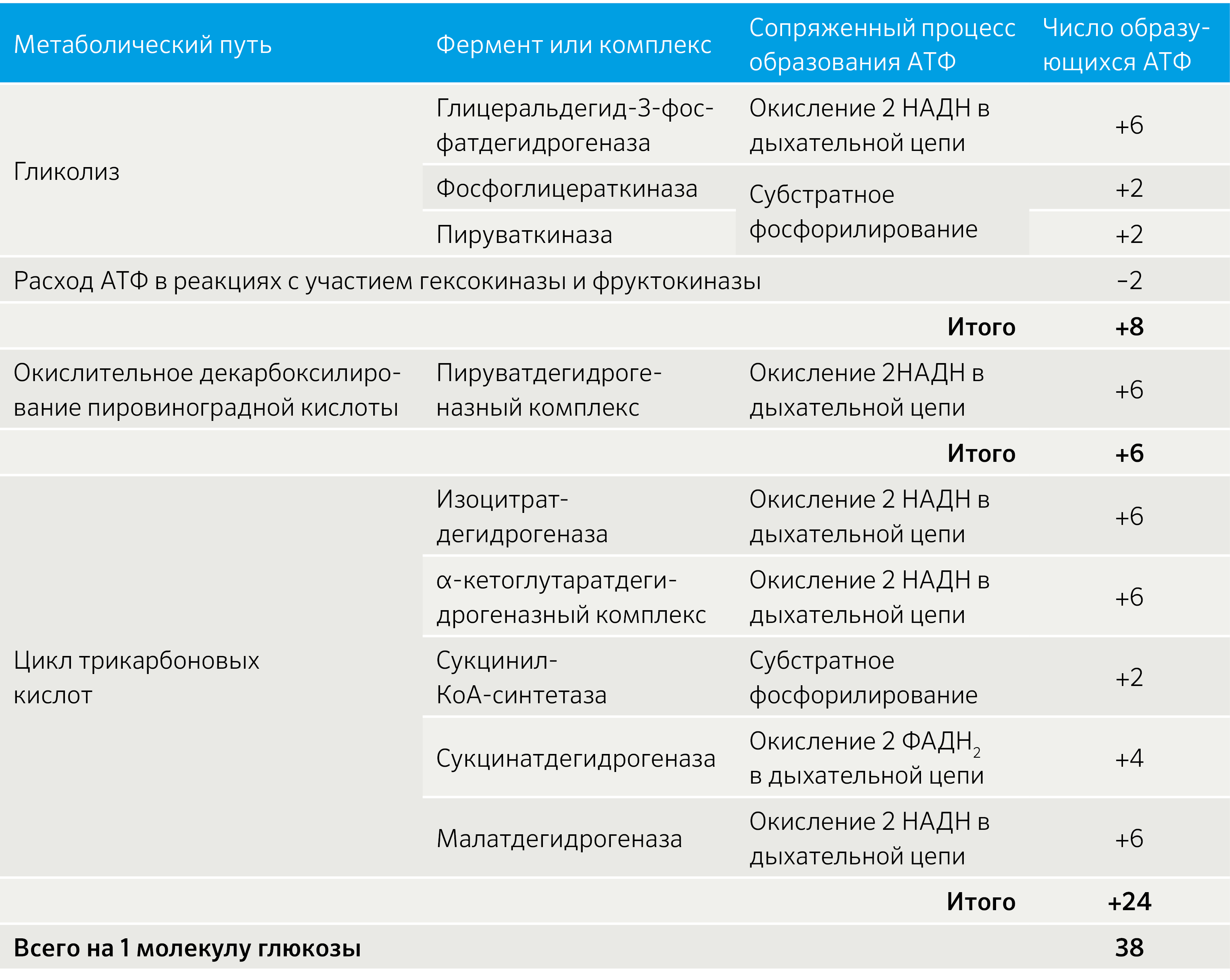
Из четырех пар атомов водорода три пары переносятся через НАД на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуются три молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, девять молекул АТФ. Одна пара атомов попадает в систему транспорта электронов через ФАД, — в результате образуются 2 молекулы АТФ. В ходе реакций цикла Кребса синтезируется также 1 молекула ГТФ, что равносильно 1 молекуле АТФ.
Итак, при окислении ацетил-КоА в цикле Кребса образуется 12 молекул АТФ.
Если же подсчитать энергетический эффект гликолитического расщепления глюкозы и последующего окисления пирувата до СO2 и Н2O, то он окажется значительно большим.
Как уже отмечалось, 1 молекула НАДН2 (3 молекулы АТФ) образуется при окислительном декарбоксилирова-нии пирувата в ацетил-КоА. Так как при расщеплении одной молекулы глюкозы образуются две молекулы пирувата, то при окислении их до 2 молекул ацетил-КоА и последующих двух оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление одной молекулы пирувата до СО2 и Н2O дает 15 молекул АТФ).
К этому надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 4 молекулы АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН2, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции.
Видео:Цикл Кребса (цикл трикарбоновых кислот) | БиохимияСкачать

Реакции цикла Кребса
Итого получим, что при расщеплении в тканях 1 молекулы глюкозы по уравнению: C6H1206 + 602 -> 6СO2 + 6Н2O синтезируется 36 молекул АТФ, что способствует накоплению в макроэргических фосфатных связях аденозинтрифосфата 36 X 34,5
1240 кДж (или, по другим данным, 36 Х 38
1430 кДж) свободной энергии.
Другими словами, из всей освобождающейся при аэробном окислении глюкозы свободной энергии (окодо 2840 кДж) до 50% ее аккумулируется в митохондриях в форме, которая может быть использована для выполнения различных физиологических функций.
Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем гликолиз. Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулы НАДН2 в дальнейшем при окислении дают не 6 молекул АТФ, а только 4. Дело в том, что сами молекулы внемитохондриального НАДН2 не способны проникать через мембрану внутрь митохондрий.
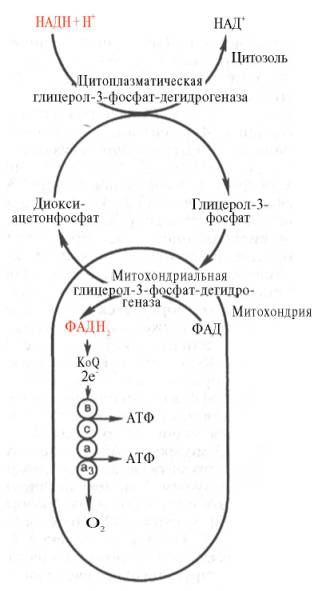
Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицерофосфатного челночного механизма (рис. 92). Как видно на рисунке, цитоплазматический НАДН2 сначала реагирует с цитоплазматическим дигидроксиацетонфосфатом, образуя глицерол-3-фосфат. Реакция катализируется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидрогеназой:
Дигидрооксиацетонфосфат + НАДН2 глицерол-3-фосфат + НАД
Образовавшийся глицерол-3-фосфат легко проникает через митохондриальную мембрану.
Внутри митохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до дигидроксиацетонфосфата:
Глицерол-З-фосфат + ФАД Дигидроксиацетонфосфат + фАДН2
Восстановленный флавопротеид (фермент — ФАДН2) вводит, на уровне KoQ приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а дигидроксиацетонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим НАДН2.
Таким образом, пара электронов (из одной молекулы цитоплазматического НАДН2), вводимая в дыхательную цепь с помощью глицерофосфатного челночного механизма, дает не 3 АТФ, а 2 АТФ.
В настоящее время четко установлено, что глицерофосфатный челночный механизм имеет место в клетках печени.
Относительно других тканей этот вопрос пока не выяснен.
Если же не считать энергии, затрачиваемой на проникновение НАДН2 в митохондрии, то в результате полного окисления 1 молекулы глюкозы может образоваться 38 молекул АТФ.
Видео:Цикл трикарбоновых кислот. Цикл КребсаСкачать

Цикл трикарбоновых кислот
Реакции гликолиза идут в цитозоле и в хлоропластах. Есть три этапа гликолиза:
1 — подготовительный (фосфорилирование гексозы и образование двух фосфотриоз);
2 — первое окислительное субстратное фосфорилирование;
3 — второе внутримолекулярное окислительное субстратное фосфорилирование.
Сахара подвергаются метаболическим превращениям в виде сложных эфиров фосфорной кислоты.
Глюкоза предварительно активируется путем фосфорилирования. В АТФ-зависимой реакции, катализируемой гексокиназой, глюкоза превращается в глюкозо-6-фосфат. После изомеризации глюкозо-6-фосфата в фруктозо-6-фосфат последний вновь фосфорилируется с образованием фруктозо-1,6-дифосфата. Фосфофруктокиназа, катализирующая эту стадию, является важным ключевым ферментом гликолиза.
Таким образом, на активацию одной молекулы глюкозы расходуются две молекулы АТФ. Фруктозо-1,6-дифосфат расщепляется альдолазой на два фосфорилированных С3-фрагмента. Эти фрагменты — глицеральдегид-3-фосфат и дигид- роксиацетонфосфат — превращаются один в другой триозофосфатизомеразой.
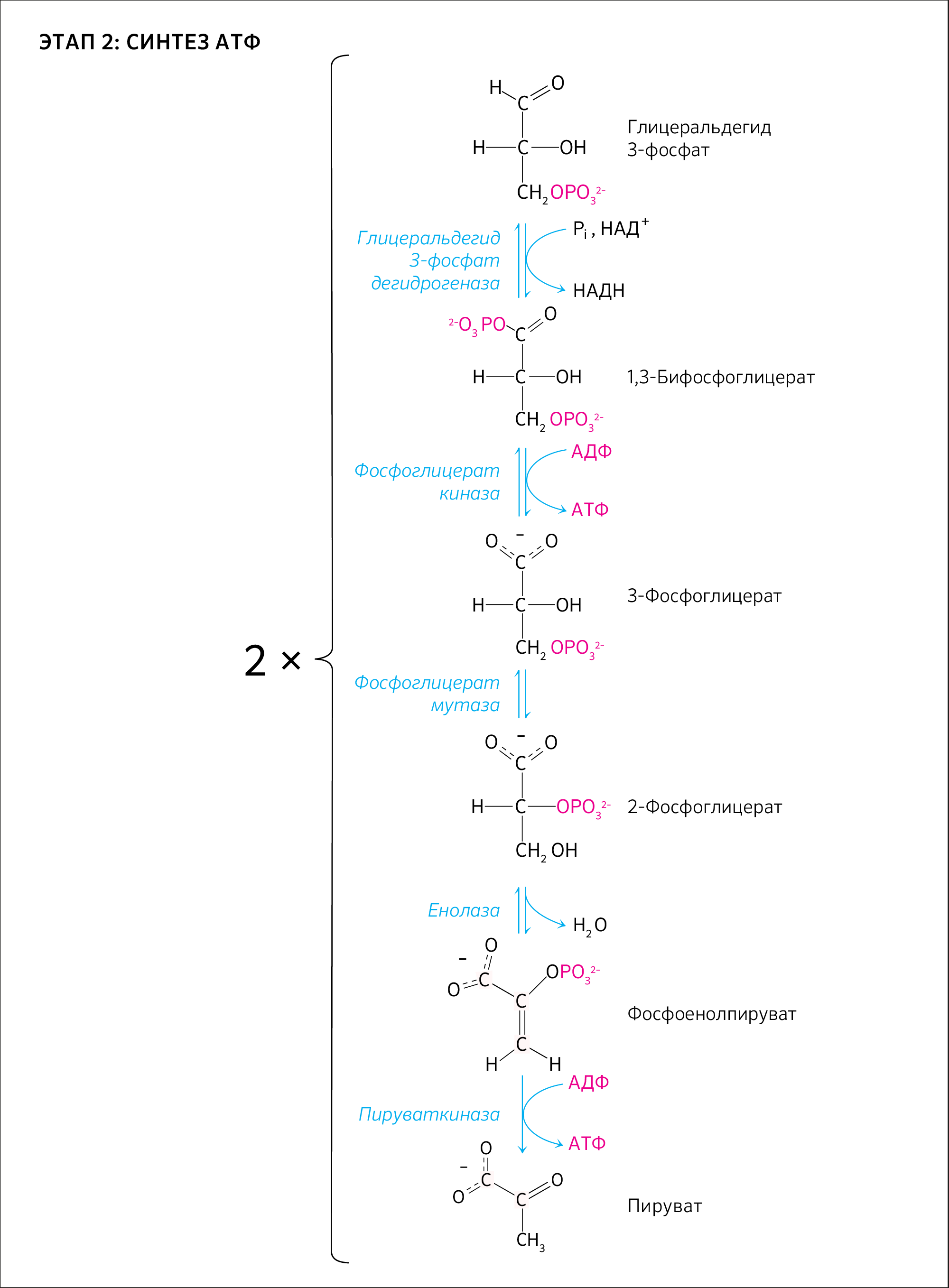
Глицеральдегид-3-фосфат окисляется глицеральдегид-З-фосфатдегид- рогеназой с образованием НАДН + Н+.
В этой реакции в молекулу включается неорганический фосфат с образованием 1,3-дифосфоглицерата. Такое промежуточное соединение содержит смешанную ангидридную связь, расщепление которой является высокоэкзоэргическим процессом. На следующей стадии, катализируемой фосфоглицераткиназой, гидролиз этого соединения сопряжен с образованием АТФ.
Следующий промежуточный продукт, гидролиз которого может быть сопряжен с синтезом АТФ, образуется в реакции изомеризации 3- фосфоглицерата, полученного в результате реакции окисления 3ФГА, в 2- фосфоглицерат (фермент фосфоглицератмутаза) и последующего отщепления воды (фермент энолаза).
Продукт представляет собой сложный эфир фосфорной кислоты и энольной формы пирувата и потому называется фосфоэнолпируватом (ФЭП). На последней стадии, которая катализируется пируваткиназой, образуются пируват и АТФ.
Наряду со стадией окисления ФГА и тиокиназной реакцией в цитратном цикле это третья реакция, позволяющая клеткам синтезировать АТФ, независимо от дыхательной цепи.
Несмотря на образование АТФ, она высоко-экзоэргична и потому необратима.
В результате гликолиза из одной молекулы глюкозы образуется 2 молекулы пировиноградной кислоты и 4 молекулы АТФ. Поскольку макроэргическая связь формируется прямо на окисляемом субстрате, такой процесс образования АТФ получил название субстратного фосфорилирования.
Две молекулы АТФ покрывают расход на первоначальное активирование субстрата за счет фосфорилирования. Следовательно, накапливаются 2 молекулы АТФ. Кроме того, в ходе гликолиза 2 молекулы НАД восстанавливаются до НАДН. В процессе гликолиза молекула глюкозы деградирует до двух молекул пирувата.
Кроме того, образуется по две молекулы АТФ и НАДН + H+ (аэробный гликолиз).
В анаэробных условиях пируват претерпевает дальнейшие превращения, обеспечивая при этом регенерацию НАД+. При этом образуются продукты брожения, такие, как лактат или этанол (анаэробный гликолиз). В этих условиях гликолиз является единственным способом получения энергии для синтеза АТФ из АДФ и неорганического фосфата. В аэробных условиях образовавшиеся 2 молекулы пировиноградной кислоты вступают в аэробную фазу дыхания.
Видео:ЦТК(Цикл трикарбоновых кислот), цикл КрепсаСкачать

Цикл Кребса
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса.
Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата).
Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление CO2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е.
в результате полного оборота цикла одна молекула ацетил-КоА сгорает до CO2 и Н2O , а молекула оксалоацетата регенерируется. В ходе реакций цикла освобождается основное количество энергии, содержащейся в окисляемом субстрате, причем большая часть этой энергии не теряется для организма, а утилизируется при образовании высокоэнергетических конечных фосфатных связей АТФ.
При окислении глюкозы в процессе дыхания при функционировании гликолиза и цикла Кребса в общей сложности образуются 38 молекул АТФ.
У растений существует иной путь переноса электронов на кислород. Этот путь не ингибируется цианидом и поэтому назван цианидустойчивым, или альтернативным. Цианидустойчивое дыхание связано с функционированием в дыхательной цепи помимо цитохромоксидазы альтернативной оксидазы, которая впервые была выделена в 1978 г.
При этом пути дыхания энергия в основном не аккумулируется в АТФ, а рассеивается в виде тепла. Ингибируется цианидустойчивое дыхание салициловой кислотой. У большинства растений цианидустойчивое дыхание составляет 10—25%, но иногда может достигать 100% общего поглощения кислорода. Это зависит от вида и условий произрастания растений. Функции альтернативного дыхания до конца не ясны. Этот путь активируется при высоком содержании АТФ в клетке и ингибировании работы основной цепи транспорта электронов при дыхании.
Предполагают, что цианидустойчивый путь играет роль при действии неблагоприятных условий. Доказано, что альтернативное дыхание принимает участие в образовании тепла. Рассеивание энергии в виде тепла может обеспечивать повышение температуры растительных тканей на 10—15°С выше температуры окружающей среды.
Для объяснения механизма синтеза АТФ, сопряженного с транспортом электронов в ЭТЦ дыхания, были предложены несколько гипотез:
- химическая (по аналогии с субстратным фосфорилированием);
- механохимическая (основанная на способности митохондрий изменять объем);
- хемиосмотическая (постулирующая промежуточную форму трансформации энергии окисления в виде трансмембранного протонного градиента).
Процесс образования АТФ в результате переноса ионов Н через мембрану митохондрии получил название окислительного фосфолирования.
Он осуществляется при участии фермента АТФ-синтетазы. Молекулы АТФ-синтетазы располагаются в виде сферических гранул на внутренней стороне внутренней мембраны митохондрий.
В результате расщепления двух молекул пировиноградной кислоты и переноса ионов водорода через мембрану по специальным каналам синтезируется в целом 36 молекул АТФ (2 молекулы в цикле Кребса и 34 молекулы в результате переноса ионов Н через мембрану).
Суммарное уравнение аэробного дыхания можно выразить следующим образом:
C6H12O6 + O2+ 6H2O + 38АДФ + 38Н3РО4→
6CO2+ 12H2O + 38АТФ
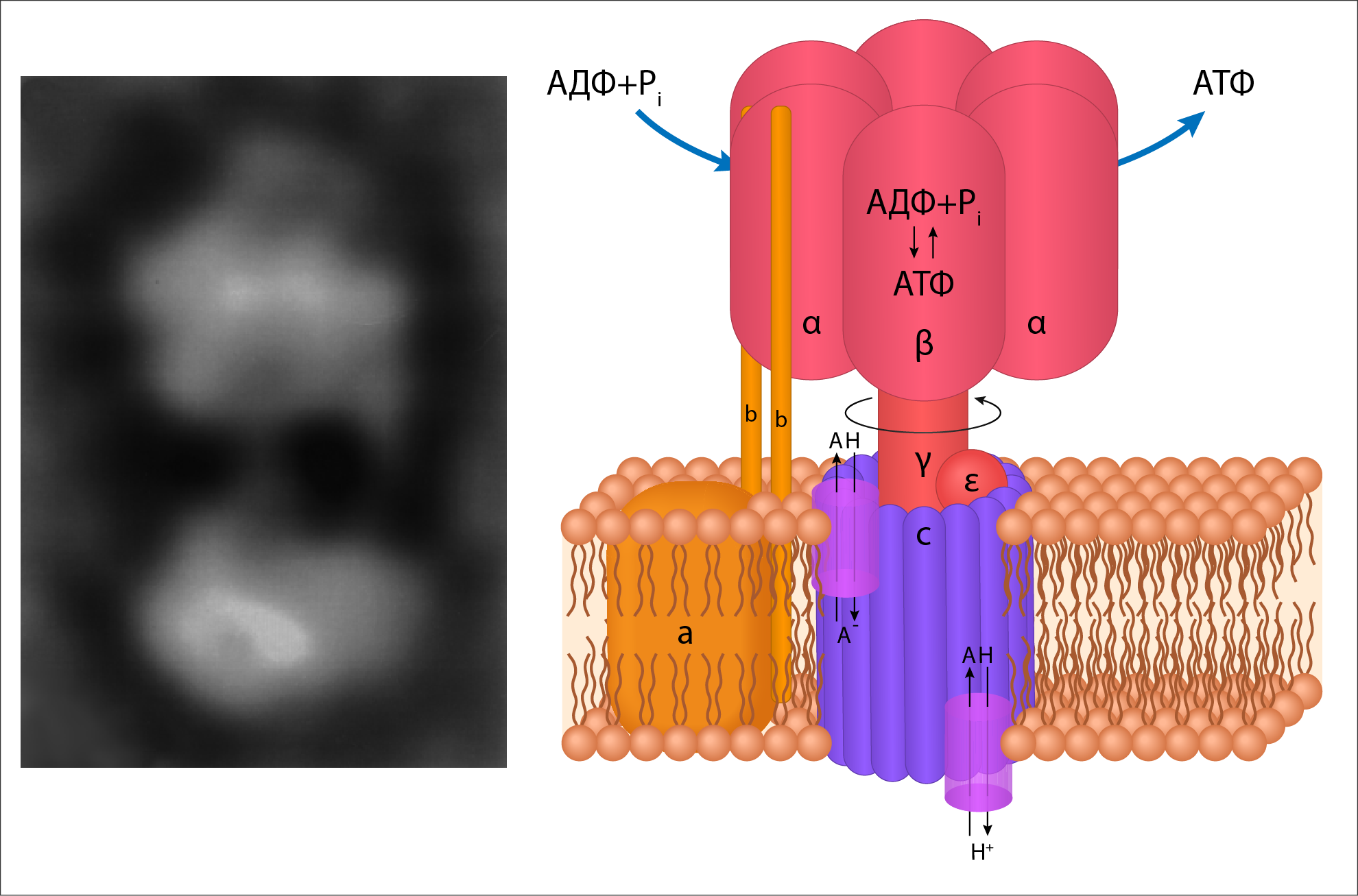
Н+-транслоцирующая АТФ-синтаза состоит из двух частей: встроенного в мембрану протонного канала (F0) из по меньшей мере 13-ти субъединиц и каталитической субъединицы (Fi), выступающей в матрикс.
«Головка» каталитической части образована тремя+ — и тремя- субъединицами, между которыми расположены три активных центра.
«Ствол» структуры образуют полипептиды Fo-части и у-, 5- и s-субъединиц «головки».
Каталитический цикл подразделяется на три фазы, каждая из которых проходит поочередно в трех активных центрах. Вначале идет связывание АДФ (ADP) и Pi, затем образуется фосфоангидридная связь и наконец освобождается конечный продукт реакции.
При каждом переносе протона через белковый канал F0 в матрикс все три активных центра катализируют очередную стадию реакции. Предполагается, что энергия протонного транспорта прежде всего расходуется на повороту -субъединицы, в результате которого циклически изменяются конформации а- и в-субъединиц.
Видео:Как запомнить цикл КребсаСкачать

Функции цикла Кребса
1.Водороддонорная функция. Цикл Кребса поставляет субстраты для дыхательной цепи (НАД-зависимые субстраты: изоцитрат, -кетоглутарат, малат; ФАД-зависимый субстрат – сукцинат).
2.Катаболическая функция. В ходе ЦТК окисляются до конечных продуктов обмена
ацетильные остатки, образовавшиеся из топливных молекул (глюкоза, жирные кислоты, глицерол, аминокислоты).
Субстраты ЦТК являются основой для синтеза многих молекул (кетокислоты — α-кетоглутарат и ЩУК — могут превращаться в аминокислоты глу и асп; ЩУК может превращаться в глюкозу, сукцинил-КоА используется на синтез гема).
4.Анаплеротическая функция. Цикл не прерывается благодаря реакциям анаплероза (пополнения) фонда его субстратов. Важнейшей анаплеротической реакцией является образование ЩУК (молекулы, запускающей цикл) путем карбоксилирования ПВК.
Видео:Цикл Кребса/Цикл лимонной кислоты (видео 7) | Клеточное дыхание | БиологияСкачать
ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (ЦИКЛ КРЕБСА)
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбо-новых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом, цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот.
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис. 10.9). Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Рассмотрим все восемь последовательных реакций (этапов) цикла Кребса.
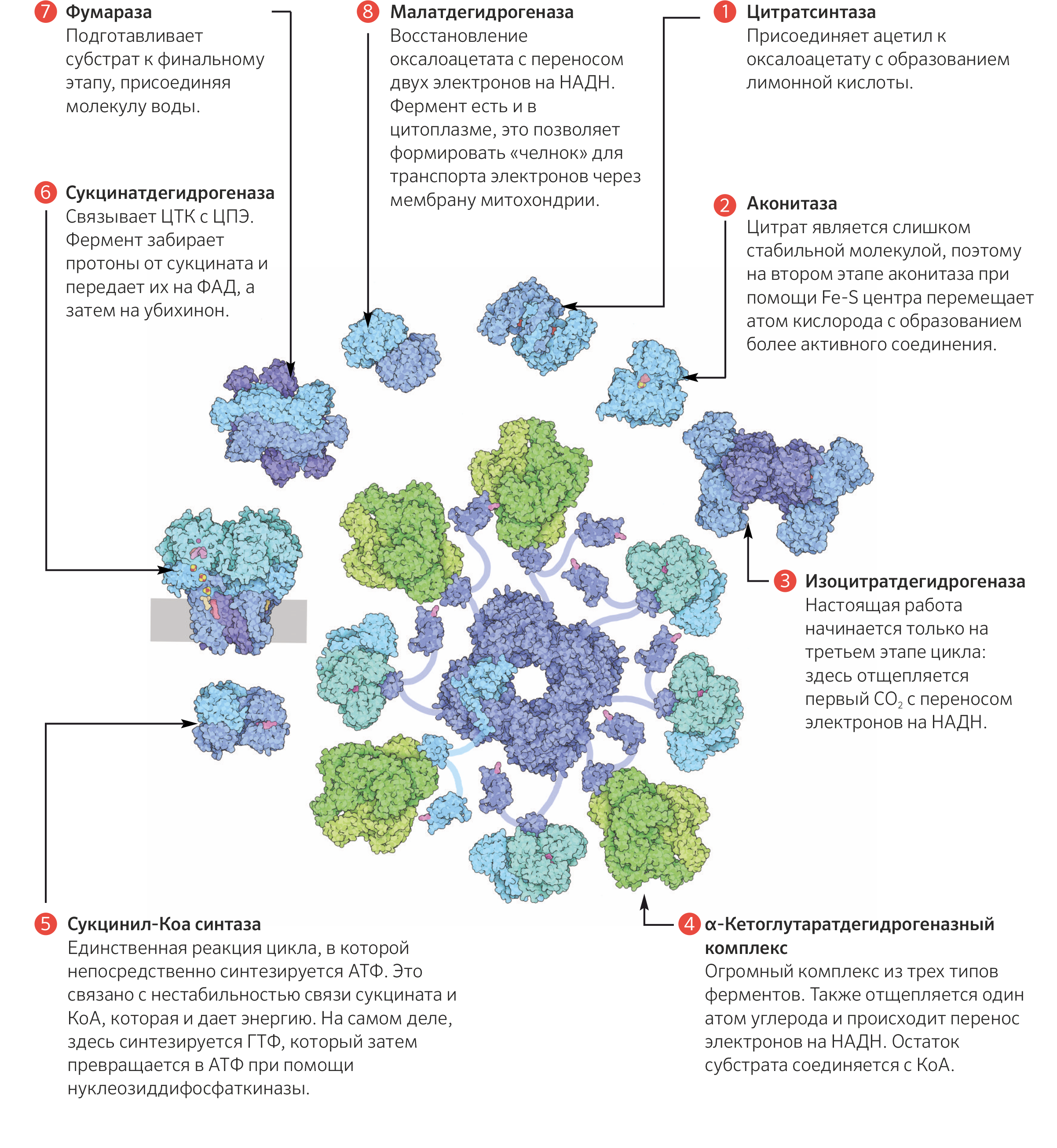
Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:
Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы.
В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg 2+ или Мn 2+ .
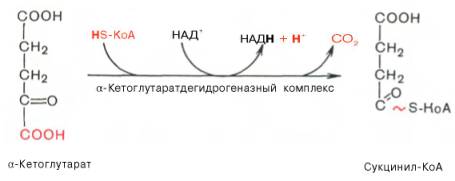
Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковым реакции окислительного декарбоксилирования пирувата до ацетил-КоА, α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД + .
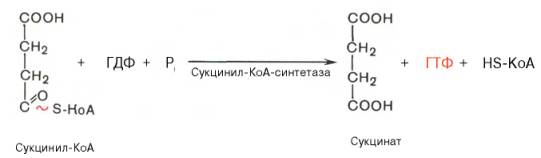
Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
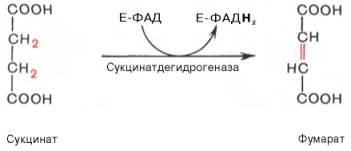
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней ми-тохондриальной мембраной:
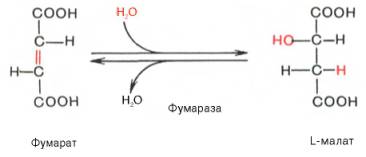
Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью (см. главу 4) – в ходе реакции образуется L-яблочная кислота:
Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД + и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3 молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9 молекул АТФ (см. главу 9). Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электронов через KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребса синтезируется также одна молекула ГТФ (субстратное фосфорилирование), что равносильно одной молекуле АТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ.
Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующего окисления двух образовавшихся молекул пирувата до СО2 и Н2О, то он окажется значительно большим.
Как отмечалось, одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилировании пирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
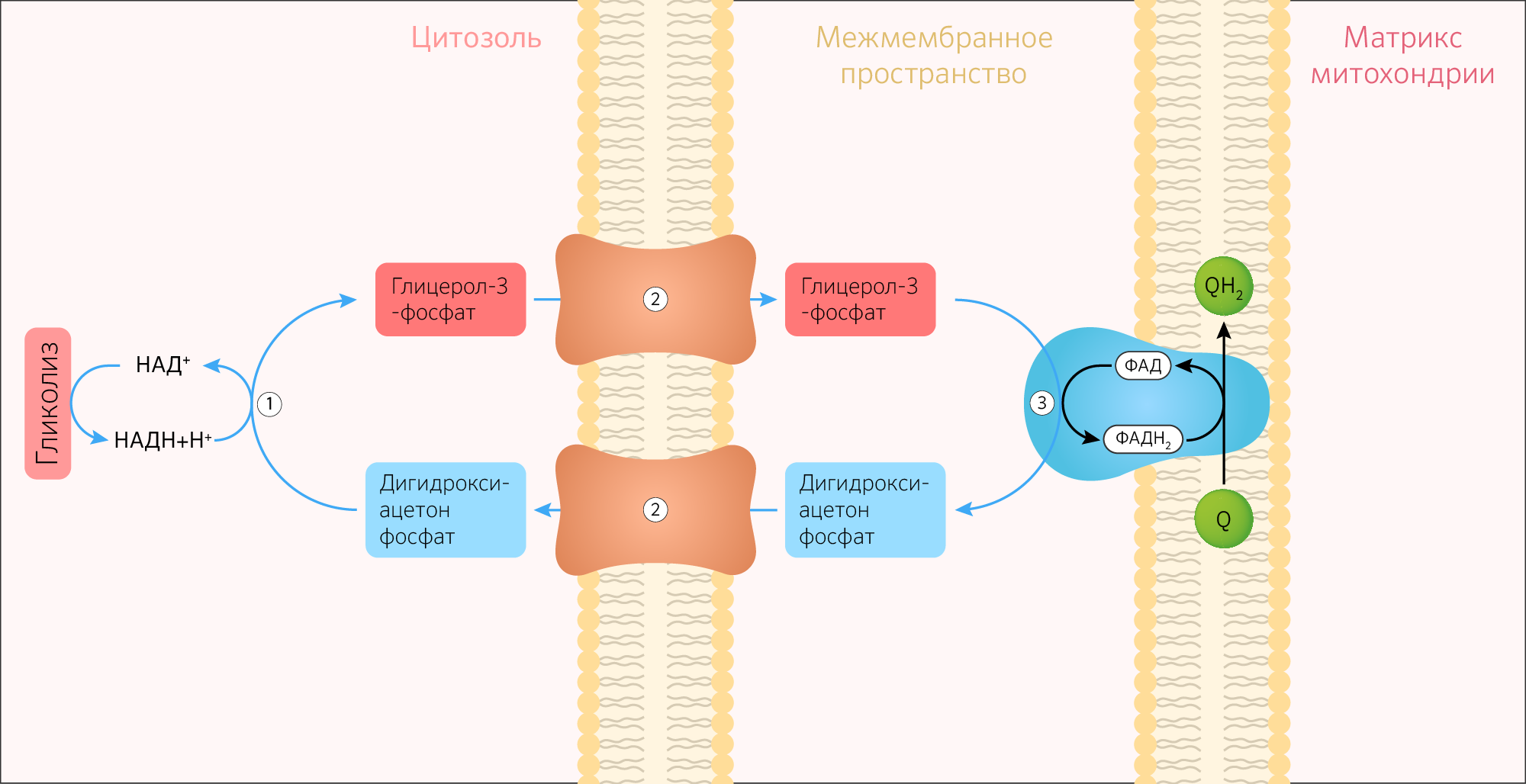
Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулы НАДН в дальнейшем при окислении могут давать не 6 молекул АТФ, а только 4. Дело в том, что сами молекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицеролфосфатного челночного механизма (рис. 10.10). Ци-топлазматический НАДН сначала реагирует с цитоплазматическим ди-гидроксиацетонфосфатом, образуя глицерол-3-фосфат. Реакция катализи-
Рис. 10.10. Глицеролфосфатный челночный механизм. Объяснение в тексте.
руется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидроге-назой:
Дигидроксиацетонфосфат + НАДН + Н + Глицерол-3-фосфат + НАД + .
Образовавшийся глицерол-3-фосфат легко проникает через митохонд-риальную мембрану. Внутри митохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до диоксиацетонфосфата:
Глицерол-3-фосфат + ФАД Диоксиацетонфосфат + ФАДН2.
Восстановленный флавопротеин (фермент-ФАДН2) вводит на уровне KoQ приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а диоксиаце-тонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим НАДН + Н + . Таким образом, пара электронов (из одной молекулы цитоплазматического НАДН + Н + ), вводимая в дыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не 3, а 2 АТФ.
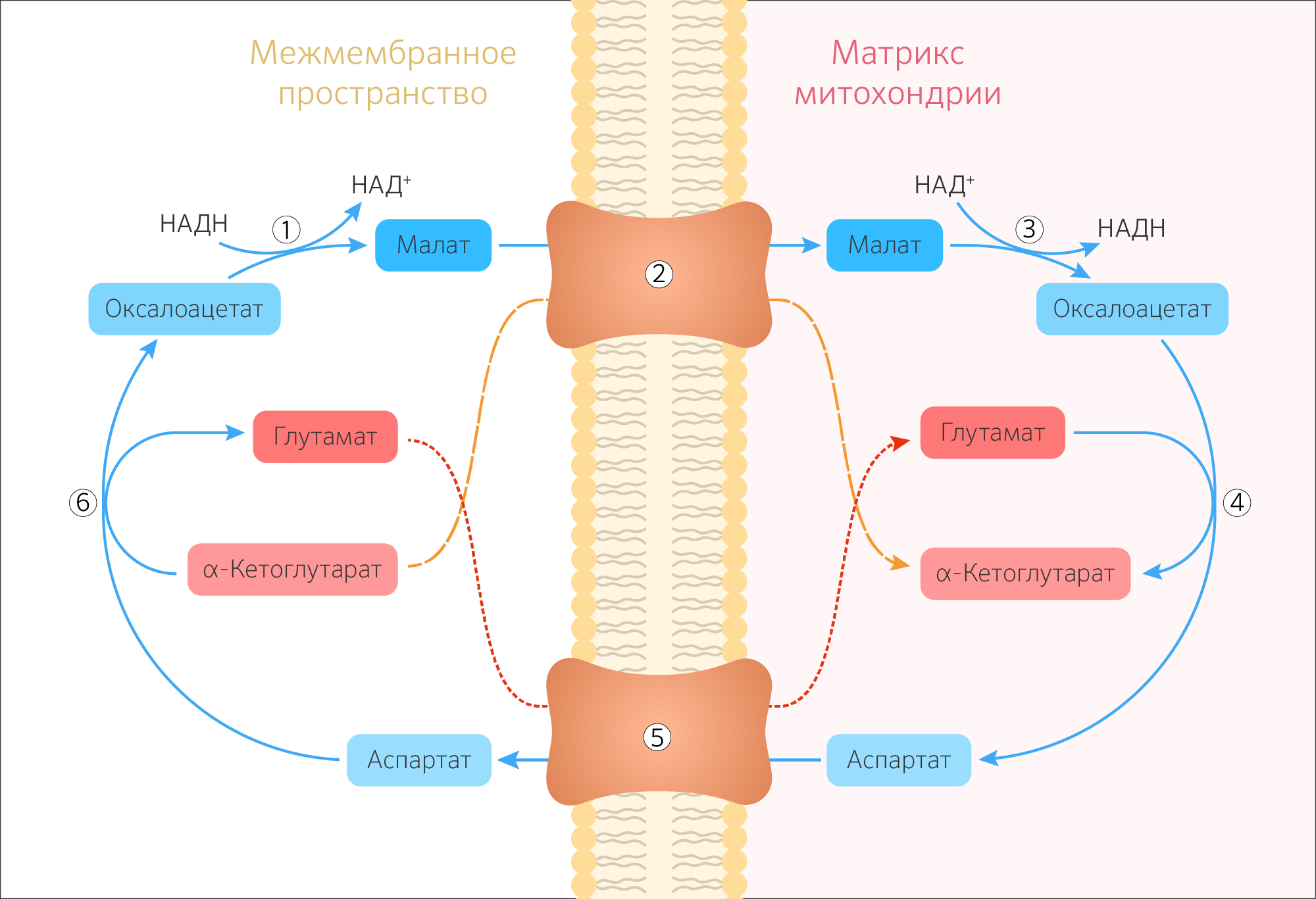
Рис. 10.11. Малат-аспартатная челночная система для переноса восстанавливающих эквивалентов от цитозольного НАДН в митохондриальный матрикс. Объяснение в тексте.
В дальнейшем было показано, что с помощью данного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного НАДН + Н + в митохондрии.
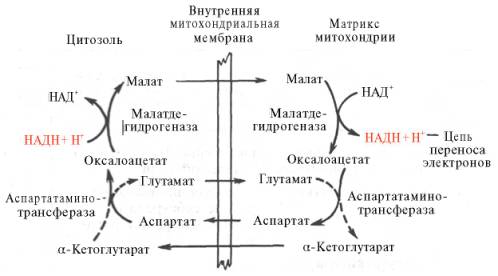
В клетках печени, почек и сердца действует более сложная малат-ас-партатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и ас-партатаминотрансферазы как в цитозоле, так и в митохондриях.
Установлено, что от цитозольного НАДН + Н + восстановленные эквиваленты сначала при участии фермента малатдегидрогеназы (рис. 10.11) переносятся на цитозольный оксалоацетат. В результате образуется малат, который с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннюю мембрану митохондрии в матрикс. Здесь малат окисляется в оксалоацетат, а матриксный НАД + восстанавливается в НАДН + Н + , который может теперь передавать свои электроны в цепь дыхательных ферментов, локализованную на внутренней мембране митохондрии. В свою очередь образовавшийся оксалоацетат в присутствии глутамата и фермента АсАТ вступает в реакцию трансаминирования. Образующиеся аспарат и α-кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий.
Транспортирование в цитозоле регенерирует оксалоацетат, что вызывает к действию следующий цикл. В целом процесс включает легкообратимые реакции, происходит без потребления энергии, «движущей силой» его является постоянное восстановление НАД + в цитозоле гли-церальдегид-3-фосфатом, образующимся при катаболизме глюкозы.
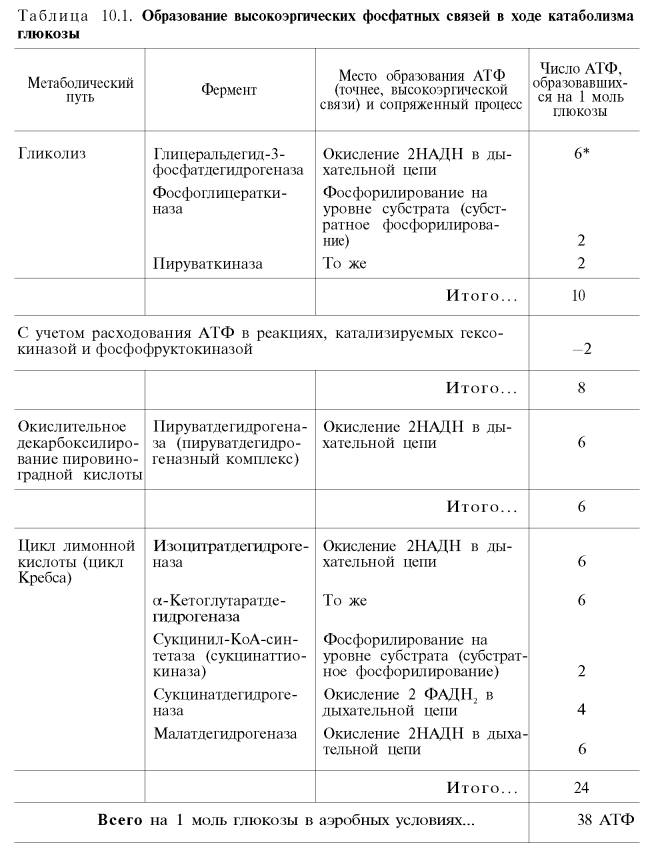
Итак, если функционирует малат-аспартатный механизм, то в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТФ (табл. 10.1).
В табл. 10.1 приведены реакции, в которых происходит образование высокоэргических фосфатных связей в ходе катаболизма глюкозы, с указанием эффективности процесса в аэробных и анаэробных условиях.
Видео:Цикл Кребса: Общее понимание и Последовательность реакцийСкачать

Цикл трикарбоновых кислот
Биохимия является основой для глубокого понимания всего, что происходит на более высоких уровнях организации живой материи. Поэтому без опоры на такие знания сегодня немыслимо полноценное биомедицинское образование.
Преподавание курса биохимии будущим врачам гуманной и ветеринарной медицины имеет цель формировать у них универсальные профессиональные компетенции. Предлагаемое учебное пособие продолжает цикл учебных материалов по основам биохимии для студентов и преподавателей факультета «Биоинженерия и ветеринарная медицина» Донского государственного технического университета, а также других вузов медико-биологического профиля. Оно знакомит читателей с процессами жизнедеятельности организма, а также с некоторыми его нарушениями, которые приводят к возникновению болезней, и позволяет, оптимизировать знания в области биохимии, применяя их при изучении нормальной и патологической физиологии, фармакологии, клинической лабораторной диагностики.
Видео:Цикл Кребса. Биохимия.Скачать
ВВЕДЕНИЕ
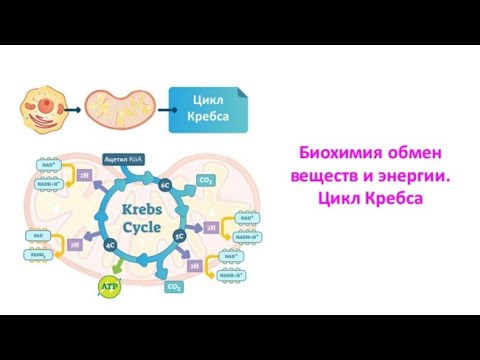
Автотрофные организмы используют энергию солнечного света для синтеза органических соединений, обладающих запасом внутренней энергии, из СО2 и H2O, то есть получают углерод из СО2. В свою очередь, гетеротрофные организмы используют энергию органических соединений, поступающих с пищей, то есть получают углерод из органических соединений. Основным способом преобразования этой энергии для нужд жизнедеятельности является биологическое окисление или тканевое дыхание. Под тканевым дыханием понимается катаболизм органических веществ клетками с участием O2 и выделением СО2 и H2O. Больше всех от обогащения атмосферы Земли кислородом во времена протерозоя выиграли альфа-протеобактерии.
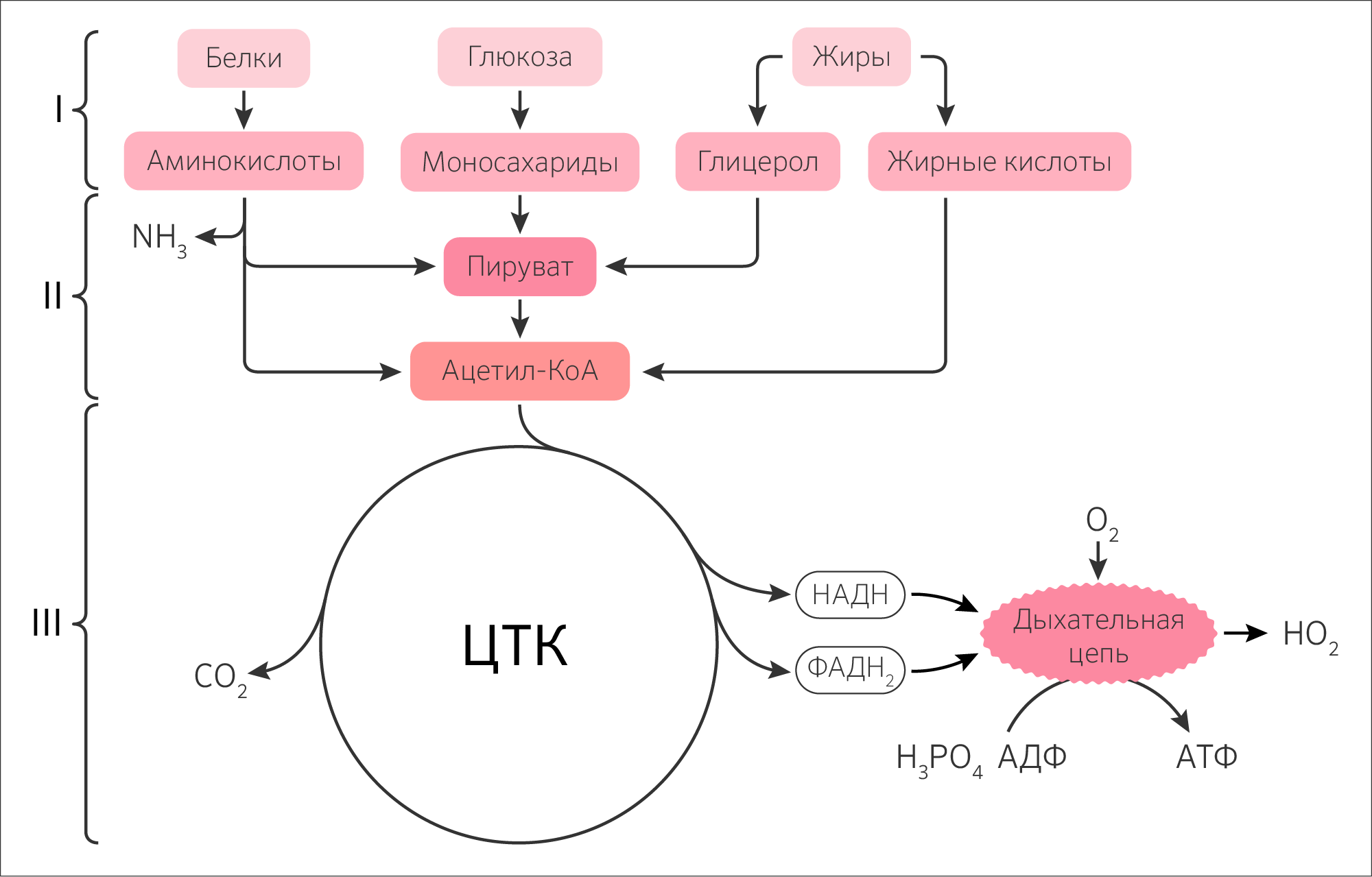
Концентрация O2 в различных клетках колеблется от 6 до 175 мкМ, и основная его часть, потребляемая эукариотами, восстанавливается в митохондриях до H2O. Любопытно, что кислород является сильным окислителем, но кинетически представляет собой довольно инертную молекулу, и способность к ее ферментативному восстановлению в клетке путем поочередного присоединения электронов имеют металлы переменной валентности (Fe 2+ /Fe 3+ , Cu + /Cu 2+ , Mn 2+ /Mn 3+ ), а также низкомолекулярные органические соединения (хиноны, флавины, которые являются кофакторами и коферментами соответственно). Общий путь катаболизма является эволюционно сложившимся метаболическим путём. Этот метаболический путь состоит из трех этапов:
- окислительное декарбоксилирование пировиноградной кислоты (пирувата) до ацетил-КоА;
- цикл трикарбоновых кислот (ЦТК) в митохондриях (хотя бывают исключения, например, ГАМК-шунт в нейронах, у растений);
- создание протонного градиента при помощи Цепи переноса электронов (ЦПЭ) или электрон-транспортной цепи.
Все три этапа связаны: конечный продукт одного является начальным субстратом следующего.
ЦТК — филогенетически старый метаболический путь, но не самый древний. Но большая часть организмов, в том числе прокариоты, имеют те или иные компоненты ЦТК. Вообще, синтез, взаимопревращение и разрушение промежуточных метаболитов (пируват, ацетил-КоА), а также все компоненты ЦТК считаются приобретением эукариот вследствие их симбиогенеза с прокариотами (альфа-протеобактериями). Последние в дальнейшем преобразовались в эукариотические органеллы — митохондрии [1]. Такая теория находит отклик в том, что ферменты ЦТК синтезируются с использованием не только митохондриальных генов, но и ядерных.
Примечательно, что ЦТК не имеет прямого отношения к аэробному дыханию (филогенетически более новому способу окисления по сравнению с анаэробным дыханием), но снижение концентрации О2 у аэробов подавляет его реакционную способность. Дело в том, что синтезированные в ходе ЦТК НАДH + Н + далее переносят гидрид-анионы на ЦПЭ и восстанавливают кислород, поступивший в процессе дыхания, до H2O. Образуемый потенциал между митохондриальным матриксом и межмембранным пространством превращается в энергию связей АТФ.
НАД (никотинамидадениндинуклеотид) является коферментом и активированным вариантом никотиновой кислоты (ниацин, витамин В3). Ферменты, обеспечивающие синтез НАД + из никотиновой кислоты, сконцентрированы в ядре клетки.
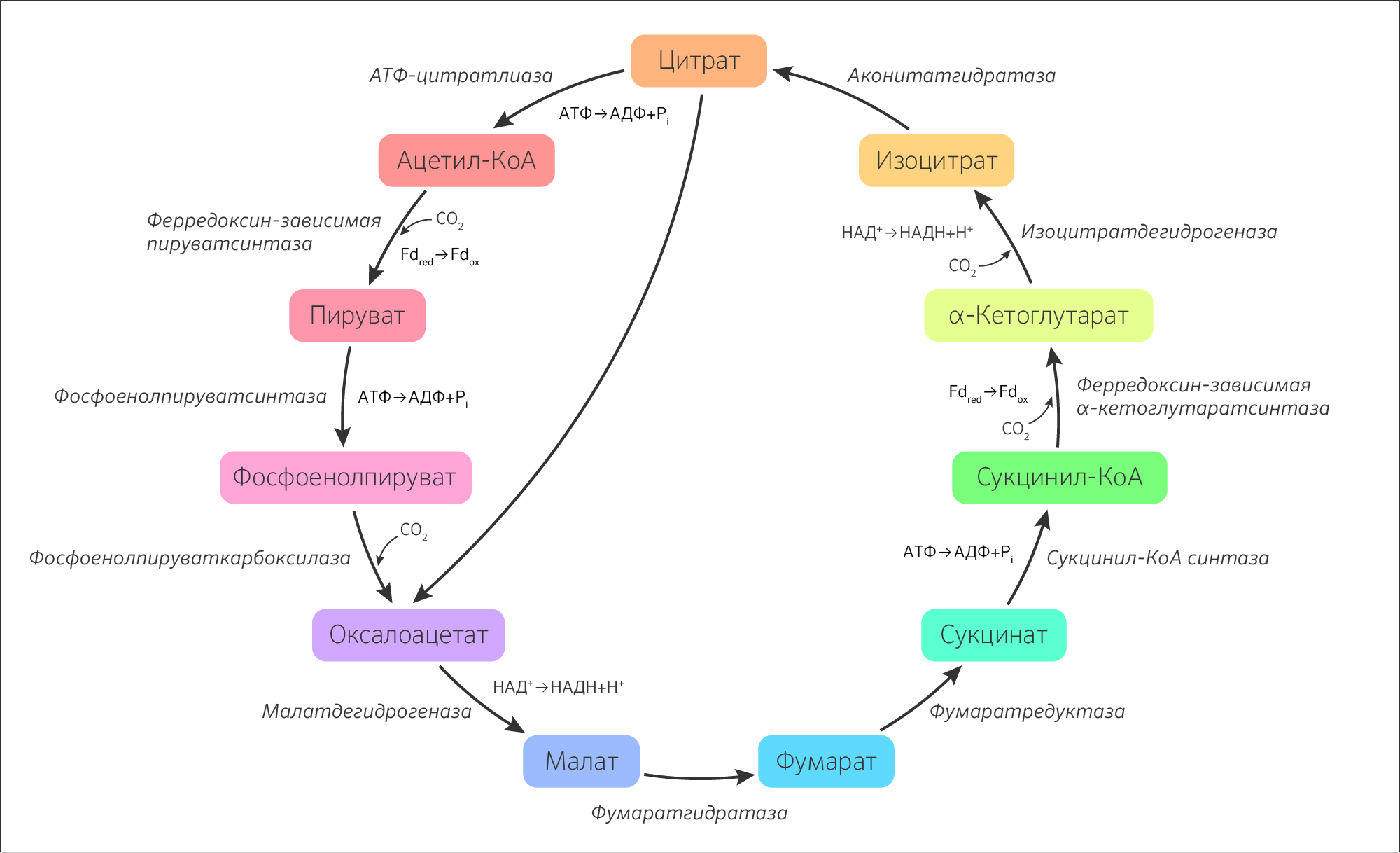
Преобразования веществ в ЦТК носят окислительный характер. На сегодняшний день исследовано множество анаэробных организмов, у которых есть набор метаболитов ЦТК, но вместо последовательного окисления субстраты подвергаются восстановлению [2]. Такой цикл получил название восстановительный цикл трикарбоновых кислот (ВЦТК) или цикл Арнона.
Таким образом, компоненты ЦТК (рисунок 2) и ВЦТК (рисунок 3) являются универсальной последовательностью для известных форм жизни [3].
Рисунок 2. Реакции цикла трикарбоновых кислот (цикл Кребса)
Рисунок 3. Восстановительный цикл трикарбоновых кислот (цикл Арнона)
Хемотрофы (водородобактерии, метанобактерии, железобактерии) — прокариоты и, пожалуй, одни из самых древних форм жизни, начало которым было положено в архей (отсюда и одноименное название домена — Archaea). Для них именно ВЦТК является началом путей биосинтеза органических веществ. Например, хемолитоавтотрофы рода Thiobacillus получают энергию в результате окислительно-восстановительных преобразований неорганических соединений и в процессе хемоассимиляции СO2. В настоящее время нет достоверных сведений о наличии ВЦТК у эукариот [4,5], поэтому для изучения метаболических путей взаимопревращения углеродсодержащих веществ логично рассмотрение не варианта ВЦТК, в котором имелся какой-то примитивный источник энергии, не представленный органическими веществами, а ЦТК как более позднего и нового приобретения эволюции.
Видео:Гладилин А. К. - Биохимия - Цикл трикарбоновых кислотСкачать

ИСТОРИЯ ОТКРЫТИЯ ЦТК
В 1930 году некоторые из компонентов ЦТК открыл Альберт Сент-Дьерди. В частности, он установил, что при добавке сукцината, фумарата и малата к измельченной мышечной ткани поглощается большее количество кислорода, чем требуется для окисления, тем самым придя к выводу, что кислоты являлись катализаторами, но сами не претерпевали изменений. Сент-Дьерди первый, кто непосредственно описал ЦТК и в 1937 году был удостоен Нобелевской премии по физиологии и медицине «За исследования биологического окисления и в особенности за открытие витамина С и катализа фумаровой кислотой» [6].
Однако полную последовательность реакций и образующихся соединений в 1937 году установил Ханс Адольф Кребс. В 1953 году он получил Нобелевскую премию «За открытие цикла лимонной кислоты» (разделил с Фрицем Альбертом Липманом, получившим премию «За открытие кофермента А и его значения для промежуточных стадий метаболизма») [7]. С тех пор ЦТК имеет авторское узнаваемое название — цикл Кребса.
Для чего нам эта историческая справка? Что ж, кто-то разбрасывает камни, а кто-то умело их собирает… Если рассматривать ее в контексте медицины, то эти прорывные, сложные и даже революционные открытия были сделаны не так уж и давно. Мы знаем мало. Мы в начале пути.
Видео:Цикл Кребса: 1-4 реакцииСкачать

ЦИКЛ КРЕБСА
Пусковым субстратом ЦТК является ацетил-КоА. Разберем, из чего он может синтезироваться.
Видео:Цикл КребсаСкачать
Углеводы
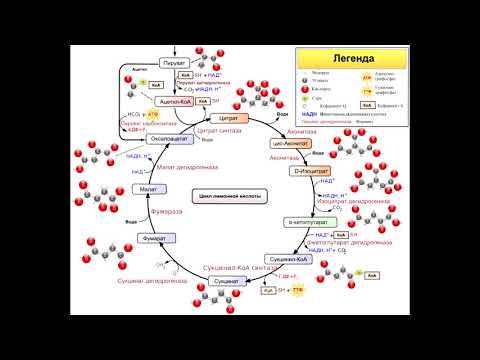
Возьмем всем известный моносахарид — глюкозу, — которая в организме человека может подвергаться гликолизу (рисунок 4). В результате гликолиза из одной молекулы глюкозы получается две молекулы пирувата. Суммарное уравнение гликолиза будет выглядеть так:
Глюкоза + 2НАД + + 2АДФ + 2Н3РО4 → 2Пирувата + 2НАДH + 2Н + + 2ATФ + 2Н2O
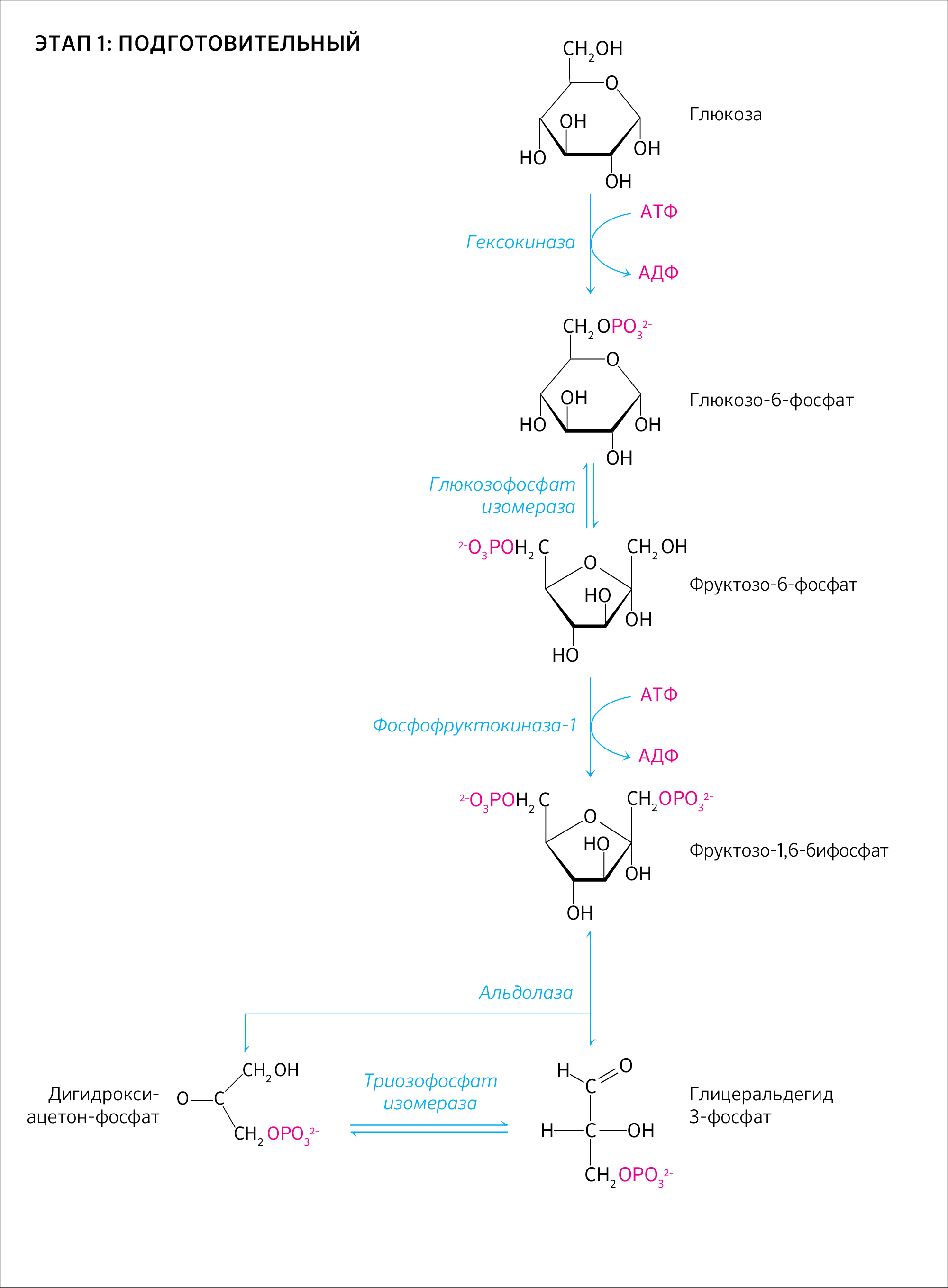
Реакции окисления глюкозы занимают 10–11 стадий, которые можно разделить на подготовительный этап — до образования 3-фосфоглицерата — и этап непосредственного синтеза АТФ. Ко всему прочему, суммарный выход АТФ при гликолизе составляет 2 молекулы при условии, что другие 2 молекулы расходуются на подготовительном этапе.
Стоит оговорить некоторые детали. Гликолиз — это не только окисление глюкозы. Другие углеводы тоже окисляются по этому пути, но только в том случае, когда они превращаются в его компоненты. Например, фруктоза при участии одной молекулы АТФ превращается в фруктоза-6-фосфат, и такое преобразование происходит в мышцах и почках. Гликолиз — это анаэробный процесс. Так, в эритроцитах он является единственным путем поддержания их биоэнергетики.
Синтез пирувата осуществляется в цитоплазме клеток в результате гликолиза, а процесс ЦТК идет в матриксе митохондрий. Следовательно, пирувату надо попасть из одного компартмента в другой. Проблема в том, что пируват является полярной молекулой и не может проникнуть через внутреннюю мембрану митохондрии, проницаемую только для О2, СО2 с помощью простой диффузии, в то время как внешняя мембрана проницаема для малых молекул и ионов за счёт поринов.
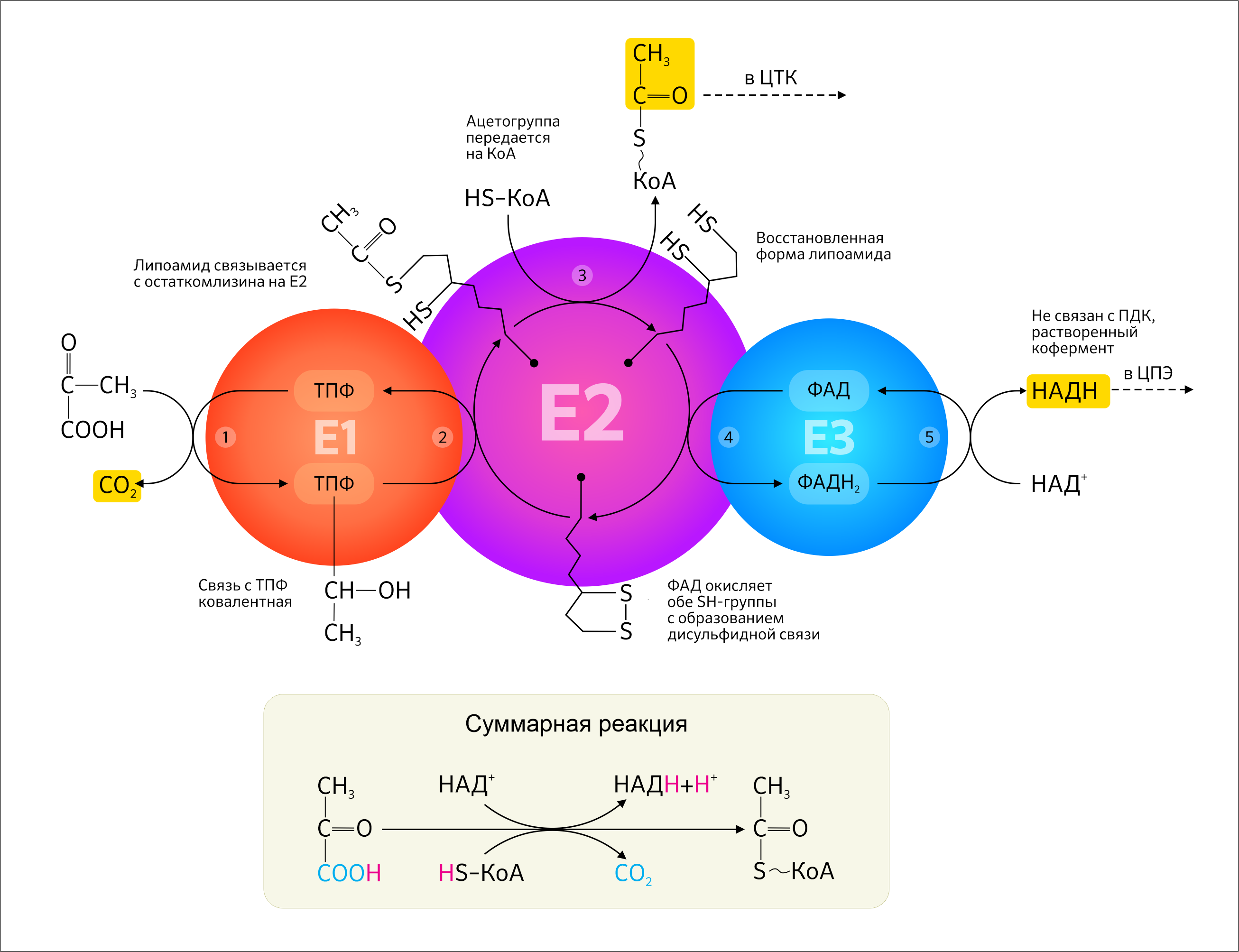
Транспорт пирувата в митохондриальный матрикс происходит при участии белка транспортера, который по последней классификации IUPAC (Международного союза теоретической и прикладной химии) и NC-IUBMB (Комитета по номенклатуре Международного союза биохимии и молекулярной биологии) относят к транслоказам с механизмом симпорта H + во внутренней мембране. Для участия в ЦТК необходима ацетильная группа пирувата — СН3–С=О, — однако этому мешает полярная карбоксильная группа, отщепить которую возможно путем окислительного декарбоксилирования с участием специального мультиферментного комплекса в митохондриальном матриксе — пируватдегидрогеназного комплекса. В итоге образуется необходимый ацетил-КоА, и реакция становится необратимой (рисунок 5).
Пируватдегидрогеназный комплекс включает в себя три типа ферментов в множестве копий, пять коферментов, два вспомогательных белка.
- пируватдегидрогеназа (Е1);
- дигидролипоилтрансацетилаза (Е2);
- дигидролипоилдегидрогеназа (Е3).
Среди компонентов этих коферментов есть четыре витамина и одно витаминоподобное вещество, которые человек получает преимущественно с пищей:
- тиамин (B1) для синтеза тиаминпирофосфата;
- рибофлавин (B2) для синтеза ФАД;
- пантотенат (B5) для синтеза КоА;
- ниацин (B3) для синтеза НАД;
- липоевая кислота (липоат).
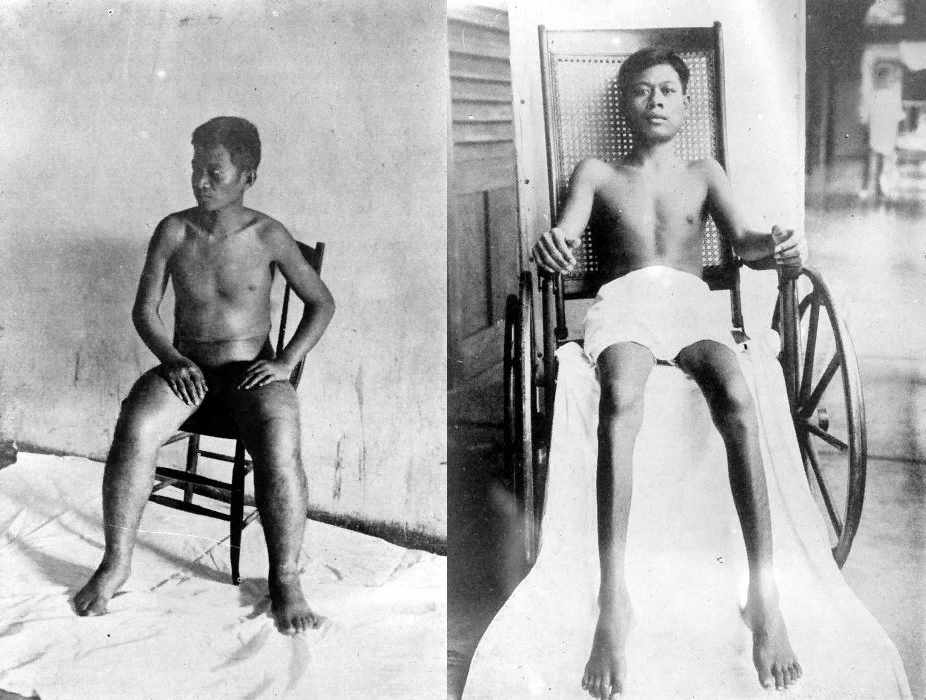
Кстати, далее, по ходу всех стадий, будет понятна роль витаминов в ЦТК. Стоит обратить внимание, что при алиментарной недостаточности компонента пируватдегидрогеназного комплекса тиамина (витамин В1) развивается болезнь бери-бери (рисунок 6), которая на сегодняшний день встречается редко и характерна для слаборазвитых стран.
Вспомогательные белки для протекания сопутствующих реакций фосфорилирования:
- протеинкиназа;
- фосфопротеинфосфосфатаза.
Видео:ЭНЕРГЕТИЧЕСКИЙ ОБМЕН 1. Цикл трикарбоновых кислот.Скачать

Липиды
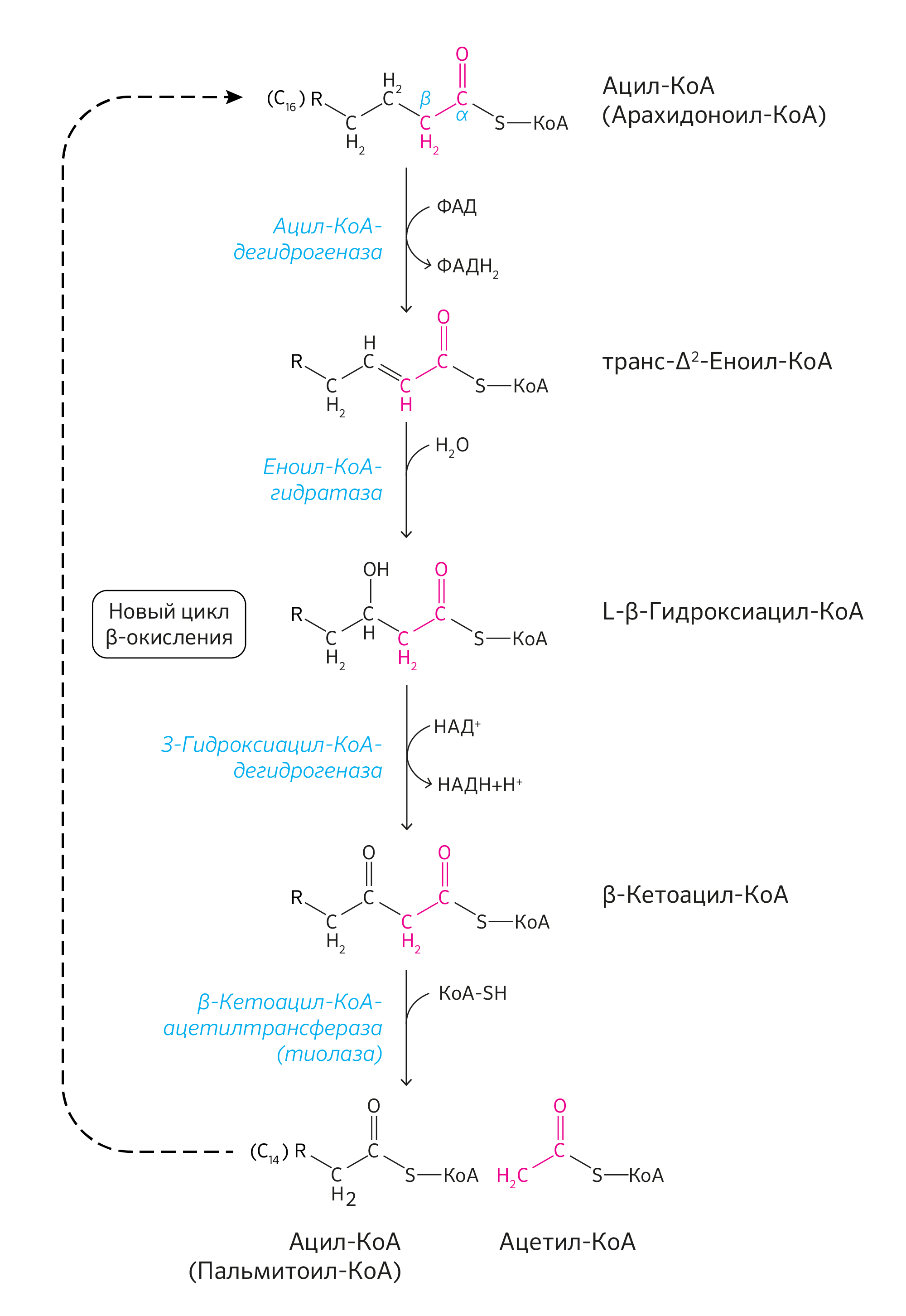
Вспомним липиды, которые распадаются до высших жирных кислот (ВЖК) и глицерола. ВЖК затем подвергаются процессу β-окисления до ацетил-КоА (рисунок 7). Глицерол в свою очередь является субстратом для глюконеогенеза в печени, и уже не сложно догадаться, что будет с вновь синтезированной глюкозой дальше.
Видео:Лекция. Общие пути катаболизма. Цикл трикарбоновых кислот.Скачать

Белки
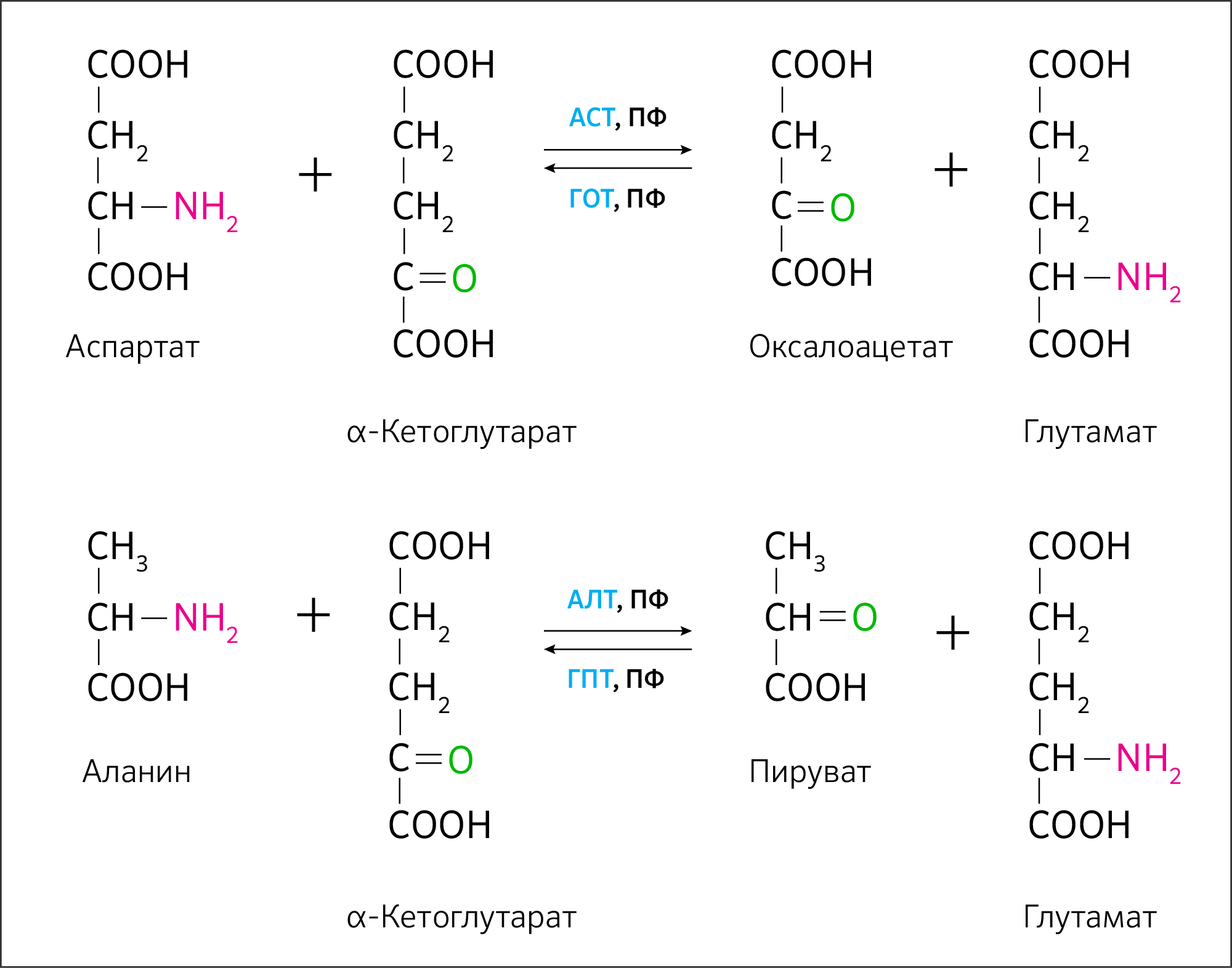
Они очевидно распадаются до аминокислот. И самое важное, что стоит отметить: аминокислоты невероятно пластичны. Путем реакций трансаминирования (ферментативные реакции переноса аминогруппы с аминокислот на кетокислоты) (рисунок 8) организм может получать не только глюкозу и пируват, но также субстраты ЦТК — α-кетоглутарат, оксалоацетат. Более того, такие аминокислоты, как серин, аланин, триптофан и другие могут превратиться в ацетил-КоА, минуя превращение до пирувата (рисунок 9).
Аланинаминотрансфераза локализована в цитоплазме клеток. Аспартатаминотрансфераза имеет как цитоплазматическую (cAST), так и митохондриальную (mAST) изоформы. Аминотрансферазы переносят аминогруппу аминокислот в состав глутамата. Затем глутамат с помощью транслоказ попадает из цитоплазмы в митохондрию, где активна аспартатаминотрансфераза. В результате глутамат снова превращается в α-кетоглутарат.
АСТ — аспартатаминотрансфераза, ПФ — кофермент пиридоксальфосфат (производный витамина В6), ГОТ — глутамат-оксалоацетатаминотрансфераза, АЛТ — аланинаминотрансфераза, ГПТ — глутамат-пируватаминотрансфераза
Рисунок 9. Аминокислоты как ресурс для синтеза компонентов цикла трикарбоновых кислот.
Видео:Цитология. Лекция 53. Цикл КребсаСкачать

Этанол
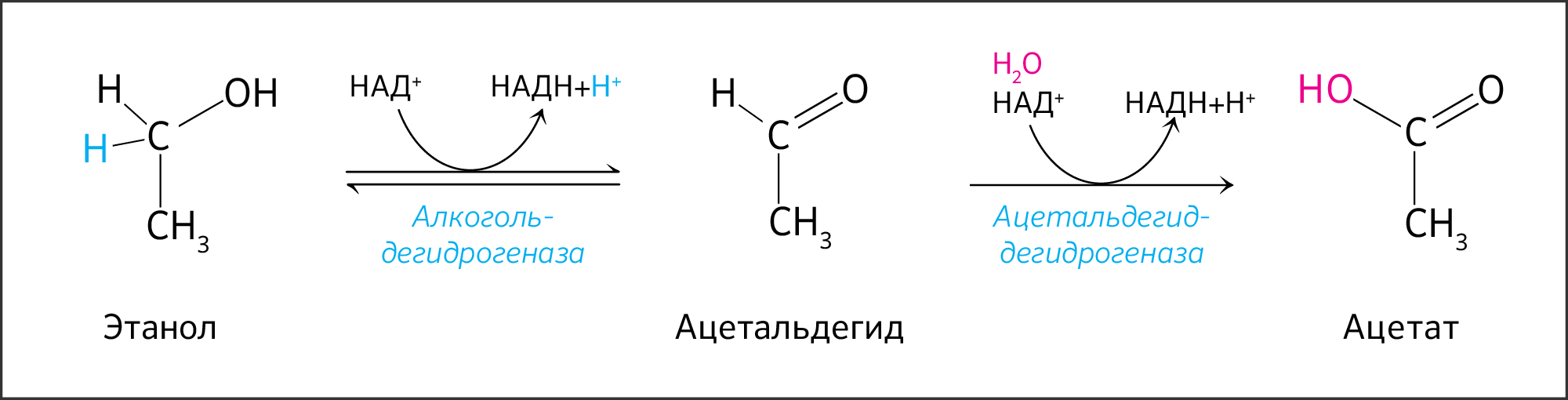
Алкогольдегидрогеназа печени окисляет этанол до ацетальдегида (рисунок 10). В ходе последующей реакции токсичный ацетальдегид в той же печени при участии альдегиддегидрогеназы окисляется до уксусной кислоты, которая претерпевает превращения с образованием ацетил-КоА.
Рисунок 10. Реакция превращения этанола в ацетат. Алкогольдегидрогеназа использует НАД + для осуществления реакции и в норме не локализуется в сыворотке крови человека.
Видео:цикл КребсаСкачать

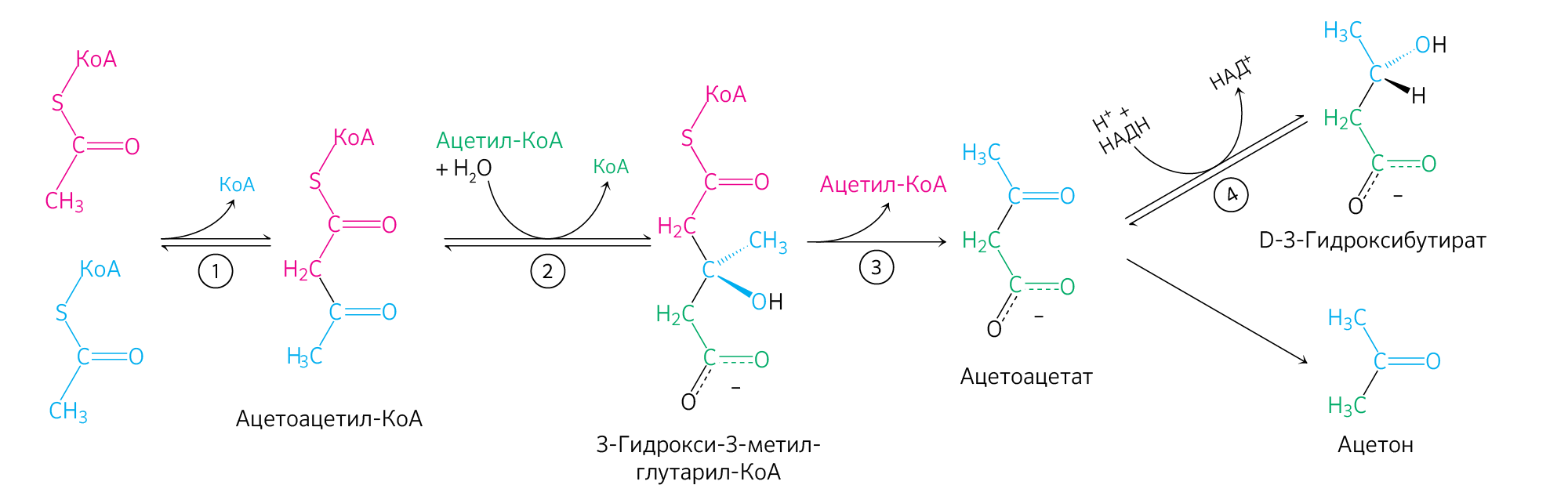
Кетоновые тела
Если для синтеза ацетоацетата (рисунок 11) в митохондриях гепатоцитов необходимо наличие двух молекул ацетил-КоА, пришедших в результате обильного поступления ВЖК в печень или при обезвреживании этанола, то его катаболизм клетками организма (рисунок 12) вновь приводит к образованию двух молекул ацетил-КоА, которые отправятся в ЦТК.
Рисунок 11. Анаболизм кетоновых тел.
Рисунок 12. Катаболизм кетоновых тел.
Выходит, что белки, жиры и углеводы являются источниками не только ацетил-КоА, который «закрутит колесо ЦТК», но и незаменимых для его стадий субстратов.
Большинство окислительных реакций ЦТК обратимы, но исключение составляют три стадии: превращение оксалоацетата в цитрат, окисление изоцитрата до α-кетоглутарата и окисление α-кетоглутарата до сукцинил-КоА.
Далее подробно остановимся на каждой из восьми стадий:
I стадия — образование цитрата;
II стадия — образование изоцитрата;
III стадия — окисление до α-кетоглутарата;
IV стадия — окисление до сукцинил-КоА;
V стадия — образование сукцината;
VI стадия — окисление до фумарата;
VII стадия — гидратация до малата;
VIII стадия — окисление до оксалоацетата.
Видео:Цикл Кребса за 2 минутыСкачать

СТАДИИ ЦТК
Видео:Биохимия. Лекция 51. Общие пути катаболизма. Энергообмен. Цикл Кребса.Скачать

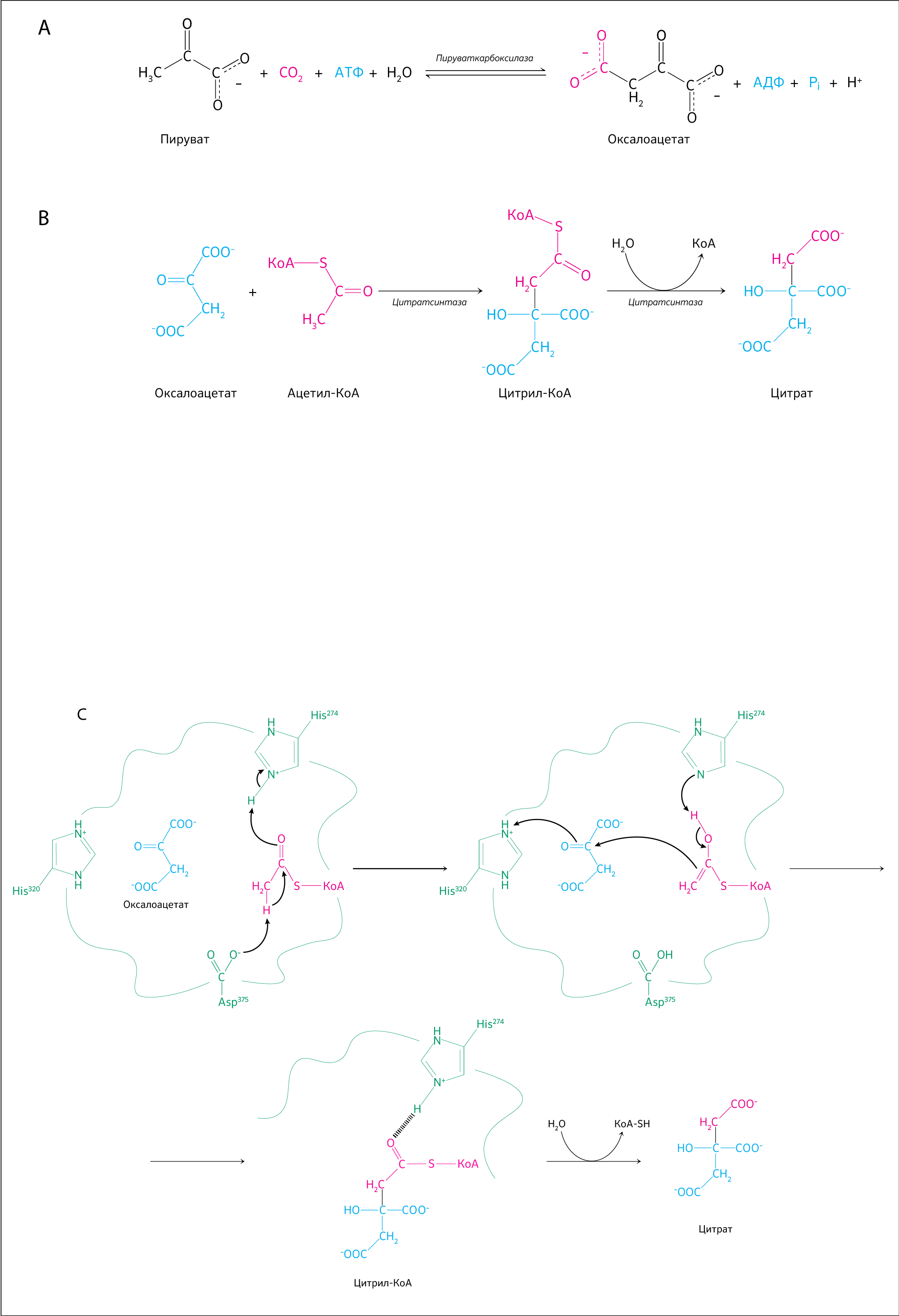
I стадия — образование цитрата
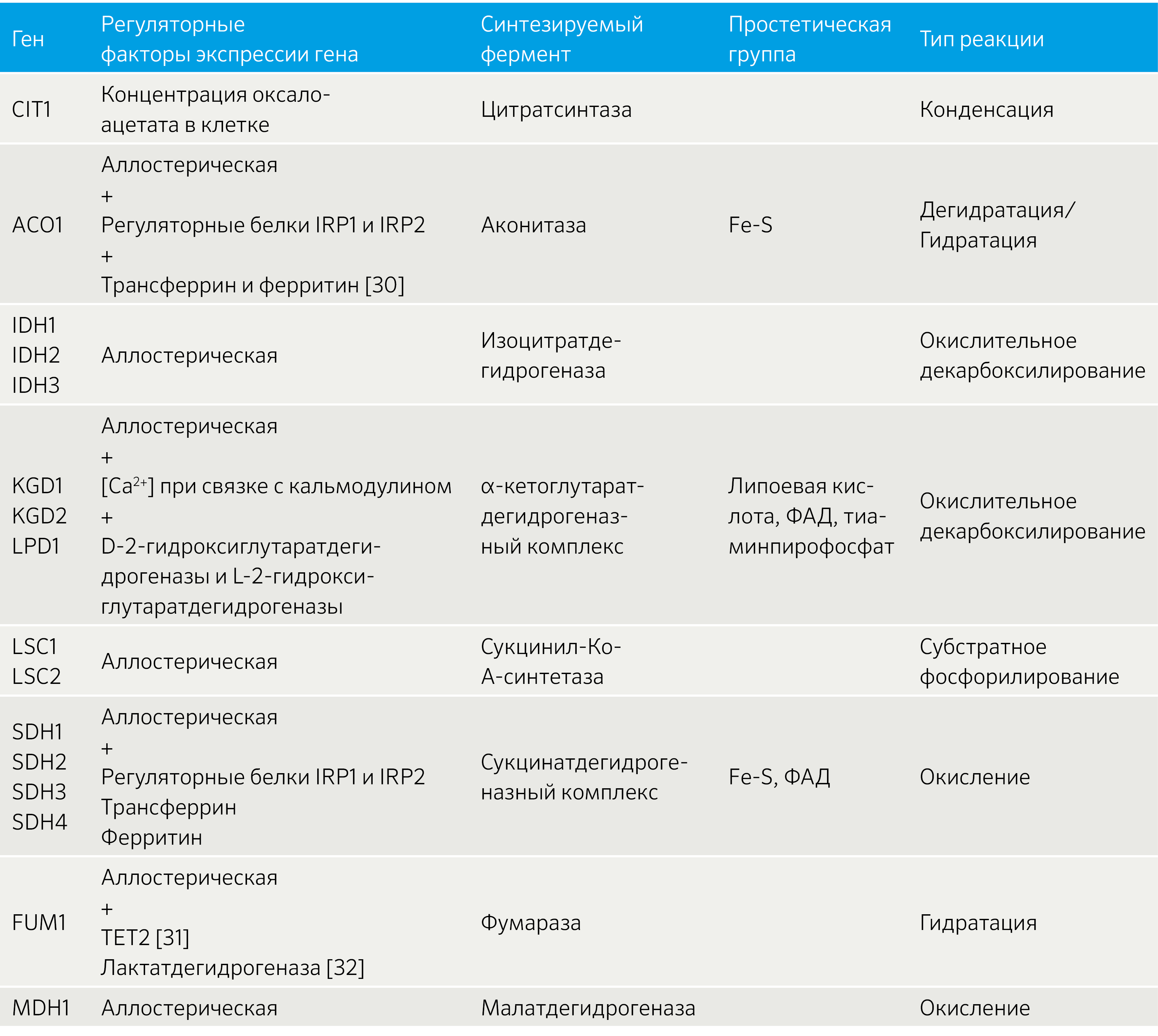
Оксалоацетат (щавелевоуксусная кислота) соединяется с ацетил-КоА в присутствии фермента цитратсинтазы (рисунок 13). Биотин является необходимым компонентом в реакции карбоксилирования пирувата с участием АТФ, в результате чего образуется сам оксалоацетат в присутствии пируваткарбоксилазы, коферментом которой является биотин. Так получается трикарбоновый цитрат — лимонная кислота, поэтому ЦТК иногда называют циклом лимонной кислоты.
Ацетил-КоА имеет карбонильный (С=О) участок, превращающийся в гидроксильный (С–ОН) благодаря цитратсинтазе (кодируется ядерным геном CIT1). Промежуточный продукт — цитроил-КоА, образующийся в активном центре фермента, — гидролизуется до свободного КоА и цитрата.
Эта стадия ЦТК является одной из немногих необратимых реакций, поэтому уровень экспрессии CIT1 оказывает влияние на остальные стадии цикла.
Видео:Песенка про цикл Кребса или как ещё учить биохимию?Скачать

II стадия — образование изоцитрата через цис-аконитат
Из цитрата необходимо получить его изомер в присутствии фермента аконитазы (аконитатгидратазы), которая будет проводить дегидратацию цитрата и следом гидратацию полученного промежуточного соединения (трикарбоновой кислоты цис-аконитата) для получения изоцитрата, т. е. является одновременно и изомеразой, и гидратазой (рисунок 14).
Аконитаза (лат. aconítum — борец, была открыта в растении Aconítum napéllus) — название данного соединения по международной номенклатуре — аконитатгидратаза. Фермент имеет митохондриальную и цитоплазматическую изоформы, кодируемые ядерными генами ACO1 на p-плече 9 хромосомы и ACO2 на q-плече 22 хромосомы соответственно. Митохондриальная изоформа фермента катализирует превращение цитрата в изоцитрат с использованием НАД + (нарушение гена ACO1 приводит к неспособности провести эту стадию ЦТК [8]), а цитоплазматическая катализирует превращение цитрата в изоцитрат с использованием НАДФ, которая образует НАДФН, участвующий в синтезе ВЖК и стероидов.
Видео:Цикл Кребса: подводим итоги. Анаболическая роль ЦТК.Скачать

III стадия — окисление изоцитрата до α-кетоглутарата
Начиная с этой стадии цикл перестает быть трикарбоновым с точки зрения химических структур последующих субстратов. Здесь фермент изоцитратдегидрогеназа катализирует окислительное декарбоксилирование изоцитрата с образованием α-кетоглутарата (оксоглутарата) и СО2. Реакция проходит через промежуточное соединение — оксалосукцинат — и является необратимой.
Кроме декарбоксилирования в этой реакции происходит восстановление кофермента HAД + до НАДH+H + (НАДФН) (рисунок 15).
Изоцитратдегидрогеназа является октамером, состоящим из четырех субъединиц Idh1p и четырех субъединиц Idh2p, кодируемых генами второй хромосомы IDH1 (внемитохондриальный) и IDH2 (внутримитохондриальный) соответственно. Гены IDH1 и IDH2 транскрибируются независимо друг от друга, при этом изменение экспрессии любого из них не влияет на транскрипцию другого, но гетерозиготные мутации в любом из генов изоцитратдегидрогеназы приводят к снижению активности фермента с сохранением функции [9].
Кроме того, есть структурно не связанный с IDH1 и IDH2 ядерный ген IDH3, который является интегральным для ЦТК и имеет три изоформы: IDH3A, IDH3B, IDH3G. Суть в том, что IDH1 и IDH2 полагаются на кофермент НАДФ как на акцептор получаемых в ходе окислительного декарбоксилирования электронов, а IDH3 связан именно с НАД + . Поэтому изоцитратдегидрогеназа принадлежит трем отдельным изоформам, одна из которых связана с НАД+, а две другие с НАДФ, но функционально они одинаковы.
Более того, эта стадия является скорость-лимитирующей для всего ЦТК. Окисление изоцитрата до α-кетоглутарата происходит медленно по той простой причине, что IDH3 аллостерически ингибируется образующимся НАДH+H + , α-кетоглутаратом и АТФ, а активируется НАД + , изоцитратом и АДФ.
Видео:Цикл Кребса: вводнаяСкачать

IV стадия — окисление α-кетоглутарата до сукцинил-КоА
Далее происходит такое же окислительное декарбоксилирование как и с пируватом. Теперь α-кетоглутарат необратимо превращается в сукцинил-КоА и СО2 (рисунок 16). А значит и выполнять окислительное декарбоксилирование будет достаточно похожий фермент — α-кетоглутаратдегидрогеназный комплекс. Он близок к пируватдегидрогеназному комплексу по структуре, функциям и также включает три типа ферментов: КЕ1/КЕ2/КЕ3, каждый из которых кодируется отдельным ядерным геном KGD1, KGD2 и LPD1 соответственно [10].
В результате реакции у α-кетоглутарата отщепляется группа –СООН в α-положении. Отщепление кислотного остатка в результате даст CO2 и гидрид-анион. Бывшему α-кетоглутарату к С=О присоединяется свободная теперь группа –SКоА и получается сукцинил-КоА.
V стадия — превращение сукцинил-КоА в сукцинат
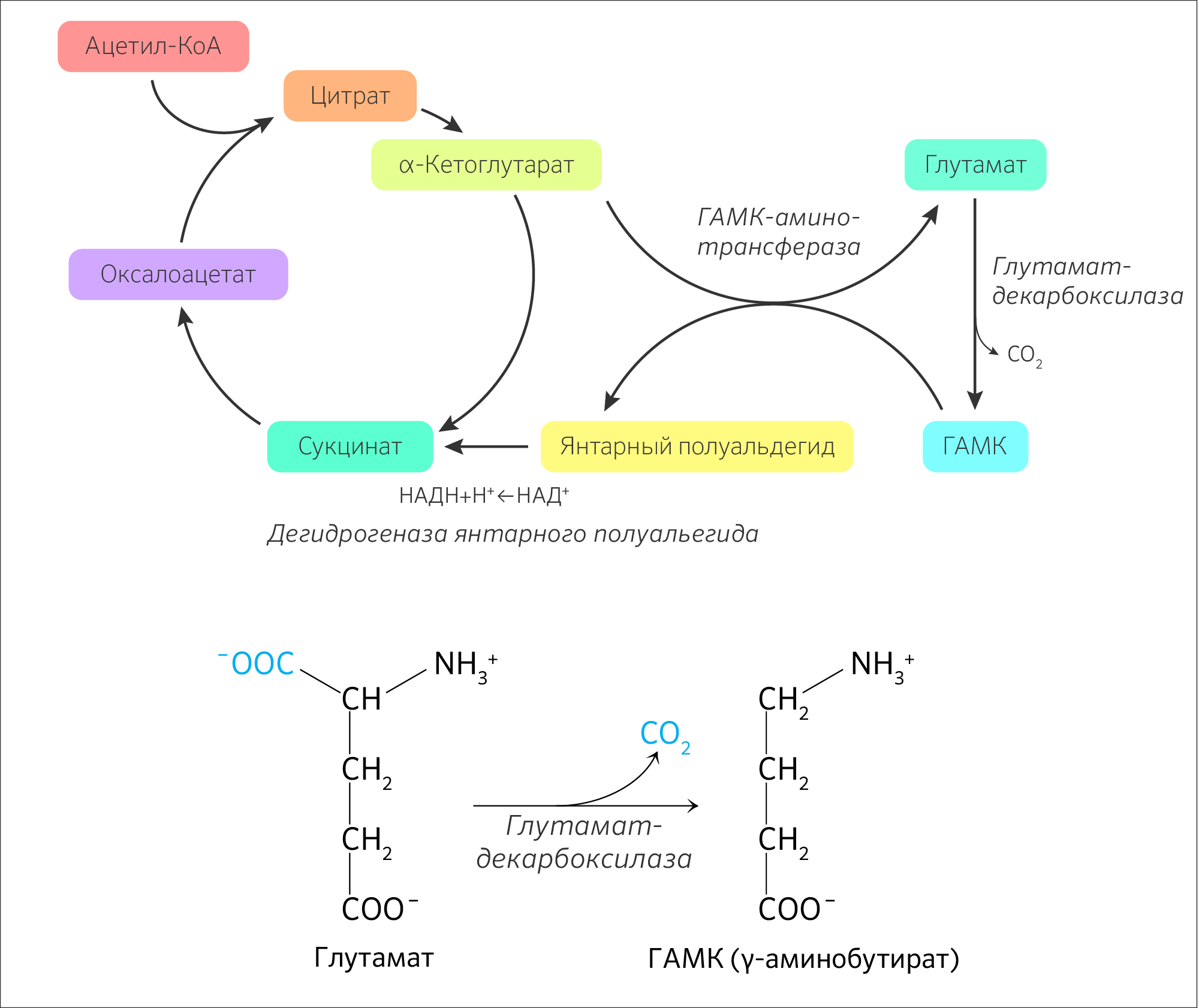
Сукцинил-КоА является соединением, которое может формировать новый порядок реакций. Доказательством тому является возможность альтернативного хода ЦТК под названием ГАМК-шунт (рисунок 17) в нейронах и астроцитах центральной нервной системы, где IV стадия заканчивается превращением не в сукцинил-КоА, а в глутамат, который декарбоксилируется в ГАМК (тормозный нейромедиатор). Затем ГАМК метаболизируется сначала до сукцинилового полуальдегида, а потом до сукцината — продукта V стадии.
Образование сукцината происходит при участии фермента сукцинил-КоА-синтетазы (используется лигаза, т. к. катализируется образование новых связей между индивидуальными молекулами с использованием энергии макроэргических соединений) (рисунок 18).
Сукцинил-КоА-синтетаза функционирует в виде гетеродимера и состоит из субъединиц α и β, необходимых для его каталитической активности и кодируемые генами LSC1 и LSC2 соответственно [11]. Он отщепляет –SКоА, H + для его связки будет взят у H3PO4, а оставшаяся фосфорная группа H2PO4 — присоединится к ГДФ или АДФ с образованием ГТФ или АТФ. Образование ГТФ у животных или АТФ у растений за счет энергии, запасенной при окислительном декарбоксилировании α-кетоглутарата до сукцинил-КоА с его тиоэфирной группой, является реакцией субстратного фосфорилирования, как и синтез ATФ при гликолизе (таблица 1).
VI стадия — окисление сукцината до фумарата
Сукцинат (янтарная кислота) окисляется до фумарата под действием оксидоредуктазы — сукцинатдегидрогеназы (у эукариот это митохондриальный хромопротеин и единственный фермент ЦТК, который закреплен во внутренней мембране митохондрий). Активный центр фермента образуют субъединицы, содержащие флавин и железо-серные группы, кодируемые генами SDH1 и SHD2 соответственно [12,13]. Закрепление фермента в мембране митохондрии осуществляется с помощью двух гидрофобных субъединиц, кодируемых генами SDH3 и SDH4 [14,15]. Для сборки функционального комплекса необходим шаперон семейства Hsp60-Tcm62p [16].
В этой реакции от сукцината отщепляется гидрид-анион, но коферментом будет являться не НАД + или НАДФ, как в предыдущих реакциях, а флавинадениндинуклеотид (ФАД) (образуется из рибофлавина, витамина B2), т. к. этот кофермент является ковалентно связанной простетической группой сукцинатдегидрогеназы. В итоге в исходном соединении просто создается ковалентная связь.
Изучая эту стадию подробно, непременно столкнешься с понятием об убихиноне (кофермент Q) (рисунок 19). Этот компонент ЦПЭ принимает участие в окислительном фосфорилировании как компонент митохондриального ферментного комплекса (МФК). Всего же на сегодня изучено четыре МФК (1 — НАДН-дегидрогеназный комплекс, 2 — сукцинатдегидрогеназа, 3 — убихинон-цитохром С-оксидоредуктаза, 4 — цитохромоксидаза). Функционирование МФК 1 и 3 приводит к генерации активных форм кислорода (АФК).
Таким образом, сукцинатдегидрогеназа является одновременно ферментом этой стадии и обязательным компонентом ЦПЭ. Какова ее функция в ЦПЭ? Дело в том, что НАДH+H + переносится гидрид-анион, который будет отдаваться МФК 1, а потом МФК 3 и 4, создавая необходимый пул электронов. К слову, вновь о роли аминокислот в организме человека: убихинон синтезируется из аминокислот тирозина, фенилаланина и мевалоновой кислоты (субстратом для синтеза мевалоновой кислоты служит ацетил-КоА).
VII стадия — гидратация фумарата до малата
Полученная ковалентная связь между атомами углерода фумарата будет подвергаться гидратации до малата (L-малата, яблочной кислоты) при действии гомотетрамерного фермента фумаратгидратазы или фумаразы (рисунок 20). Фумараза стереоспецифична к транс-изомерам, а не цис-изомерам.
Рисунок 20. Реакция превращения фумарата в малат.
В отличие от других ферментов цикла, имеющих митохондриальную и цитоплазматическую изоформы, которые кодируются отдельными генами, обе изоформы фумаразы закодированы в одном и том же ядерном гене — FUM1 — и транслируются с одного и того же транскрипта [17] путем альтернативного сплайсинга. Фумараза принадлежит ферментам двух классов. Первый класс обнаружен у прокариот, и это термолабильный железозависимый фермент. Второй класс обнаружен у млекопитающих, дрожжей и коринебактерий, где он уже является термостабильным железонезависимым ферментом [18,19].
VIII стадия — окисление малата до оксалоацетата
Последняя стадия ЦТК (рисунок 21).
Реакция сопровождается действием уже привычной НАД-зависимой дегидрогеназы — L-малатдегидрогеназы. Митохондриальная малатдегидрогеназа эукариот функционирует в виде гомодимера, субъединицы которого закодированы в митохондриальном гене MDH2 [20].
Концентрация оксалоацетата в митохондриях мала (около 10 -6 М). Реакция превращения малата в оксалоацетат при стандартных условиях характеризуется положительной энергией Гиббса (ΔG’° +29,7), что направляет ее в обратном направлении, но благодаря малой концентрации оксалоацетата реакция осуществляется около равновесия (ΔG 0).
ЭНЕРГЕТИЧЕСКАЯ РОЛЬ ЦТК
Освобождающаяся в результате окисления одной молекулы ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. В ходе ЦТК синтезируется также одна молекула ГТФ (субстратное фосфорилирование), что эквивалентно одной молекуле АТФ при действии фермента нуклеозиддифосфаткиназы. Полученные НАДH+H + понесут гидрид-анионы для работы АТФ-синтазы путем их передачи через 1, 3 и 4 МФК на внутренней мембране митохондрий (кристы).
При этом на 1 НАДH+H + будет приходится 3 АТФ, а на 1 ФАДН2 придется только 2 АТФ из-за передачи электронов на МФК 1, 3 и 4 ЦПЭ с меньшей энергией, чем у НАД + . Вследствие этого электроны от ФАД-зависимых дегидрогеназ поступают в ЦПЭ на МФК 2, минуя первый пункт сопряжения — НАДН-дегидрогеназный комплекс.
Энергетический выход одного ЦТК на основании энергии Гиббса:
— 3 НАДH+H + = 9 АТФ
— 1 ФАДН2 = 2 АТФ
— 1 ГТФ = 1 АТФ
Итого: получаем 12 АТФ из одного ацетил-КоА. Так как основным источником энергии являются углеводы, то не стоит забывать, что при гликолизе мы из одной молекулы глюкозы получаем две молекулы пирувата, поэтому смело удваиваем значение АТФ до 24 и прибавляем 2 НАДH+H + и 2 АТФ, полученных при гликолизе, а также 2 НАДH+H + , полученных в ходе реакций окислительного декарбоксилирования пирувата. В идеально работающей системе при расщеплении в тканях одной молекулы глюкозы получается 38 АТФ согласно уравнению:
Однако глицеролфосфатная челночная система переноса НАДH+H + в матрикс митохондрий из цитоплазмы идёт в конечном счёте с потерей АТФ. Данный механизм будет рассмотрен ниже, но в таком случае при расщеплении одной молекулы глюкозы будет получаться около 25 АТФ.
В энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробное дыхание.
Таблица 1. Образование макроэргических фосфатных связей в ходе гликолиза, ЦТК и аэробного дыхания.
Из вышесказанного следует, что основная роль ЦТК заключается в поставке 4 гидрид-анионов (или 8 электронов — 6 на НАДH и 2 на ФАДH2) в ЦПЭ. Кроме того, в самом цикле образуется одна молекула ГТФ.
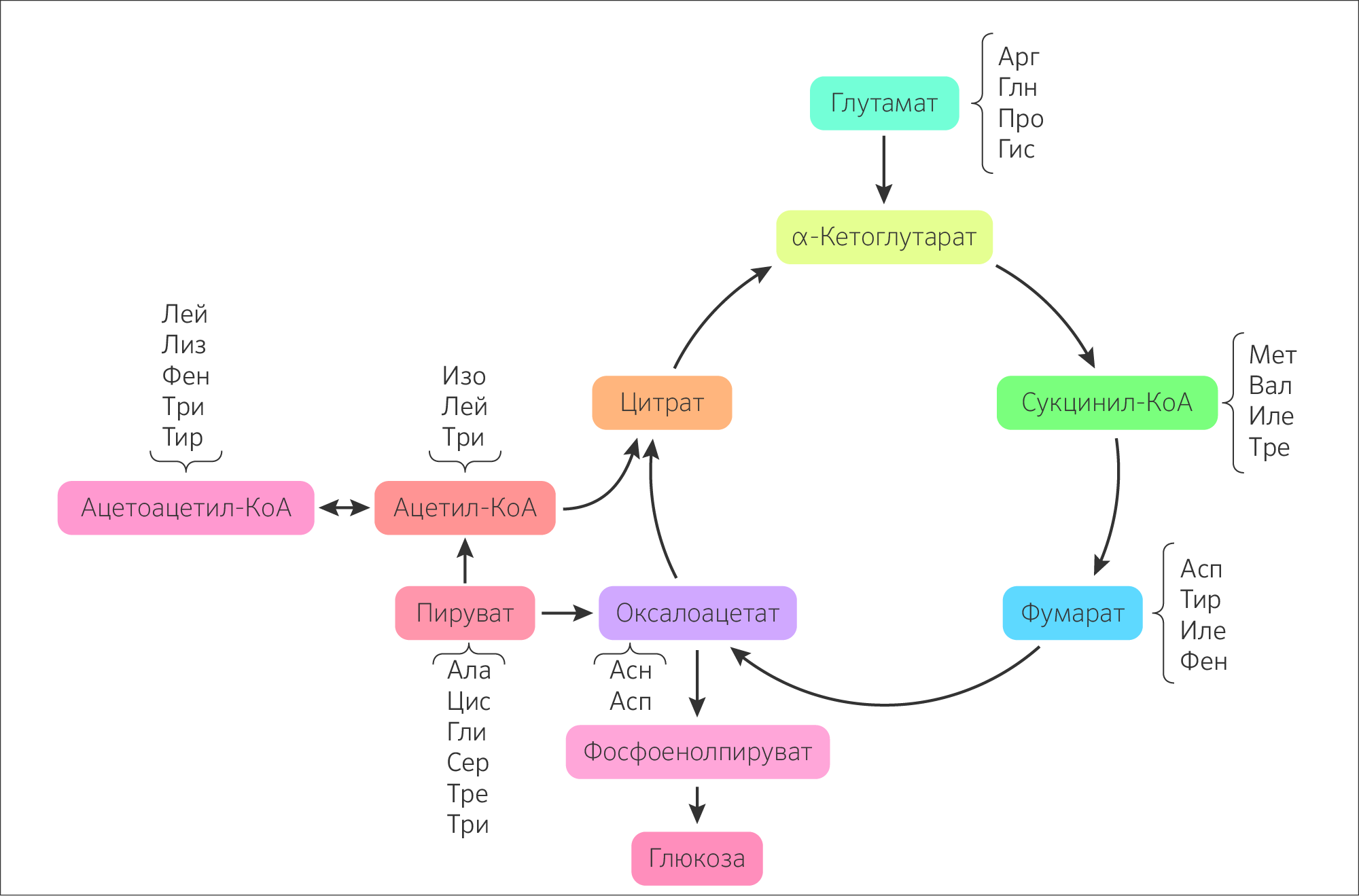
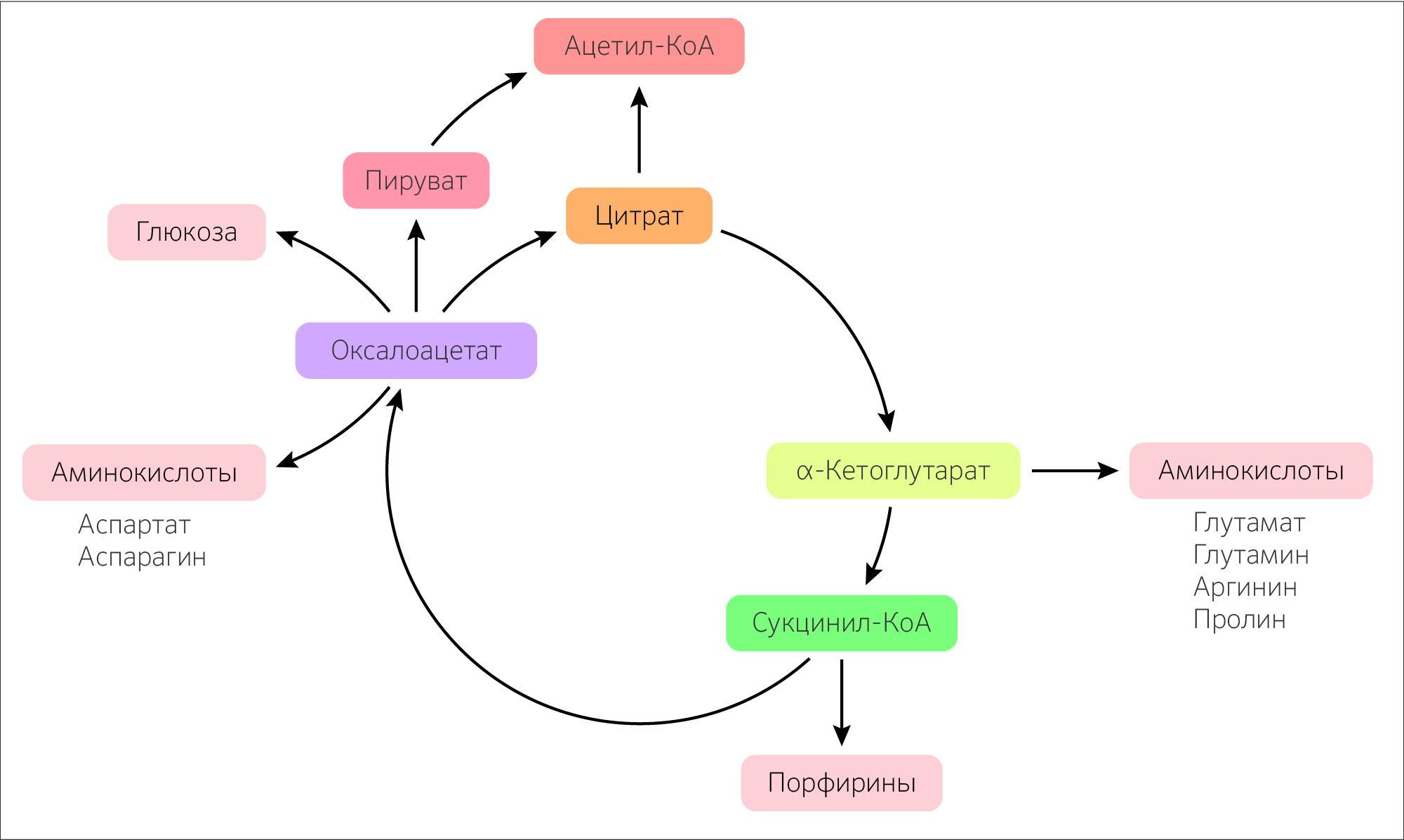
РОЛЬ ЦТК В МЕТАБОЛИЗМЕ
ЦТК играет важную роль в процессе анаболизма (рисунок 22): из α-кетоглутарата синтезируется глутамат, а из него глутамин, аргинин, пролин, в свою очередь, из оксалоацетата синтезируется аспартат, который при реакции аминирования образует аспарагин. Сукцинил-КоА как предшественник δ-аминолевулиновой кислоты при его конденсации с глицином будет участвовать в синтезе порфиринов у животных или хлорофилла у растений. Из оксалоацетата в процессе глюконеогенеза будет получена глюкоза.
Рисунок 22. Значение цикла трикарбоновых кислот в анаболизме.
В процессе катаболизма (рисунок 23) на I этапе крупные молекулы (полимеры) расщепляются до простых компонентов (мономеров): углеводы превращаются в глюкозу, жиры в ВЖК и глицерол, белки в аминокислоты. На II этапе полученные мономеры внутриклеточно специфически расщепляются до одного и того же метаболита — пирувата. Далее пируват (а также некоторые аминокислоты в процессе дезаминирования и ВЖК в процессе β-окисления) окисляется до ацетил-КоА. III этап представляет собой ЦТК и ЦПЭ (общий путь катаболизма), где образованный ацетил-КоА окончательно распадается до CO2 в митохондриях клетки. То есть 2 атома углерода в составе ацетил-КоА входят в ЦТК (I стадия) и 2 атома углерода в составе CO2 покидают его (III и IV стадии).
Также некоторые аминокислоты могут превращаться в субстраты стадий ЦТК: аргинин, гистидин и глутамат в α-кетоглутарат, а фенилаланин и тирозин в фумарат.
Рисунок 23. Значение цикла трикарбоновых кислот в катаболизме.
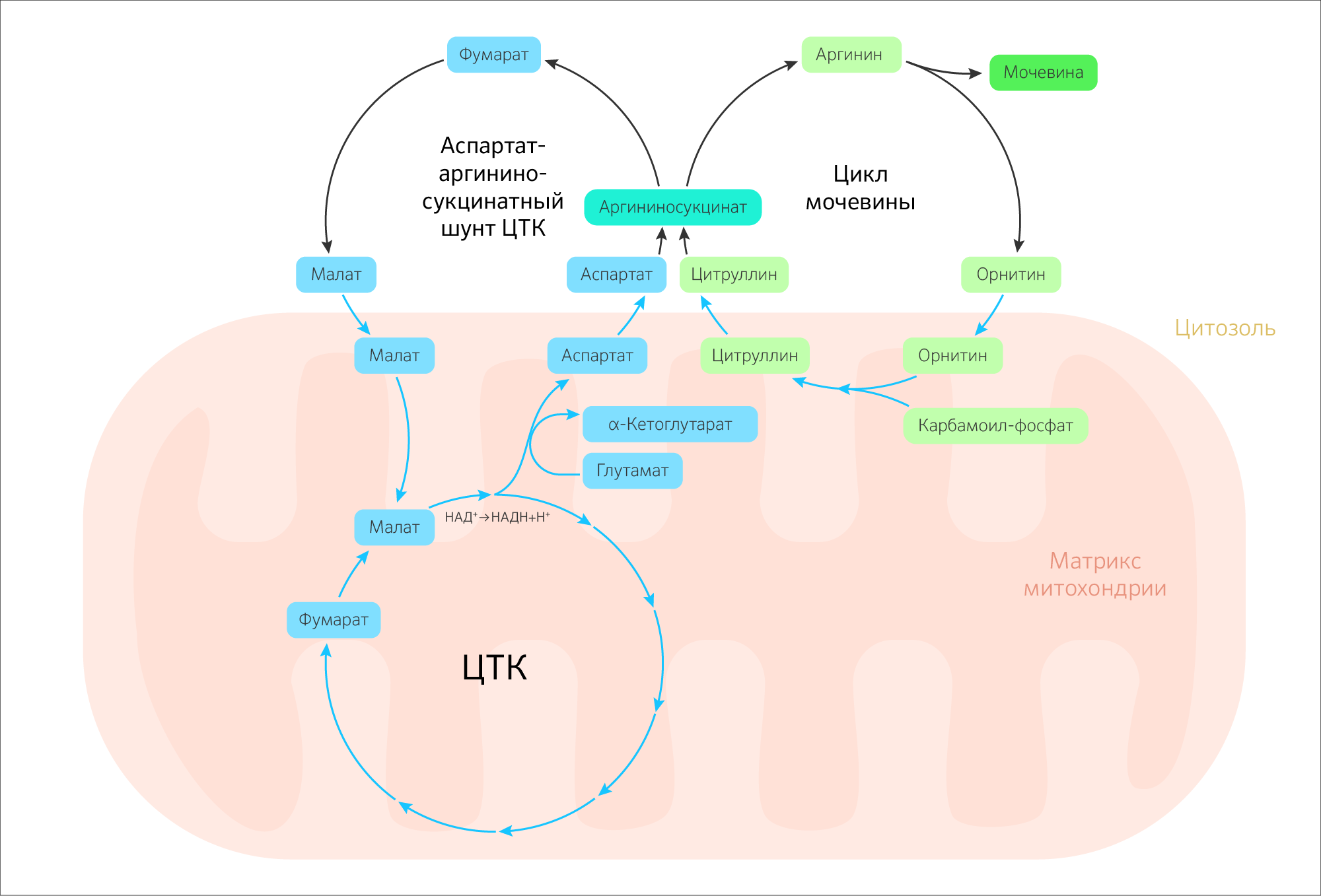
Существует связь между ЦТК и циклом мочевины. Такое пересечение названо «бициклом Кребса» (рисунок 24). Непосредственный путь, связывающий ЦТК и цикл мочевины, называется аспартат-аргининосукцинатный шунт: в нем утилизируются аминогруппы. Фумарат, образующийся в аргининосукцинатной реакции в межмембранном пространстве, является субстратом ЦТК. При этом фумарат либо в цикле мочевины, либо при синтезе пуринов может быть превращен в малат, который будет транспортирован в матрикс через малат-аспартатный переносчик для участия в ЦТК (рисунок 25).
Рисунок 24. Схема взаимодействия цикла трикарбоновых кислот и цикла мочевины (цикл Кребса-Гензелейта).
Ключевым путём транспорта НАДH+H + из цитоплазмы через внутреннюю мембрану митохондрии в матрикс являются митохондриальные челноки: малат-аспартатная и глицеролфосфатная челночные системы.
Малат-аспартатная челночная система осуществляет перенос НАДH+H + из межмембранного пространства в митохондриальный матрикс и действует в митохондриях печени, почек и сердца. НАДH+H + передает гидрид-анион на оксалоацетат, и образуется малат, который переносится через внутреннюю мембрану митохондрии малат-α-кетоглутаратной транспортной системой. В ЦТК малат превращается в оксалоацетат при действии митохондриальной малатдегидрогеназы. Оксалоацетат сам по себе не может вернуться обратно в межмембранное пространство, но может подвергаться действию трансаминазы и превращаться в аспартат, который переносится в межмембранное пространство глутамат-аспартатной транспортной системой. Там аспартат снова переходит в оксалоацетат, который вновь запускает челночную систему.
Рисунок 25. Схема малат-аспартатной челночной системы
Помимо малат-аспартатной челночной системы в митохондриях работает глицеролфосфатная челночная система (рисунок 26), которая переносит НАДH+H + из цитоплазмы внутрь митохондрии благодаря ферменту глицерол-3-фосфат-дегидрогеназа. Глицерол-3-фосфат-дегидрогеназа имеет две изоформы — цитоплазматическую и митохондриальную, кодируемые генами GPD1 и GPD2 соответственно. Ключевая разница между двумя изоформами в использовании разных коферментов: у цитоплазматической — НАД + , а у митохондриальной — ФАД.
Цитоплазматическая глицерол-3-фосфат-дегидрогеназа полностью находится в цитоплазме и не проникает в мембрану митохондрии. Митохондриальная глицерол-3-фосфат-дегидрогеназа располагается на внешней стороне внутренней мембраны митохондрии и именно она окисляет глицерол-3-фосфат до ФАДH2, а образующиеся в ходе такой окислительно-восстановительной реакции H + далее переходят на убихинон ЦПЭ. В результате работы глицеролфосфатной челночной системы на 1 НАДH+H + будет приходиться только 1,5 АТФ.
Следовательно, ЦТК — это амфиболический цикл. С одной стороны, присутствуют выраженные катаболические процессы, но вместе с тем промежуточные продукты ЦТК начинают новые биосинтетические пути, которые приводят к снижению их концентрации. Такое истощение пула промежуточных продуктов должно пополняться путем анаплеротических реакций.
РЕГУЛЯЦИЯ ЦТК
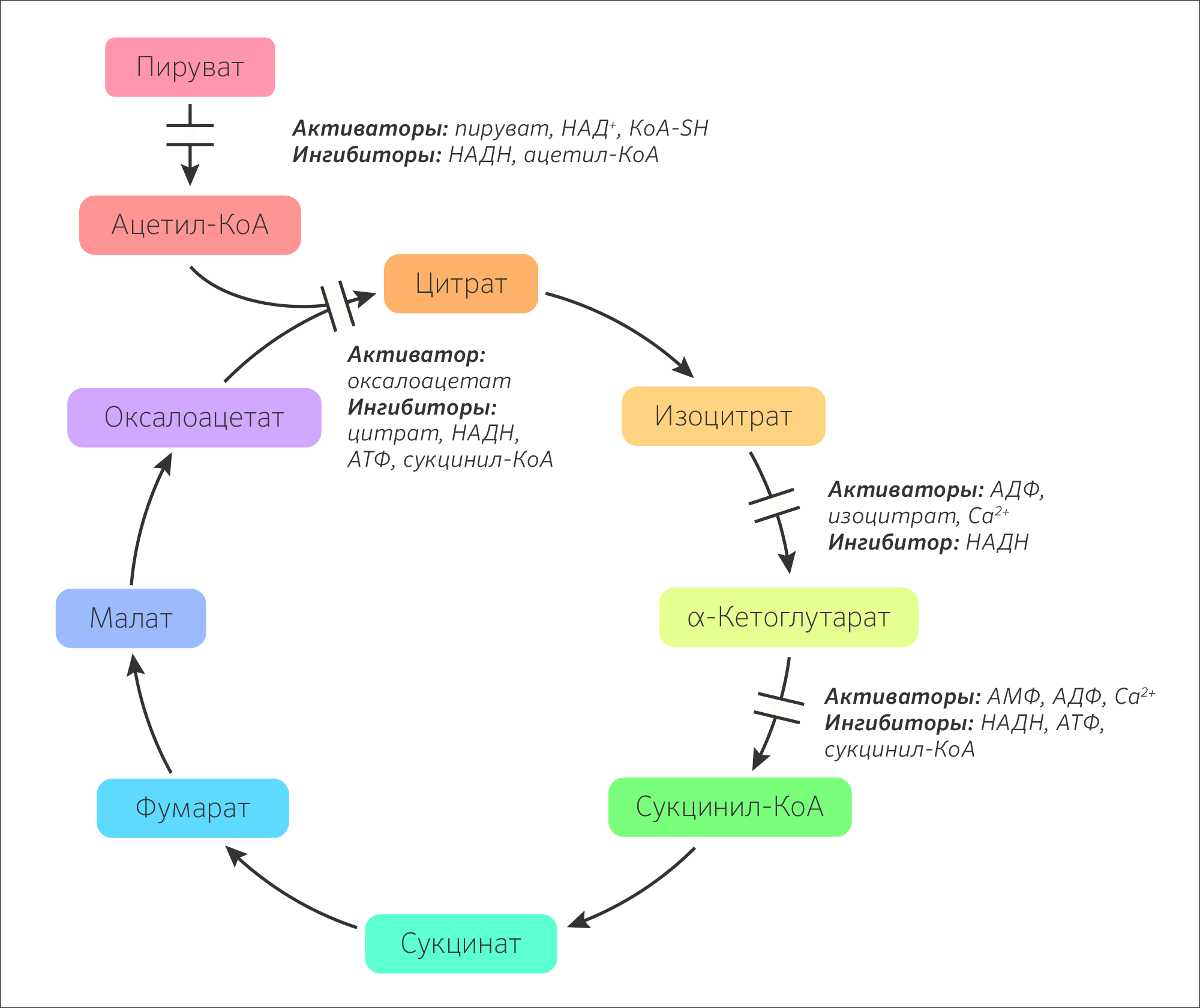
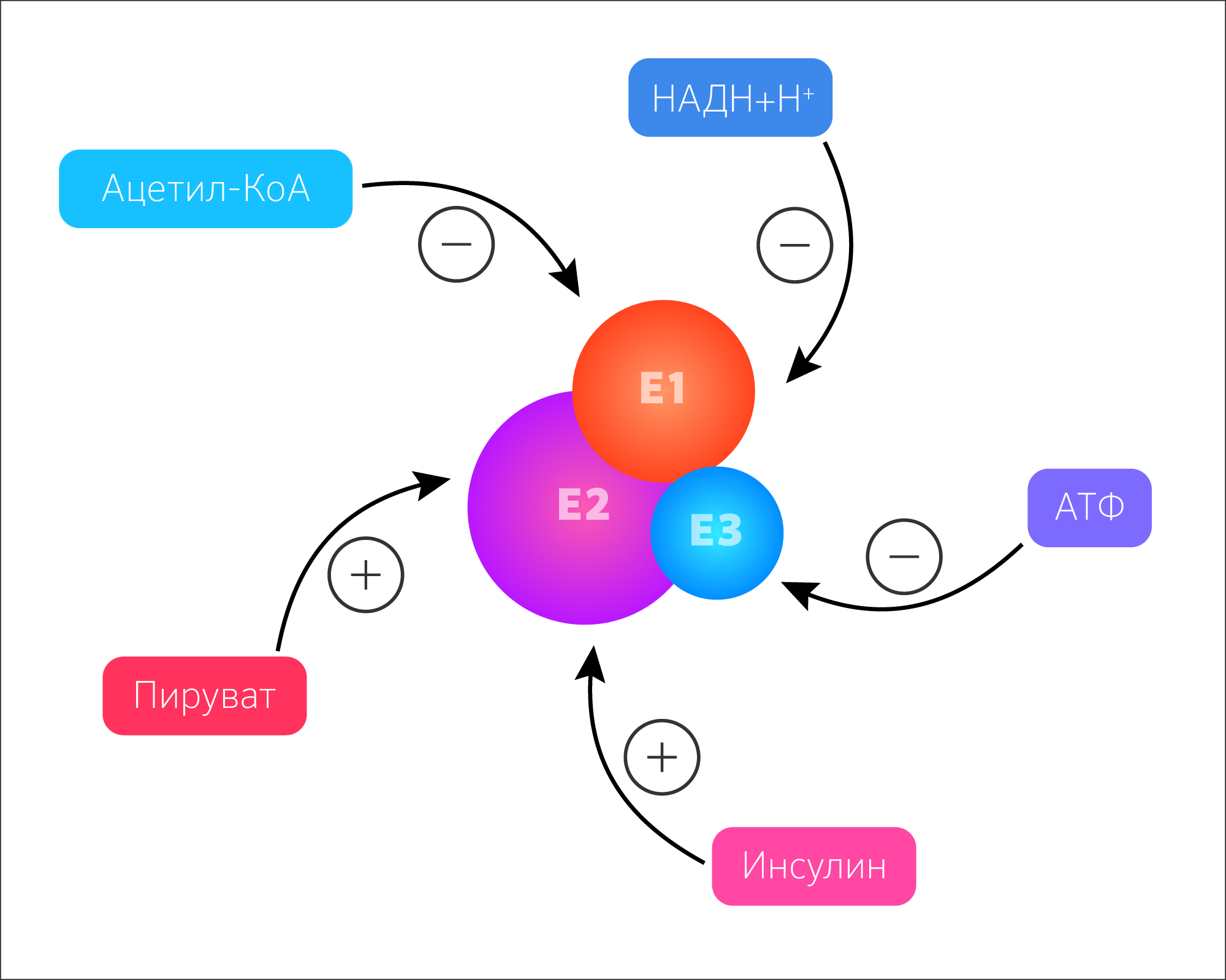
Рисунок 27. Естественная регуляция активности ферментов цикла трикарбоновых кислот по принципу обратной связи.
Скорость реакций ЦТК зависит от обеспеченности клеток энергией АТФ. Активность зависит от соотношения [АТФ]/[АДФ] и [НАДH+H + ]/[НАД + ] (рисунок 27). То есть общий путь катаболизма активируется при низком энергетическом потенциале клетки или ингибируется при высоком. Соотношение [АТФ]/[АДФ] характеризует энергетический заряд клетки (ЭЗК) по Аткинсу, который выражается формулой:
ЭЗК может меняться от 0 до 1. Метаболические пути, приводящие к синтезу АТФ, ингибируются высоким значением ЭЗК, а ведущие к затрате АТФ, активируются высоким значением ЭЗК.
Для ферментов необратимых реакций: пируватдегидрогеназного комплекса, цитратсинтазы, изоцитратдегидрогеназы и α-кетоглутаратдегидрогеназного комплекса индукторами являются такие субстраты как АДФ, окисленный НАД + , а ингибиторами продукты реакции — АТФ, восстановленный НАД + , сукцинил-КоА.
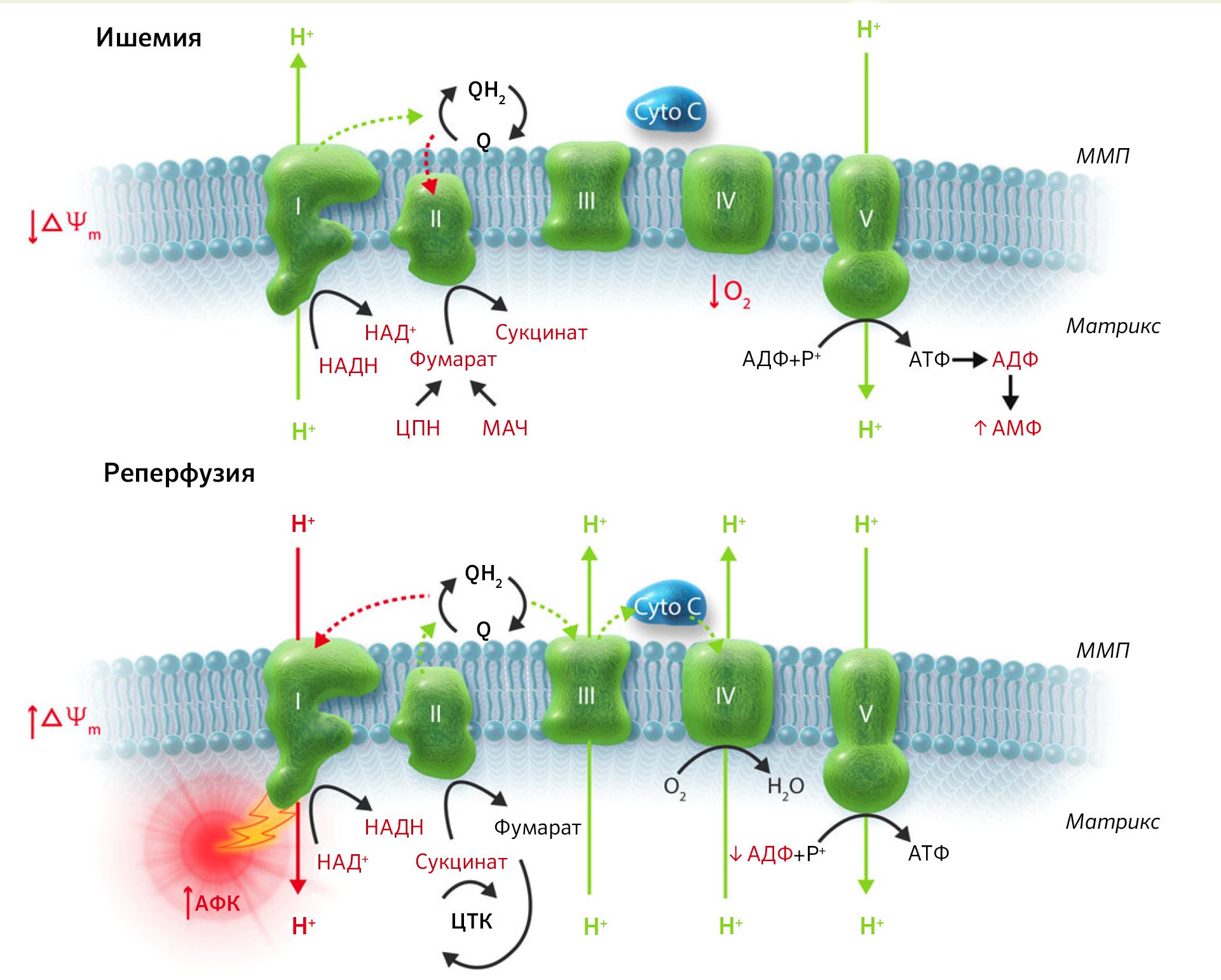
В качестве подтверждения такой зависимости от коферментов и макроэргов рассмотрим некоторые аспекты физиологии и фармакологии. Разобщители тканевого дыхания и окислительного фосфорилирования, например, тиреоидные гормоны, катехоламины, белок термогенин и некоторые антибиотики или лекарственные препараты — парацетамол, динитрофенол, дикумарин — однозначно противостоят депонированию энергии в АТФ. То есть энергия переноса Н + просто рассеивается в виде тепла из-за того, что при действии разобщителей протоны минуют каналы FОF1-ATФсинтазы (рисунок 28) [21]. Но окислительное фосфорилирование не может происходить, если при этом нет фосфорилирования АДФ с образованием АТФ. Для этого в каналы FОF1-ATФсинтазы должны поступать Н + , так как источником энергии для работы FОF1-ATФсинтазы является трансмембранная разность электрохимических потенциалов. В результате разобщения возрастает концентрация АДФ, потребление O2, окисление НАДН+Н + и ФАДН2, что приводит к высвобождению тепловой энергии.
Трансмембранный белок термогенин синтезируется в клетках бурой жировой ткани, но гомологичные белки присутствуют и в других тканях. При охлаждении организма эти клетки получают сигнал от симпатической нервной системы, и в них активируется процесс липолиза, что приводит к получению НАДН+Н + и ФАДН2. Далее активируется ЦПЭ и возрастает электрохимический градиент. Но в мембранах митохондрий клеток бурого жира много темогенина, поэтому большая часть энергии Н + рассеивается в виде тепла, что и помогает поддерживать температуру тела при охлаждении.
Рисунок 28. Схематическое изображение F1FО-АТФсинтазы и ее электронный снимок. F1 — внемембранный (матриксный) комплекс АТФсинтазы. FО — трансмембранный домен.
Динитрофенол — вещество для производства антисептиков, красителей, гербицидов — проникает в межмембранное пространство митохондрий, где концентрация Н + выше, и далее с помощью диффузии попадает в матрикс, где концентрация Н + ниже. Там динитрофенол теряет свой Н + , переходит в ионизированную форму и снова возвращается в межмембранное пространство. Тем самым он рассеивает протонный градиент на внутренней мембране митохондрии. Схожим образом динитрофенол может нарушать глиоксилатный цикл — анаплеротический путь ЦТК у растений, грибов, бактерий и простейших.
Особенно выражено действие парацетамола, а точнее метаболита его действующего вещества — ацетаминофена, на митохондрии гепатоцитов [22]. При поражении свободными радикалами этого вещества митохондриальных мембран, образуемые продукты липопероксидации и свободные ионы кальция нарушают трансмембранный потенциал. Далее при нарушении целостности митохондрий происходит провоспалительный сигналинг цитокинами — IL-1β, ФНО-α, а также простагландина Е2 и тромбоксана В2, что в конечном итоге приводит к деструкции ДНК [23].
Особое место в регуляции ЦТК занимает ответная регуляция пируватдегидрогеназного комплекса. Его активность как фермента зависит от доступности пирувата, аллостерического эффекта и ковалентной модификации. Ковалентная модификация пируватдегидрогеназного комплекса осуществляется путем фосфорилирования и дефосфорилирования по остаткам серина при помощи вспомогательных белков протеинкиназы и фосфопротеинфосфатазы. Протеинкиназа фосфорилирует пируватдегидрогеназный комплекс и инактивирует его, а фосфопротеинфосфатаза дефосфорилирует, превращая его в активную форму. Активность вспомогательных белков может изменяться аллостерически (рисунок 29).
При накоплении продуктов пируватдегидрогеназной реакции тормозится превращение пирувата в ацетил-КоА, т. к. ацетил-КоА и НАДН+Н + являются аллостерическими активаторами протеинкиназы. Такая ситуация создается в печени при голодании: из жировой ткани в цикл трикарбоновых кислот поступают ВЖК, из которых синтезируется ацетил-КоА, а пируват при этом не окисляется и используется для синтеза глюкозы.
Фосфопротеинфосфатаза активируется при повышении концентрации АДФ, внутриклеточного Ca 2+ и под влиянием инсулина за счет повышения концентрации внутримитохондриального Ca 2+ . Этот механизм активации пируватдегидрогеназного комплекса играет важную роль в мышцах и жировой ткани.
Таким образом, активность пируватдегидрогеназного комплекса подавляется нарастающей концентрацией АТФ ([АТФ]/[АДФ]), ацетил-КоА (или жирных кислот для осуществления альтернативных путей образования ацетил-КоА) и НАДH+H + ([НАДH+H + ]/[НАД + ]). Аллостерическое подавление активности пируватдегидрогеназного комплекса усиливается в присутствии жирных кислот, АМФ, КоА и НАД + , когда в цикл трикарбоновых кислот поступает меньше ацетата.
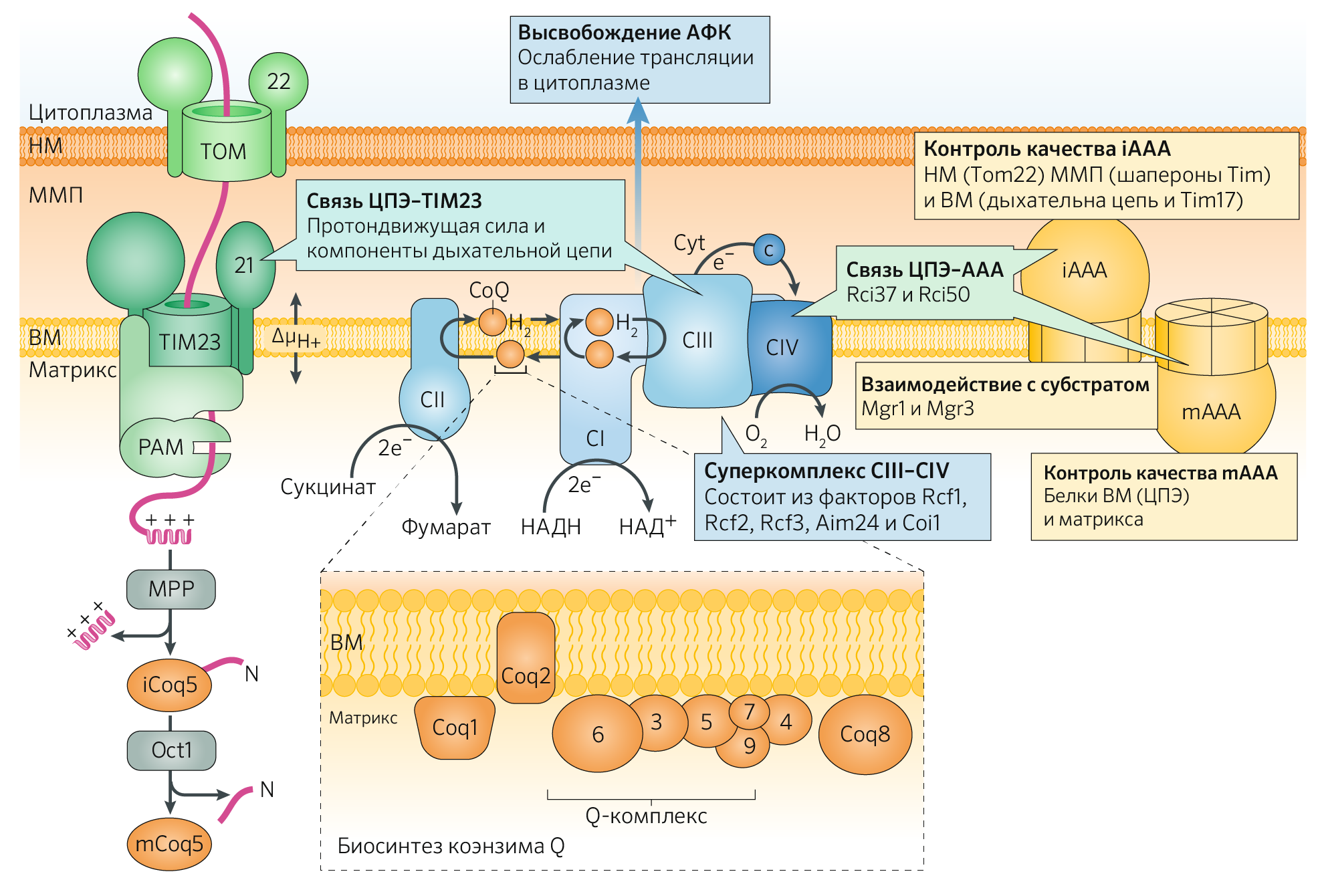
Помимо вышесказанного нельзя не упомянуть значение многочисленных сигнальных белков в регуляции МФК (рисунок 30). Примечательна роль комплексов ТОМ (транслоказа внешней мембраны) на внешней мембране и TIM (транслоказа внутренней мембраны) на внутренней в переносе белков из цитоплазмы в митохондрию, т. к. уже было сказано, что некоторые изоформы ферментов ЦТК синтезируются ядерной, а не митохондриальной ДНК, и заведомо должны быть не только транспортированы между двумя органеллами, но и специфически внедрены через мембрану митохондрии.
Митохондриальные белки после трансляции переносятся к внешней мембране, где их N-концевая сигнальная последовательность сначала взаимодействует с компонентом ТОМ-комплекса и укрепляется белком TOM-22, который содержит кислые цитозольные домены, взаимодействующие с остатками основных аминокислот в составе N-концевой сигнальной последовательности. После переноса через канал в межмембранном пространстве эта основная часть белка-субстрата за счет сил электростатического притяжения входит в контакт с кислыми доменами белков TOM-22 и TIM-23, но близость друг к другу TOM-22 и TIM-23 обеспечивает прохождение белка-субстрата между этими комплексами, минуя выход в межмембранное пространство.
Непосредственное участие в митохондриальном сигналинге принимает AAA (ATPases associated with various cellular activities — АТФ-синтазы, связанные с различными клеточными активностями) — домен, состоящий из α и β субъединиц мембранно-связанного или FO комплекса АТФ-синтазы, который несет так называемый «Walker motifs» [24] — высоко консервативные трехмерные структуры белка, которые регулируют функциональную деятельность FOF1-АТФ-синтазы. При таргетинге митохондриальные белки находятся в несвернутом состоянии и подготавливаются к транслокации за счет связи с белком HSP70, находящемся в цитозоле. Белки семейства HSP экспрессируются при повышении температуры и помогают транспорту других белков, стабилизируя их в частично свернутом состоянии.
Иными словами, ЦТК и ЦПЭ позволяют митохондрии выполнять ее энергетическую роль — синтез АТФ. Но накопилось много данных, которые говорят об участии митохондрий в регуляции различных сигнальных путей в клетке. К тому же, митохондрии являются одним из основных источников внутриклеточных АФК, и в них содержится большое количество ферментов, катализирующих окислительно-восстановительные реакции. Субстраты этих ферментов окисляются кислородом и превращаются в супероксидные радикалы — предшественники прочих АФК, которые в свою очередь участвуют в регуляции как путем прямого окисления функциональных биомолекул, так и путем активации сигнальных каскадов, например, антиоксидантных систем клетки [26,27].
Основные пути регуляции экспрессии генов, кодирующих ферменты ЦТК
Экспрессия генов (таблица 2), кодирующих ферменты (рисунок 31), зависит от функционирования следующих регуляторных систем:
- глюкозная катаболическая репрессия;
- митохондриальные факторы.
У клеток с дисфункциями митохондрий экспрессия генов ЦТК зависит от белков семейства Rtg. Белок Rtg 3, содержащий bHLH-домен, образует комплекс с белком Rtg 1 в ядре. Этот комплекс участвует в ретроградном ответе клетки, то есть в изменении экспрессии ядерных генов в ответ на нарушение состояния митохондрий, в частности ЦПЭ [28]. Было показано, что Rtg-путь активирует экспрессию генов ферментов первых трех стадий ЦТК [29].
Таблица 2. Регуляция экспрессии генов цикла трикарбоновых кислот.
Рисунок 31. Структура ферментов цикла трикарбоновых кислот и их обобщённая роль [33].
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ЦТК И ВОЗМОЖНОСТИ ЕГО ФАРМАКОЛОГИЧЕСКОГО КОНТРОЛЯ
Применение сукцината (янтарной кислоты) и витамина B2 в терапии
Применение фармакологических препаратов с целью активации (поддержания, стимуляции) и дезактивации ЦТК довольно дискуссионно и неоднозначно, т. к. сам процесс реакций ЦТК является консолидированным, а факторов, влияющих на реакционную способность, не всегда зависящих друг от друга, а значит — плохо контролируемых, множество. Есть очень примечательные доводы о том, что потребление кислорода кардиомиоцитами вовсе не изменяется по сравнению с изначальным уровнем при селективной блокаде К + -ATФ-зависимых каналов митохондрий, служащих для индукции адаптации к гипоксии, 5-гидроксидеканоатом [34]. То есть многие типовые патологические процессы на самом деле не такие уж и типовые. Очень важно учитывать контекст конкретных факторов, клеток и реакционных процессов.
Нарушение синтеза АТФ, как правило, связано с дезорганизацией дыхательных МФК на фоне патологического состояния (гипоксии). К МФК 1 относят активацию НАД-зависимого окисления субстратов ЦТК, а к МФК 2 активацию сукцинатоксидазного пути окисления (VI стадия ЦТК) как самого энергоэффективного [35]. Применение препаратов янтарной кислоты является спорной практикой. При этом этилметилгидроксипиридина сукцинат (Мексидол, Мексикор, Нейрокс и т. д.) является одним из самых популярных препаратов на догоспитальном, госпитальном и амбулаторном этапах в России [36] и включен в Перечень жизненно необходимых и важнейших лекарственных препаратов [37], но не одобрен для медицинского применения в США и Европе, а также не входит в систему классификации анатомо-терапевтических и химических веществ (Anatomical Therapeutic Chemical Classification System), утвержденную ВОЗ.
В отечественной медицине препарат получил широкое применение при лечении ишемического инсульта [38,39]. Главным доказательным мотивом выступает принцип Ле Шателье-Брауна, т. е. если в ЦТК извне увеличивать концентрацию его субстрата, то в итоге должна получиться вполне естественная стимуляция реакций, не противоречащая законам химии. Но подтверждается ли это эмпирически? Пока нет. Так, исследователи считают увеличение концентрации сукцината не только универсальным диагностическим критерием ишемии миокарда, но и дополнительным фактором повреждения при постинфарктной реперфузии наряду с АФК (рисунок 32) [40].
Накопление сукцината вследствие мутаций по генам сукцинатдегидрогеназы связывают с ингибированием ряда α-кетоглутарат-зависимых гистон-деметилаз, в частности Jhd1. Предполагается, что сукцинат может играть роль в злокачественной трансформации клеток [41]. В итоге терапия в подобных случаях должна быть направлена на ингибирование накопления или чрезмерного окисления сукцината. На сегодняшний день есть данные о том, что вещество диметилмалонат обладает кардиопротективным свойством на экспериментальных моделях за счет воздействия на процесс окисления сукцината [42]. Правда, такие данные должны подтверждаться надлежащими научными исследованиями с участием людей, т. к. клиническое значение такого подхода пока тоже не выяснено или отсутствует вовсе.
В любом случае нужно понимать, что есть биохимия in silicoin vitroin vivo, но в противовес есть парадигма доказательной медицины и клиническое значение для практики врача.
Касаемо рибофлавина, во-первых, выше было сказано, что витамин В2 является предшественником кофермента ФАД в организме человека. Поэтому будет закономерно рассматривать влияние рибофлавина с позиции метаболизма ФАД. Во-вторых, окисление пирувата, α-кетоглутарата и сукцината идет под действием дегидрогеназных комплексов, обязательным компонентом которых является ФАД. В третьих, ФАД обладает высоким окислительно-восстановительным потенциалом (больше, чем НАД + при значении Е° –0,32 против –0,12 у ФАД). Опираясь на предыдущие доводы касательно нежелательного накопления сукцината, есть вероятность его опосредованной утилизации путем потенцирования окисления до фумарата. Но есть загвоздка: реакция превращения сукцината в фумарат обратима, а сукцинатдегидрогеназный комплекс, как и любой фермент, может ускорить как прямую, так и обратную реакции. В таком случае направление реакции будет диктоваться концентрацией субстрата или продукта, но контролировать и тем более влиять на это в биосистеме человека пока непосильная задача. И может быть не нужная.
Все же ФАД (и НАД + ) имеют некоторое диагностическое значение, например, как мишени при флуоресценции (хемилюминесценции) слизистых ротовой полости при обследовании онкологических больных [43,44]. Дело в том, что восстановленные формы этих коферментов могут поглощать спектр излучения в 340 нм, а окисленные нет. В итоге есть возможность качественно регистрировать интенсивность окисления, особенно при усилении хемилюминесценции от АФК [45].
Вдобавок необходимо обозначить, что дефицит рибофлавина не так распространен, а последствия его недостатка не настолько опасны, чтобы употреблять его в виде препарата. Ведь фактическую суточную норму жители экономически благополучных стран получают с пищей, и вопрос скорее стоит в сбалансированности питания.
Соответственно трендом и перспективой на сегодня является не использование компонентов ЦТК для моделирования реакций при метаболических патологиях любого генеза или применение их в виде препаратов для лечения, а скорее их прикладное исследование в клинической лабораторной диагностике. Например, жидкостная хроматография с масс-спектрометрией для определения онкометаболита D-2-гидроксиглутарата, о котором будет сказано ниже, или газовая хроматография с масс-спектрометрией для определения концентрации сукцината и фумарата.
Онкология, митохондриальные заболевания и иммунитет
Ферменты ЦТК кодируются конститутивными генами (housekeeping genes). Звучит скучно, если это не такие заболевания, как лейомиома или феохромоцитома, возникающие из-за дефекта в гене, кодирующем сукцинатдегидрогеназный комплекс (SDHB, SDHC, SDHD [46]), а также синдромы Лея, Кернса-Сейра, MELAS, MERRF [47]. Некоторые мутации в гене FUM1, кодирующем фумаразу, приводят к снижению или потере активности фермента и как следствие образованию опухолей кожи, матки, нейробластом и/или рака почек (например, лейомиоматоз и хромофильная карцинома почек второго типа) [48]. Для митохондриальных заболеваний характерна гетероплазмия, т. е. в клетке могут находиться как мутантные мтДНК, так и ДНК дикого типа [49]. Также появились данные, что мтДНК может наследоваться потомками от отца [50].
Давно известно, что пусковым механизмом онкологических процессов является собственное снижение реакционной способности ЦТК при нарушениях в ЦПЭ ввиду деградации ферментов, а также концентрирование онкогенных метаболитов [51]. Например, при мутациях в генах IDH1 и IDH2 изоцитратдегидрогеназы образуется субстрат D-2-гидроксиглутарат [52]. В ответ на накопление данного субстрата экспрессируется белок HIF-1α (Hypoxia-inducible factor 1-alpha — фактор, индуцируемый гипоксией), являющийся онкомаркером, т. к. способствует ангиогенезу за счет взаимодействия с проангиогенным фактором VEGF (Vascular Endothelial Growth Factor — фактор роста эндотелия сосудов) [53].
Гипоксию не стоит рассматривать только с позиции физического снижения концентрации кислорода ввиду нарушения его поступления в кровь или транспорта в ткани. Гипоксия также может быть сигналом нарушения тканевого дыхания (функции митохондрии), неотъемлемой частью которого является ЦТК, и об этом было сказано в самом начале. Особую ее роль может подтверждать тот факт, что нейтрофилы в условиях недостатка кислорода живут значительно дольше, чем в нормальных. Такая живучесть определяется увеличением количества транскрипционных факторов HIF-1α, которые приводят к экспрессии Mcl-1 (Induced myeloid leukemia cell differentiation protein — индуцированный белок дифференцировки клеток миелоидного лейкоза) — главного антиапоптотического фактора нейтрофилов из семейства Bcl-2 [54,55].
Не исключают и эффект Варбурга, который сопряжен с выключением митохондриальных генов и сопутствует онкологическим процессам [56]. Данный эффект основан на активации интенсивного гликолиза с образованием лактата даже при избытке кислорода, что является облигатным признаком пролиферации опухолевых клеток [57,58]. При этом некоторые стадии ЦТК обращаются, чтобы синтезировать ацетил-КоА, который нужен для синтеза липидов. Также HIF-1α действует как фактор транскрипции, усиливающий синтез гликолитических ферментов, киназы пируватдегидрогеназного комплекса, которая блокирует реакцию окислительного декарбоксилирования пирувата, и тем самым возрастает концентрация пирувата в цитоплазме клетки, что приводит к усилению эффекта Варбурга и метаболизированию пирувата в лактат.
В конечном итоге при накоплении D-2-гидроксиглутарата возрастает риск сопряженного острого миелоидного лейкоза или глиомы [59,60], при сопутствующем нарушении деметилирования ДНК с участием эпигеномного фактора TET2 (Ten-eleven TranslationTet methylcytosine dioxygenase 2 — тетраметилцитозиндиоксигеназа 2) [61]. Уменьшение количества HIF-1α происходит при действии белка VHL (Von Hippel–Lindau tumor suppressor protein — белок-онкосупрессор), но не в условиях гипоксии (62).
Синдром Лея — генетически детерминированное заболевание с поражением серого вещества головного и спинного мозга, чаще проявляется в раннем детском возрасте [63]. МФК транслируются на митохондриальной ДНК, а мутации при синдроме Лея приводят к дисфункции ЦПЭ (особенно МФК 1, 2 и 4), нарушению синтеза пируватдегидрогеназного комплекса с накоплением в дальнейшем пирувата и лактата в тканях [64,65]. Накапливаемый пируват не поступает в митохондрии, и образующийся в чрезмерных концентрациях лактат оказывает токсичное действие на структуру нейрона.
Синдром Кернса-Сейра или митохондриальная миопатия имеет характерный симптомокомплекс: прогрессирующая наружная офтальмоплегия, пигментная ретинопатия, атриовентрикулярная блокада. Наиболее часто патология выражена со стороны глаз в виде птоза. При этом заболевании также наблюдаются нарушения в работе эндокринной системы. Они включают гипогонадизм, сахарный диабет, гипопаратиреоз, дефицит соматотропина [66]. Синдром проявляется при делеции митохондриальной ДНК [67], что приводит к гетероплазмии [68], и уже распределение мутантных ДНК зависит от локализации процесса в определенной клетке, ткани, органе [69]. Мутации, как правило, приводят к выключению МФК ЦПЭ, что создает уменьшение соотношения [АТФ]/[АДФ], аллостерической деградации реакционной способности ЦТК и накоплению пирувата и лактата [70].
Синдром MELAS (англ. Mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes — митохондриальная энцефаломиопатия, лактатацидоз, инсультоподобные эпизоды) — нейродегенеративное заболевание, диагностически значимыми жалобами которого являются мигрени, судороги, снижение слуха, непереносимость физических нагрузок и повышение концентрации лактата в крови [71].
MERRF (англ. Myoclonic Epilepsy with Ragged Red Fibers) — заболевание, характеризующиеся миоклонической эпилепсией и феноменом RRF (морфологический маркер в биоптате миофибрилл с рваными красными краями). Патогенез данного синдрома является похожим на вышеизложенные митохондриальные заболевания [72].
Иммунная система и ее вовлеченность при нарушениях синтеза ферментов ЦТК понятна. Очевидно, что клетки, потерявшие функциональность своих митохондрий, заведомо являются чужеродными и провоцирующими иммунный ответ. А что можно сказать о прямом воздействии на ЦТК самих иммунокомпетентных клеток?
Существует мнение, что гамма-интерферон не только активирует макрофаги и NK-клетки для регуляции аутоиммунных процессов, но и потенцирует аэробный гликолиз, перепрофилирует митохондрии, усиливает сигналинг окислительного фосфорилирования в них, но это лишь опосредованное влияние на ЦТК как на реакционный компонент митохондрий [73]. В международной практике иммуностимуляторами называют и сами цитокины, используемые как фармакологические средства, которые одобрило FDA. Это сигнальные молекулы иммунитета, и они взаимодействуют с мембранными рецепторами клеток, но не митохондрий.
Тот же интерферон не взаимодействует напрямую с рецепторами митохондрий. Внутриклеточные АФК, сопровождающие воспаление (хотя определенные концентрации АФК стабильны и не являются токсичными, например, перекись водорода присутствует в клетке в постоянной концентрации в пределах 1 нМ [74]), формируются за счет связи интерферона с цитоплазматическим рецептором врожденного иммунитета NLRX1 и адаптерного белка MAVS на внешней мембране митохондрий. Тем самым MAVS, при наличии митохондриальных АФК, может участвовать в апоптозе зараженных вирусами клеток или нетозе нейтрофилов [75,76,77]. Но нет утверждения, что прием определенного интерферона или его индуктора в виде препарата может достоверно повлиять на энергетический метаболизм пораженных вирусом или иммунокомпетентных клеток, тем самым усиливая их активность. На сегодня не продемонстрирована такая эффективность в рамках двойных слепых плацебо-контролируемых исследований, поэтому использование иммуностимуляторов считается бесполезным. Перспектива исследований скорее затрагивает влияние на сигналинг в ЦПЭ, так как ЦТК является последовательностью реакций небелковых компонентов, находящихся в зависимости от функционирования огромного комплекса белкового сигналинга митохондрий. Однако исследователями показано возрастание L-2-гидроксиглутарата (при все той же мутации в генах изоцитратдегидрогеназы) и его производных в ответ на гипоксию и экспрессию HIF-1α у CD8+ лимфоцитов [78].
Таким образом, метаболиты, выявляющиеся при нарушении работы ЦТК и митохондрий, в целом, могут являться как токсичными (лактат, АФК), так и онкогенными (VEGF, D-2-гидроксиглутарат, HIF-1α). Но нет оснований полагать, что ЦТК можно контролировать и регулировать клинико-фармакологическими методами.