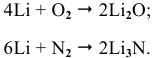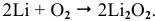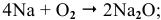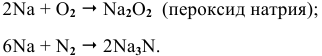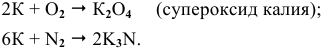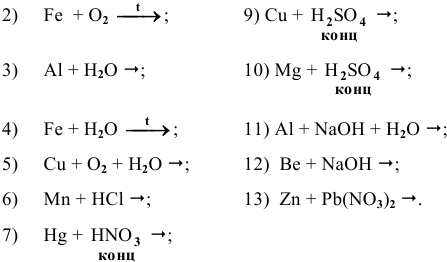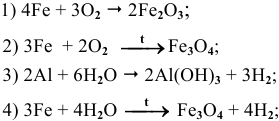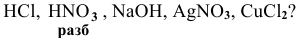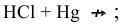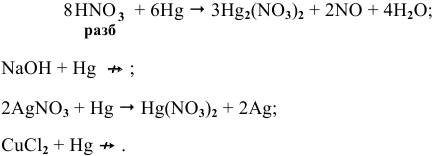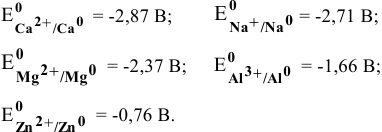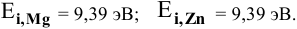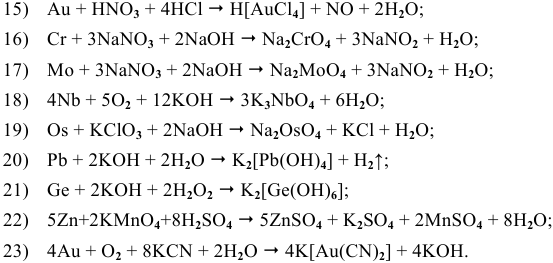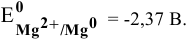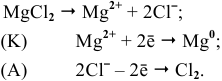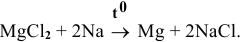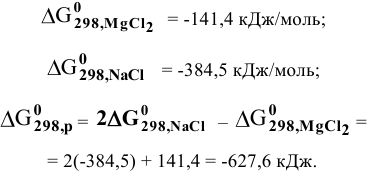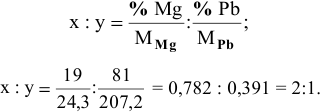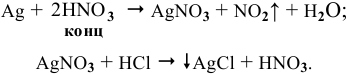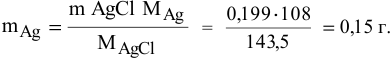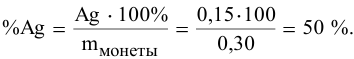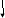- Химические свойства металлов
- Задача 81
- Задача 82
- Задача 84
- Задача 85
- Задача 86
- Задача 87
- Задача 88
- Уравнения по теме «Химические свойства металлов» методическая разработка по химии (9 класс) на тему
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- Цепочки (схемы) превращений для самостоятельных и контрольных работ по темам «Алюминий и его соединения» и «Железо и его соединения» в 9,11 классах
- Просмотр содержимого документа «Цепочки (схемы) превращений для самостоятельных и контрольных работ по темам «Алюминий и его соединения» и «Железо и его соединения» в 9,11 классах»
- 📺 Видео
Химические свойства металлов
Задача 81
Написать уравнения реакций окисления следующих щелочных металлов: 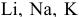
Решение:
Щелочные металлы стоят в начале ряда напряжений металлов. Являясь наиболее активными, они легко окисляются кислородом воздуха уже при обычных температурах. Однако для каждого из указанных металлов есть свои особенности. Литий уже при обычных температурах реагирует как с кислородом воздуха, так и со вторым компонентом воздуха — азотом, образуя, соответственно, оксид и нитрид лития:
При высоких температурах вместо оксида лития образуется пероксид лития:
Натрий: а) при обычной температуре —
б) при высоких температурах —
Калий: а) при обычной температуре — 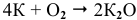
б) при высоких температурах —
Задача 82
Основываясь на знании общих химических свойств металлов, написать уравнения следующих химических реакций:

Решение:
5) Электрохимическая коррозия меди с кислородной деполяризацией:
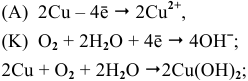
Задача 83
С какими из следующих веществ может реагировать ртуть:
Решение:
Задача 84
Среди металлов: 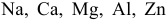
а) в водных средах;
б) в неводных средах.
Решение:
В водных средах количественной характеристикой восстановительных свойств металла является величина его электродного потенциала. Для изучаемых металлов величины стандартных электродных потенциалов следующие:
Наиболее низкий электродный потенциал у кальция, значит, он наиболее сильный восстановитель в водных средах, а наиболее высокий электродный потенциал у цинка, значит, он наиболее слабый восстановитель среди перечисленных металлов.
В неводных средах количественной характеристикой восстановительных свойств металла является величина его энергии ионизации.
Величины энергий ионизации изучаемых металлов находим в справочнике:
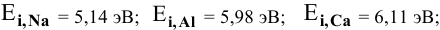
Наиболее низкая энергия ионизации (ионизационный потенциал) у натрия — самого сильного восстановителя из перечисленных металлов, наиболее высокая энергия ионизации у цинка — самого слабого восстановителя.
Задача 85
Составить и уравнять с помощью электронного баланса ОВ реакции.
Решение:
Ниже приводятся уравнения уже составленных и уравненных реакций:

Задача 86
Каким методом может быть получен металлический магний?
Решение:
Магний — это очень активный металл, его электродный потенциал
Значит, магний может быть получен не электролизом водных растворов солей магния, а электролизом расплавов его солей, например электролизом расплава 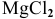
Магний также может быть получен металлотермией при использовании какого-либо металла, химическое сродство которого к атому, с которым он связан, выше, чем у магния, например:
Докажем возможность использования Na:
Так как 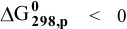
Задача 87
При смешивании расплавленных масс магния и свинца образуется интерметаллическое соединение, содержащее 81% РЬ. Какова его формула?
Решение:
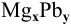
Таким образом, формула интерметаллического соединения — 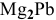
Задача 88
Для определения процентного содержания серебра в старой монете растворили 0,3 г этой монеты в концентрированной 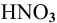
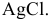
Решение:
Уравнения химических реакций, происходящих в ходе анализа, следующие:
Согласно уравнениям этих двух реакций, 1 моль 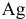
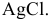
Рассчитаем массу серебра, соответствующую 0,199 г 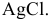
Вычислим процентное содержание серебра в монете:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Уравнения по теме «Химические свойства металлов»
методическая разработка по химии (9 класс) на тему
Большое количество уравнений, требующих детальной проработки теоретического материала.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Скачать:
| Вложение | Размер |
|---|---|
| uravneniya_po_teme_himicheskie_svoystva_metallov.docx | 13.64 КБ |
Видео:8 класс. Цепочки превращений. Генетические ряды.Скачать

Предварительный просмотр:
Тема: Химические свойства металлов
Дописать уравнения возможных реакций и расставить коэффициенты:
- Li + C=
- Sn + H 2 O=
- Cu + H 2 SO 4 (Конц)= Cu SO 4 + SO 2 + H 2 O
- Ba + KOH=
- Fe + PbCl 2 =
- Cu + H 2 O=
- Ba+ P=
- Al + HCl=
- Hg+ AgNO 3 =
- Na + Cl 2 =
- K + H 2 O=
- Cu + H NO 3 (Конц)=
- Zn + KOH=
- Fe + AlCl 3 =
- ZnCl 2 +Sn =
- Cu + H 2 O=
- Al+ KOH=
- Ni + MgO=
- Br 2 + Ca=
- Zn + H 2 O=
- Mg+ H 3 PO 4 =
- Fe + NaOH=
- Al + CoO=
- Sn + H 2 O=
- Ba + KOH=
- Al + FeO=
- Au + H 2 O=
- Be+ O 2 =
- Ni+ HCl=
- Sn+ AgNO 3 =
- К+ Cl 2 =
- Ca + H 2 O=
- Zn+ NaOH=
- Fe + AlCl 3 =
- Fe + H 2 O=
- Zn + H 2 SO 4 (разб)=
- Be+ KOH=
- ZnCl 2 +Sn =
- Li + I 2 =
- Ni + MgO=
- Br 2 + Ca=
- Zn + H 2 O=
- Mg+ H 3 PO 4 =
- Fe + NaOH=
Видео:1.4. Алканы: Решение цепочек. ЕГЭ по химииСкачать

По теме: методические разработки, презентации и конспекты
план-конспект урока с использованием ЭОР в 9 классе по теме «Положение металлов в ПСХЭ. Физические свойства металлов»
Цель урока: повторить положение металлов в ПСХЭ и особенности строения их атомов, обобщить и расширить знания учащихся о физических свойствах металлов.
Свойства металлов. Металлы в организме человека
Методическая разработка урока химии в 9 классе в рамках школьного методического дня «Как сделать вопросы и задания инструментом развития мышления учащихся».
Конспект урока по теме:»Металлы, их положение в Периодической системе, строение атомов металлов. Общие физические свойства металлов.»
План — конспект урока разработан для учащихся 9 класса на основе Примерной программы по химии для основной школы и на основе программы авторского курса химии для 8-11 классов О.С. Габриеляна (в .
Металлы и их соединения. Общая характеристика и свойства металлов.
Данный материал будет незаменим как мультимедийное дополнение на уроке химии по теме «Металлы и их соединения» и будет полезен любому учителю, стремящемуся сделать объяснение нового материала максимал.
Урок по химии в 9 классе. Тема: «Общие химические свойства металлов. Взаимодействие металлов со сложными веществами. Электрохимический ряд напряжений металлов».
Урок по химии в 9 классе. Тема: «Общие химические свойства металлов. Взаимодействие металлов со сложными веществами. Электрохимический ряд напряжений металлов». Цели урока учебные, воспитательные и р.
Получение металлов. Физические свойства металлов.
План — конспект урока с рабочей инструкцией.
План урока химии по теме «Положение металлов в Периодической системе химических элементов Д.И. Менделеева, строение их атомов. Строение металлов – простых веществ. Физические свойства металлов».
План урока № 62 (9кл). Положение металлов в Периодической системе химических элементов Д.И. Менделеева, строение их атомов. Строение металлов – простых веществ. Физические свойства металлов.
Видео:Решение цепочек превращений по химииСкачать

Цепочки (схемы) превращений для самостоятельных и контрольных работ по темам «Алюминий и его соединения» и «Железо и его соединения» в 9,11 классах
Разработка соответствует учебно-методическому комплекту Г.Е.Рудзитиса, Ф.Г.Фельдмана и может применяться при проведении самостоятельных и контрольных работ в 9, 11 классах.
Цель учебного материала – проверить уровень учебных достижений учащихся по темам «Алюминий и его соединения» и «Железо и его соединения».
«Цепочки» – это оптимальный способ проверить большой объем знаний в одном упражнении.
Просмотр содержимого документа
«Цепочки (схемы) превращений для самостоятельных и контрольных работ по темам «Алюминий и его соединения» и «Железо и его соединения» в 9,11 классах»
Цепочки (схемы) превращений для самостоятельных и контрольных работ по темам
«Алюминий и его соединения» и «Железо и его соединения» в 9,11 классах
Разработка соответствует учебно-методическому комплекту Г.Е.Рудзитиса, Ф.Г.Фельдмана и может применяться при проведении самостоятельных и контрольных работ в 9, 11 классах.
Цель учебного материала – проверить уровень учебных достижений учащихся по темам «Алюминий и его соединения» и «Железо и его соединения».
Такие задания со схемами последовательных превращений одних веществ в другие, которые характеризуют связь между основными классами неорганических веществ, в данном случае, могут быть использованы для подготовки учащихся к ОГЭ и ЕГЭ, а также для дистанционного обучения.
Для выполнения таких заданий необходимо знать основные классы неорганических соединений, номенклатуру, лабораторные и промышленные способы получения, химические свойства, в том числе продукты термического разложения веществ, механизмы реакций.
«Цепочки» – это оптимальный способ проверить большой объем знаний в одном упражнении.



2) Al → K[Al(OH)₄] → Al(NO₃)₃ → Al(OH)₃ → AlBr₃ → AlCl3


4 

5 

📺 Видео
Реакции металлов с кислородом и водой. 8 класс.Скачать

8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Химические свойства металлов. 9 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

9 класс § 4. "Цепочки превращений".Скачать

9 класс § 16 "Цепочки превращений".Скачать

9 класс § 14 "Цепочки превращений".Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химия 9 класс (Урок№23 - Щелочные металлы. Физические и химические свойства. Оксиды и гидроксиды.)Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ОГЭ. Задание 21. Цепочка превращений.Скачать
9 класс § 15 "Цепочки превращений".Скачать