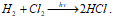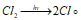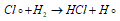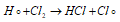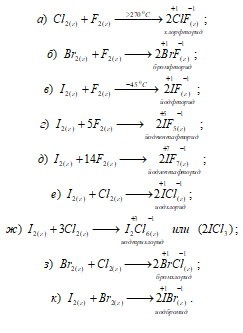Задача 812.
Составить схему цепной реакции хлора с водородом. Какую роль в ней играет освещение? Имеет ли значение частота света?
Решение:
Синтез HCl из Н2 и Cl2 протекает на свету:
Эта реакция относится к неразветвлённым цепным реакциям. Поглощение кванта света или другой лучистой энергии (hv) молекулой Cl2 приводит к её возбуждению – к появлению в ней энергичных колебаний атомов. И, как только энергия колебаний атомов превышает энергию связи между атомами, то молекула распадается. Формирование цепи начинается с образования радикалов:
Образующиеся атомы хлора легко реагируют с молекулой водорода с образованием молекулы хлороводорода и атома водорода:
Атом водорода, в свою очередь, легко реагирует с молекулой хлора с образованием молекулы хлороводорода и атома хлора:
Эта последовательность процесса продолжается дальше, в рассматриваемом случае число звеньев может достигать 100000. При данной фотохимической реакции частота света играет существенную роль, поскольку количество энергии кванта света определяется произведением постоянной Планка (h) и частотой света (v), получим: (hv). От численного значения частоты света зависит величина количества энергии кванта. Для распада молекулы Cl2 на 2 необходима частота света чуть больше 550 ммк. Под действием получаемого при данной частоте кванта света разрушается связь Cl — Cl, а не Н — Н, так как Е(Cl — Cl) = 243 кДж/моль, а Е(Н — Н) = 436 кДж/моль.
Таким образом, под действием света энергии кванта света (Е = hv) достаточно только для разрыва связей Cl — Cl в молекуле Cl2, а не для разрыва связей Н — Н в молекуле Н2. Именно свет является фактором, который определяет начало цепной реакции — образование свободных атомов хлора.
Задача 813.
Написать уравнения реакций взаимодействия галогенов с водой и растворами щелочей (холодными и горячими).
Решение:
а) Уравнения реакций взаимодействия галогенов с водой:
Раствор брома в воде называют «бромной водой».
б) Уравнения реакций взаимодействия галогенов с холодным раствором щёлочи:
Cl2 + 2OH— ↔ Cl — + OCl — + H2O.
в) Уравнения реакции взаимодействия галогена с горячим раствором щёлочи:
3Cl2 + 6OH — ↔ 5Cl — + OCl3 — + 3H2O.
Таким образом, при растворении галогенов в холодной воде и в холодных растворах щелочей происходит восстановление хлора до степени окисления его атома +1 и окисление галогена до степени окисления -1. В горячих растворах щелочей галоген самоокисляется и самовосстанавливается соответственно до степени окисления -1 и до степени окисления +5.
Задача 814.
Привести примеры возможных реакций галогенов друг с другом. Указать степени окисленности галогенов в продуктах реакций.
Решение:
Известны соединения галогенов друг с другом (галоиды), например: BrCl, ICl3, BrF5, IF7, ClF, ClF5 IBr и другие. Все соединения галоидов могут быть получены прямым синтезом, например:
Некоторые из галоидов могут существовать в обычных условиях и не разлагаться, например ClF (газ), BrF (жидкость), IF5 (жидкость), IF7 (газ).
Задача 815.
При 300 °С степень термической диссоциации НI составляет 20%. Каковы при этой температуре равновесные концентрации Н2 и I2 в системе
Н2 +12 ↔ 2НI, если равновесная концентрация НI равна 0,96 моль/л?
Решение:
Обозначим начальную концентрацию HI через х (моль/л). Если к моменту наступления равновесия из каждых х молей йодоводорода диссоциировано х молей,
то при этом, согласно уравнению реакции, образовалось 0,5х; моля Н2 и 0,5х моля I2.
Находим начальную концентрацию HI (х) с учетом того, что термическая диссоциация ее составляет 20% (0,2), составив соотношение:
0,96 = х — (0,96 . 0,2);
х = 0,96 + 0,192 = 1,152 моля.
Тогда равновесные концентрации Н2 и I2 с учётом того, что степень термической диссоциации НI составляет 20%, получим:
[H2] =[I2] = 0,5x . 0,2 = 0,5 . 1,152 . 0,2 = 0,1152 моля.
- Галогены. Химия галогенов и их соединений
- Галогены
- Положение в периодической системе химических элементов
- Электронное строение галогенов
- Физические свойства и закономерности изменения свойств
- Соединения галогенов
- Способы получения галогенов
- Химические свойства галогенов
- Галогеноводороды
- Строение молекулы и физические свойства
- Способы получения галогеноводородов
- Химические свойства галогеноводородов
- Галогениды металлов
- Способы получения галогенидов
- Химические свойства галогенидов
- Кислородсодержащие кислоты галогенов
- Хлорноватистая кислота и ее соли
- Хлористая кислота и ее соли
- Хлорноватая кислота и ее соли
- Хлорная кислота и ее соли
- Галогены. Теория и подборка заданий №32 ЕГЭ. материал для подготовки к егэ (гиа) по химии (11 класс)
- Скачать:
- Предварительный просмотр:
- 📹 Видео
Видео:Галогены. 9 класс.Скачать

Галогены. Химия галогенов и их соединений
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns 2 np 5 .
Например , электронная конфигурация фтора :
Электронная концигурация хлора :
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s 2 2p 5 | … 3s 2 3p 5 | … 4s 2 4p 5 | … 5s 2 5p 5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220 о С | –101 о С | –7 о С | 113,5 о С |
| Т кипения | –188 о С | –34 о С | 58 о С | 185 о С |
Внешний вид галогенов:
Фтор
Хлор
Бром
Йод
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются ионы натрия:
K(–): Na + +1e → Na 0
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза расплава хлорида натрия:
2Na + + 2Cl − → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH −
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Например , взаимодействием соляной кислоты с оксидом марганца (IV)
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
3. Получение брома.
Бром можно получить окислением ионов Br – сильными окислителями.
Например , бромоводород окисляется хлором:
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
Например , оксид марганца (IV):
4. Получение йода.
Йод получают окислением ионов I – сильными окислителями.
Например , хлор окисляет йодид калия:
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например , оксид марганца (IV) в кислой среде окисляет йодид калия:
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей . Галогены реагируют с металлами и неметаллами .
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например , железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например , фтор окисляет хлор, бром и йод:
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например , хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлороватую кислоту:
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например , хлор реагирует с холодным раствором гидроксидом натрия:
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например , хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например , фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например , хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Например , действием концентрированной серной кислоты на хлорид натрия:
Галогеноводороды получают также прямым взаимодействием простых веществ:
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства . Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами . Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
Например , хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
2HCl + CaO → CaCl2 + H2O
HCl + NaOH → NaCl + H2O
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с металлами , расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
Например , соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют , образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H + + F –
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H + + Cl –
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Например , соляная кислота реагирует с карбонатом кальция:
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с галогенами . При этом более активные галогены вытесняют менее активные.
Например , бром вытесняет йод из йодоводорода:
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например : концентрированная соляная кислота окисляется оксидом марганца (IV):
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Например , бромоводород окисляется концентрированной серной кислотой:
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
Или с оксидом марганца (IV):
Пероксид водорода также окисляет бромоводород до молекулярного брома:
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
Например , йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
Йодоводород легко окисляется соединениями азота, например , оксидом азота (IV):
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
1. Галогениды металлов получают при взаимодействии галогенов с металлами . При этом галогены проявляют свойства окислителя.
Например , хлор взаимодействует с магнием и кальцием:
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Например , соляная кислота реагирует с железом с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
Например , при взаимодействии оксида кальция и соляной кислоты:
2HCl + CaO → CaCl2 + H2O
Еще пример : взаимодействие оксида алюминия с соляной кислотой:
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
Например , при взаимодействии гидроксида натрия и соляной кислоты:
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
Например , гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями , если образуется осадок, газ или вода.
Например , бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
2. Галогениды тяжелых металлов реагируют с более активными металлами . При этом более активные металлы вытесняют менее активные.
Например , магний вытесняет медь из расплава хлорида меди (II):
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Например , натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
Например , при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
4. Галогениды металлов проявляют восстановительные свойства . Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями. В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
Например , бромид калия окисляется концентрированной серной кислотой:
Еще пример : йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака .
Например , хлорид серебра (I) растворяется под действием избытка раствора аммиака:
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
Например , хлорид серебра разлагается под действием ультрафиолета:
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде :
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается :
2HClO → 2HCl + O2
2. Как кислота, хлорноватистая кислота реагирует с сильными основаниями .
Например , с гидроксидом калия:
HClO + KOH → KClO + H2O
3. Ярко выражены окислительные свойства хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
Например , хлорноватистая кислота окисляет йодоводород:
HClO + 2HI → HCl + I2 + H2O
Хлорноватистая кислота также окисляет, например , пероксид водорода:
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
Например , соляная кислота реагирует с гипохлоритом натрия:
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Даже угольная кислота вытесняет гипохлориты:
2. Гипохлориты вступают в обменные реакции с другими солями , если образуется слабый электролит.
Например , гипохлорит кальция реагирует с растворимыми карбонатами:
3. При нагревании гипохлориты разлагаются :
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
2. При длительном хранении разлагается:
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Например , из хлората бария под действием серной кислоты:
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
2. Хлорноватая кислота – сильный окислитель.
Например , хлорноватая кислота окисляет фосфор:
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
Например , хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример : хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Например , из перхлората натрия под действием серной кислоты:
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
2. Хлорная кислота – сильный окислитель.
Например , хлорная кислота окисляет углерод:
3. При нагревании хлорная кислота разлагается:
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Например , перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
Еще пример : перхлорат калия окисляет алюминий:
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Галогены. Теория и подборка заданий №32 ЕГЭ.
материал для подготовки к егэ (гиа) по химии (11 класс)
Кратко основная теория по теме «Галогены и их соединения», а также задания №32 с ответами.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Скачать:
| Вложение | Размер |
|---|---|
| galogeny.docx | 41.28 КБ |
Видео:8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать

Предварительный просмотр:
Хлор. Соединения хлора.
- В промышленности хлор получают электролизом расплава или раствора хлорида натрия:
2NaCl 2Na + Cl 2 ↑
2NaCl + 2H 2 O H 2 ↑ + 2NaOH + Cl 2 ↑
- В лаборатории хлор получают взаимодействием соляной кислоты с сильными окислителями, например:
MnO 2 + 4HCl = MnCl 2 + Cl 2 ↑ + 2H 2 O
2KMnO 4 + 16HCl = 2MnCl 2 + 2KCl + 5Cl 2 ↑ + 8H 2 O
KClO 3 + 6HCl = KCl + 3Cl 2 ↑ + 3H 2 O
K 2 Cr 2 O 7 + 14HCl = 2CrCl 3 + 2KCl + 3Cl 2 ↑ + 7H 2 O
Химические свойства . Свободный хлор реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов . Хлор проявляет сильные окислительные свойства в реакциях как с простыми веществами – неметаллами и металлами, так и со сложными веществами:
Cl 2 + H 2 = 2HCl 3Cl 2 + 2P = 2PCl 3 5Cl 2 + 2P = 2PCl 5
2Cl 2 + Si = SiCl 4 2Cl 2 + C (кокс) + 2H 2 O (пар) = CO 2 + 4HCl
Cl 2 + 2Na = 2NaCl Cl 2 + Mg = MgCl 2 3Cl 2 + 2Fe = 2FeCl 3
Cl 2 + H 2 O↔ HCl + HClO (хлорная вода)
2Cl 2 + 2H 2 O = 4HCl + O 2 (на свету или кип.)
Сl 2 + 2NaOH (хол.) = NaCl + NaClO + H 2 O
3Cl 2 + 6NaOH (гор.) = 5NaCl + NaClO 3 + 3H 2 O
2Сl 2 + 2Са(OH) 2 (хол.) = СaCl 2 + Сa(ClO) 2 + 2H 2 O хлорная известь
Cl 2 + 2NaI = 2NaCl + I 2 Cl 2 + H 2 S = S + 2HCl
Cl 2 + 3H 2 O 2 = 2HCl + 2H 2 O + O 2
Cl 2 + H 2 O + Na 2 SO 3 = 2HCl + Na 2 SO 4
- Хлороводород. Хлороводород получают действием концентрированной соляной кислоты на твердый хлорид натрия:
H 2 SO 4(конц.) + NaCl (тверд.) = NaHSO 4 + HCl↑
Хлороводород получают также прямым взаимодействием простых веществ: Cl 2 + H 2 2HCl
Соляная кислота . В химических реакциях соляная кислота проявляет все свойства сильных кислот: взаимодействует с металлами, стоящими в ряду напряжений левее водорода, с оксидами (основными, амфотерными), основаниями, амфотерными гидроксидами и солями:
2HCl + Fe = FeCl 2 + H 2
2HCl + CaO = CaCl 2 + H 2 O
6HCl + Al 2 O 3 = 2AlCl 3 + 3H 2 O
HCl + NaOH = NaCl + H 2 O
2HCl + Cu(OH) 2 = CuCl 2 + 2H 2 O
2HCl + Zn(OH) 2 = ZnCl 2 + 2H 2 O
HCl + NaHCO 3 = NaCl + CO 2 ↑ + H 2 O
HCl + AgNO 3 = AgCl↓ + HNO 3 (качественная реакция на галогенид-ионы)
6HCl (конц.) + 2HNO 3(конц.) = 3Cl 2 + 2NO + 4H 2 O
HClO HClO 2 HClO 3 HClO 4
Хлорноватистая хлористая хлорноватая хлорная
усиление кислотных свойств
2HClO 2HCl + O 2 HClO + 2HI = HCl + I 2 + H 2 O
HClO + H 2 O 2 = HCl + H 2 O + O 2
Соли соляной кислоты – хлориды.
AgCl + 2(NH 3 ∙ H 2 O) = [Ag(NH 3 ) 2 ]Cl + 2H 2 O
2AgCl 2Ag + Cl 2
Соли кислородсодержащих кислот.
NaClO + 2HCl = NaCl + Cl 2 + H 2 O
Ca(ClO) 2 + H 2 SO 4 = CaSO 4 + 2HCl + O 2
Ca(ClO) 2 + CO 2 + H 2 O = CaCO 3 + 2HCl + 2O 2
Ca(ClO) 2 + Na 2 CO 3 = CaCO 3 + 2NaClO
Ca(ClO) 2 CaCl 2 + O 2
4KClO 3 3KClO 4 + KCl
2KClO 3 2KCl + 3O 2 ↑
KClO 4 2O 2 + KCl
III. Бром. Соединения брома. По химической активности бром занимает промежуточное положение между хлором и иодом.
Br 2 + H 2 = 2HBr 3Br 2 + 2Fe = 2FeBr 3
Br 2 + H 2 O = НBr + НBrO – бромная вода
3Br 2 + 6NaOH (конц.) = 5NaBr + NaBrO 3 + 3H 2 O при нагревании
Br 2 + 2NaOH (конц.) = NaBr + NаBrO + H 2 O без нагревания
3Br 2 + 3Na 2 CO 3 = 5NaBr + NaBrO 3 + 3CO 2
3Br 2 + S + 4H 2 O = 6HBr + H 2 SO 4
Br 2 + SO 2 + 2H 2 O = 2HBr + H 2 SO 4
Br 2 + 2NaI = 2NaBr + I 2 Br 2 + H 2 S = S + 2HBr
4Br 2 + Na 2 S 2 O 3 + 10NaOH = 2Na 2 SO 4 + 8NaBr + 5H 2 O
14HBr + K 2 Cr 2 O 7 = 2KBr + 2CrBr 3 + 3Br 2 + 7H 2 O
4HBr + MnO 2 = MnBr 2 + Br 2 + 2H 2 O
2HBr + H 2 O 2 = Br 2 + 2H 2 O
2KBr + 2H 2 SO 4 (конц.) = 4K 2 SO 4 + 4Br 2 + SO 2 + 2H 2 O
2KBrO 3 3O 2 + 2KBr
2KBrO 4 O 2 + 2KBrO 3 (до 275°С)
KBrO 4 2O 2 + KBr (выше 390°С)
IV. Йод. Соединения йода.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании.
3I 2 + 3P = 2PI 3 I 2 + H 2 = 2HI I 2 + Fe = FeI 2
Йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
3I 2 + 6NaOH (гор.) = 5NaI + NaIO 3 + 3H 2 O
I 2 + 2NaOH (хол) =NaI + NaIO + H 2 O
3I 2 + 10HNO 3(разб) = 6HIO 3 + 10NO + 2H 2 O
I 2 + 10HNO 3 ( конц.) = 2HIO 3 + 10NO 2 + 4H 2 O
I 2 + 5NaClO + 2NaOH = 5NaCl + 2NaIO 3 + H 2 O
I 2 + 5Cl 2 + 6H 2 O = 10HCl + 2HIO 3
I 2 + Na 2 SO 3 + 2NaOH = 2NaI + Na 2 SO 4 + H 2 O
2HI + 2FeCl 3 = I 2 + 2FeCl 2 + 2HCl
2HI + Fe 2 (SO 4 ) 3 = 2FeSO 4 + I 2 + H 2 SO 4
2HI + NO 2 = I 2 + NO + H 2 O
2HI + S = I 2 + H 2 S
8KI + 5H 2 SO 4 (конц.) = 4K 2 SO 4 + 4I 2 + H 2 S + 4H 2 Oили
8KI + 9H 2 SO 4(конц.) = 4I 2 ↓ + H 2 S↑ + 8KHSO 4 + 4H 2 O
KI + 3H 2 O + 3Cl 2 = HIO 3 + KCl + 5HCl
10KI + 8H 2 SO 4 + 2KMnO 4 = 5I 2 + 2MnSO 4 + 6K 2 SO 4 + 8H 2 O
6KI + 7H 2 SO 4 + K 2 Cr 2 O 7 = Cr 2 (SO 4 ) 3 + 3I 2 + 4K 2 SO 4 + 7H 2 O
2KI + H 2 SO 4 + H 2 O 2 = I 2 + K 2 SO 4 + 2H 2 O
2KI + Fe 2 (SO 4 ) 3 = I 2 + 2FeSO 4 + K 2 SO 4
2KI + 2CuSO 4 + K 2 SO 3 + H 2 O = 2CuI + 2K 2 SO 4 + H 2 SO 4
2HIO 3 I 2 O 5 + H 2 O
2HIO 3 + 10HCl = I 2 + 5Cl 2 + 6H 2 O
2HIO 3 + 5Na 2 SO 3 = 5Na 2 SO 4 + I 2 + H 2 O
2HIO 3 + 5H 2 SO 4 + 10FeSO 4 = Fe 2 (SO 4 ) 3 + I 2 + 6H 2 O
I 2 O 5 + 5CO I 2 + 5CO 2
2KIO 3 3O 2 + 2KI
2KIO 3 + 12HCl (конц.) = I 2 + 5Cl 2 + 2KCl + 6H 2 O
KIO 3 + 3H 2 SO 4 + 5KI = 3I 2 + 3K 2 SO 4 + 3H 2 O
KIO 3 + 3H 2 O 2 = KI + 3O 2 + 3H 2 O
2KIO 4 O 2 + 2KIO 3
5KIO 4 + 3H 2 O + 2MnSO 4 = 2HMnO 4 + 5KIO 3 + 2H 2 SO 4
1. Вещество, полученное на аноде при электролизе расплава иодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
2. Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия.Напишите уравнения описанных реакций.
3. Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты – становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
4. Бесцветные газы выделяются при выдерживании концентрированной кислоты, как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли.Напишите уравнения описанных реакций.
5. При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха, при нагревании этой соли без катализатора образуются соль Б и соль кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный газ (простое вещество) и образуется соль Б. соль Б окрашивает пламя в фиолетовый цвет, при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета.Напишите уравнения описанных реакций.
6) При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного газа. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ , входящий в состав атмосферного воздуха. Напишите уравнения описанных реакций.
7) Йод нагрели с избытком фосфора, и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.
8) Газ, выделившийся при нагревании твердой поваренной соли с концентрированной серной кислотой, пропустили через раствор перманганата калия. Газообразный продукт реакции поглотили холодным раствором едкого натра. После добавления в полученный раствор йодоводородной кислоты появляется резкий запах и раствор приобретает тёмную окраску.Напишите уравнения описанных реакций.
9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв.Напишите уравнения описанных реакций.
10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия.Напишите уравнения описанных реакций.
12) К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании её в присутствии диоксида марганца – газ, входящий в состав атмосферы. Напишите уравнения описанных реакций.
13)Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся при оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия. Напишите уравнения описанных реакций.
14) Раствор иодида калия обработали избытком хлорной воды, при этом сначала наблюдали образование осадка, а затем – его полное растворение. Образовавшуюся при этом йодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. полученный оксид прореагировал с угарным газом. Напишите уравнения описанных реакций.
15) Йод обработали хлорноватой кислотой. Продукт реакции осторожно нагрели. продукт реакции осторожно нагрели. Образующийся оксид реагирует с угарным газом с образованием двух веществ – простого и сложного. Простое вещество растворяется в теплом щелочном растворе сульфита натрия. Напишите уравнения описанных реакций.
16) Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль.Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль.Напишите уравнения описанных реакций.
📹 Видео
Решение цепочек превращений по химииСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

9 класс. Галогены. Решение упражнений и задач.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

9 класс.Соединения галогеновСкачать
ГАЛОГЕНЫ | Химия 9 классСкачать

1.4. Алканы: Решение цепочек. ЕГЭ по химииСкачать

9 класс. Галогены. Химические свойства.Скачать
8 класс. Цепочки превращений. Генетические ряды.Скачать

ОГЭ. Задание 21. Цепочка превращений.Скачать
Цепочки превращений по неорганической химии. Вариант №2.Скачать

Арены (бензол, толуол): цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Самые сложные органические цепочки ЕГЭ 2023 | Екатерина СтрогановаСкачать

Цепочки превращений по неорганической химии. Вариант №3.Скачать