Министерство образования Российской Федерации
- Саратовский государственный технический университет
- Саратов 2005
- ВВЕДЕНИЕ
- ОПРЕДЕЛЕНИЕ ТОЧНОЙ НОРМАЛЬНОСТИ ТРИЛОНА Б
- Методика проведения эксперимента
- ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДЫ ТРИЛОНОМЕТРИЧЕСКИМ СПОСОБОМ
- Методика проведения эксперимента
- ОПРЕДЕЛЕНИЕ НИКЕЛЯ ТРИЛОНОМЕТРИЧЕСКИМ СПОСОБОМ
- Методика проведения эксперимента
- ОПРЕДЕЛЕНИЕ МЕДИ ТРИЛОНОМЕТРИЧЕСКИМ СПОСОБОМ
- Методика проведения эксперимента
- ОПРЕДЕЛЕНИЕ МАРГАНЦА ТРИЛОНОМЕТРИЧЕСКИМ СПОСОБОМ
- Методика проведения эксперимента
- ОПРЕДЕЛЕНИЕ ЦИНКА ТРИЛОНОМЕТРИЧЕСКИМ СПОСОБОМ
- Реактивы: буферный раствор II (рН 5,5-6,0)
- Методика проведения эксперимента
- Литература
- Трилонометрический метод определения кальция и магния
- Определение общей жесткости воды
- 🌟 Видео
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Саратовский государственный технический университет
Методические указания к учебно-исследовательской работе
для студентов специальностей 0805, 0833
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Саратов 2005
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ВВЕДЕНИЕ
Бурное развитие промышленности требует усовершенствования технического контроля на предприятиях, применения быстрых и точных методов анализа, выполняемых с минимальными затратами. В последнее время в лабораторную практику начал внедряться новый метод анализа – комплексонометрия. Основные преимущества его заключаются в быстроте и высокой точности определения различных элементов, простоте аппаратуры, применяемой при анализе и небольшом расходе реактивов.
Комплексонометрия – титриметрический метод, основанный на реакциях взаимодействия определяемых ионов с некоторыми органическими реактивами, называемыми комплексонами. Ионы металлов практически мгновенно взаимодействуют с комплексонами с образованием растворимых малодиссоциированных соединений постоянного состава. Комплексоны – органические соединения, которые можно рассматривать, как производные аминополикарбоновых кислот. Простейший комплексон – нитрилуксусная кислота (НТА), известная под названием комплексон I
Наиболее распространены следующие комплексоны:
Комплексон II – этилендиаминтетрауксусная кислота (ЭДТА)
Комплексон III (трилон Б) – двунатриевая соль этилендиаминтетрауксусной кислоты:
Приведенные соединения могут образовывать с разными катионами прочные комплексные соединения, растворимые в воде. В большинстве случаев они настолько устойчивы, что в их растворах обычными аналитическими реакциями невозможно обнаружить соответствующий катион.
В молекуле комплексонов имеется несколько функциональных групп, способных одновременно связывать центральный атом комплекса несколькими координационными связями. Взаимодействие трилона Б с двухзарядным катионом можно представить так:

Трилон Б можно использовать для определения многих ионов, таких как Ca2+, Mg2+, Ba2+, Co2+, Ni2+, Zn2+ и др.
В этом руководстве описаны методы комплексонометрического анализа, внедренные в практику лабораторий ряда металлургических и машиностроительных заводов.
Студенты после выполнения каждой работы сдают отчет. Формы отчетности даны в конце описания каждой работы. После прохождения темы студенты отчитываются по теоретическому материалу по теме «комплексонометрия», вопросы по отчету приводятся в конце руководства.
СПОСОБЫ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
В комплексонометрии используют различные способы титрования: прямое и обратное титрование, титрование методом замещения, кислотно-основное (алкалиметрическое) титрование.
Прямое титрование используется, когда известен индикатор с четким переходом окраски в конечной точке. Так, например, катионы магния, бария, кальция и цинка могут быть определены трилоном Б в присутствии индикатора мурексида. В этом случае определяемый ион металла непосредственно титруют раствором комплексона. В раствор предварительно перед титрованием добавляют буферный раствор и рН раствора доводят до нужного значения.
Обратное титрование используют, когда невозможно прямое титрование, или в том случае, когда для определяемого катиона металла неизвестен индикатор с четким переходом окраски в эквивалентной точке. К анализируемому раствору прибавляют известный объем (избыток) стандартного раствора комплексона, раствор нагревают для завершения реакции и после охлаждения оттитровывают избыток комплексона раствором соли магния или цинка.
Титрование методом замещения основано на способности ионов магния образовывать с трилоном Б менее устойчивый комплекс, чем другие катионы. Поэтому, если смешать магниевый комплекс с катионами определяемого металла (например кальция), произойдет сдвиг равновесия вправо:

Выделившиеся ионы магния оттитровываются трилоном Б в присутствии хромогена черного.
При кислотно-основном титровании в процессе комплексообразования ионы металла с трилоном Б выделяется эквивалентное количество ионов водорода.
Выделившиеся ионы водорода титруют раствором щелочи в присутствии фенолфталеина.
СПОСОБЫ ФИКСИРОВАНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ И УСЛОВИЯ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
Точку эквивалентности в комплексонометрии можно определять различными способами:
1. При помощи кислотно-основных индикаторов. Так как при взаимодействии определяемого катиона с комплексоном происходит выделение ионов Н+ в количестве, эквивалентном количеству определяемого иона.
2. При помощи металл-индикаторов. Это органические красители, которые образуют с катионами определяемых элементов растворимые в воде окрашенные комплексные соединения. Эти окрашенные комплексы менее устойчивы, чем комплексы тех же катионов с трилоном Б. Поэтому при титровании раствора трилоном Б происходит связывание ионов металла комплексоном и выделение свободного индикатора, имеющего другую окраску, чем комплекс металла и индикатора. В качестве индикатора комплексонометрических титрований часто используется хромоген черный ЕТ-00.
Анион этого красителя в щелоченной среде имеет синюю окраску. С катионами металлов он образует комплексное соединение вино-красного цвета:
При титровании трилоном Б комплекс (MeInd-) разрушается, так как ионы металла связываются трилоном Б в более прочный комплекс:
винно-красный бесцветн. бесцветн. синий
Анионы 
При комплексонометрическом титровании необходимо соблюдать некоторые условия:
1. Реакция комплексообразования иона металла с комплексоном должна протекать количественно.
2. В точке эквивалентности определяемые катионы должны быть практически полностью связаны в комплекс и константа нестойкости таких комплексов должна быть очень незначительной.
3. Определяемые катионы должны образовывать с металл-индикатором комплексы, отличающиеся меньшей прочностью, чем их комплексы с комплексоном. Прочность комплексных соединений принято выражать величиной константы устойчивости соответствующего комплексного соединения. Для обозначения этой величины принято пользоваться логарифмом концентрации, взятым с обратным знаком (рК), причем чем выше значение рК, тем выше прочность соответствующего комплекса. Устойчивость комплексных соединений ионов металлов с комплексоном III зависит от рН раствора.
4. Титрование трилоном Б проводят при строго определенном рН раствора, поэтому титрование чаще всего проводят в буферных растворах. Следует также иметь в виду, что при образовании комплекса выделяются ионы водорода, которые понижают рН раствора. Поэтому, если титруемые растворы не защищены буферным раствором, то рН раствора будет понижаться и требуемые комплексные соединения могут не образовываться.
В сильно кислых растворах с рН 10 наблюдается образование оксикомплексных соединений или осадков гидроокисей определяемых катионов.
При комплексонометрическом титровании применяют различные индикаторы, главным образом красители, образующие прочные комплексы с ионами некоторых металлов (металл-индикаторы). Эти индикаторы, как правило, многоосновные кислоты. Они образуют с определяемым металлом кислые и средние соли, различающиеся между собой по окраске. Многие металлохромные индикаторы недостаточно устойчивы при хранении в водных растворах, поэтому часто приходится применять только растворы, приготовленные в день работы. Удобно также брать эти индикаторы в виде сухой смеси с хлористым натрием или азотнокислым натрием в соответствии 1:100. Смесь хорошо растворяют в ступке и перед титрованием всыпают немного в анализируемый раствор. Наибольшее распространение получили следующие индикаторы: кислотный хром темно-синий, кислотный хромоген черный специальный (эрихром черный Т или хромоген специальный ЕТ-00), мурексид, пирокатехиновый фиолетовый, ксиленоловый оранжевый и т. д.
Эрихром черный Т
Эрихром черный Т является органическим азокрасителем группы О, О´ — диоксиазонафталина. Сам индикатор окрашен в синий цвет, в нейтральной или щелочной среде при рН = 7-11 образует с ионами металлов (Cu2+, Mg2+, Zn2+, Mn2+, Al3+ и другими) соединения красного цвета.
Мурексид представляет собой темно-красный порошок. Структурную форму мурексида можно представить так:
Мурексид – аммонийная соль пурпурной кислоты. Водный растор мурексида окрашен в фиолетово-красный цвет, изменяющийся в зависимости от среды: при рН≤9 – красно-фиолетовый, рН = 9-10 – фиолетовый, рН>11 – сине-фиолетовый. С катионами кальция, кобальта, меди мурексид образует комплексы, растворимые в воде, красного или желтого цвета. В процессе титрования солей кальция и других металлов в присутствии мурексида в точке эквивалентности наблюдается изменение красного цвета раствора в сине-фиолетовый цвет.
Кислотный хром темно-синий является азокрасителем, имеет следующую формулу:
Этот индикатор окрашен в синий цвет, с катионами металлов в щелочной среде образует комплексные соединения вишнево-красного цвета. Применяют при определении цинка, кадмия, кальция, марганца и т. д.
Лабораторная работа 1
ИЗУЧЕНИЕ СВОЙСТВ МЕТАЛЛИНДИКАТОРОВ
Цель работы: изучить свойства металлиндикаторов: эриохром черный, мурексид, кислотный хром темно-синий.
Реактивы: 0,01 н растворы солей MgCl2, ZnSO4, MnSO4, CuSO4, Al(SO4)3; аммиачный буферный раствор I (рН 9,5 – 10,0 : 70 г NH4Cl растворяют в 250 мл Н2О, добавляют 250 мл аммиака с ω @ 25% и доводят объем до 1 литра).
Индикаторы: эриохром черный Т, мурексид, кислотный хром темно-синий (сухая смесь с NaCl в соотношении 1 : 100); 0,1 н
Опыт 1. Получение комплексных соединений индикатора эрихрома черного с ионами Mg2+, Zn2+, Mn2+, Al3+, Cu2+.
1. 5 мл соли MgCl2 отмерить пипеткой и поместить в колбу для титрования, добавить 2 мл буферного раствора I (аммиачный буферный раствор). Составить уравнение реакции и указать цвет полученного комплексного соединения соли с металлиндикатором.
2. Оттитровать полученную смесь Трилоном Б из бюретки до появления синей окраски. Записать объем трилона, пошедшего на реакцию, и составить уравнение реакции комплекса металлиндикатора с Повторить опыт с солями ZnSO4, MnSO4, CuSO4, Al2(SO4)3.
Опыт 2. Повторить опыт 1, используя индикатор мурексид.
Опыт 3. Повторить опыт 1, используя индикатор кислотный хром темно-синий.
Сделать вывод по результатам опыта.
Лабораторная работа 2
ПРИГОТОВЛЕНИЕ РАБОЧЕГО РАСТВОРА ТРИЛОНА Б
Цель работы: приготовить 200 мл 0,1 н раствора
1. Расчет навески
Трилон Б – динатриевая соль этилдиаминтетрауксусной кислоты (Na2C10H14O8N2):



2. Взвешивание Трилона Б
a1 – масса бокса на технических весах
а2 – теоретическая масса бюкса с навеской
а3 – масса бюкса с навеской на технических весах
3. Растворение Трилона Б
Навеску количественно перенести в мерную колбу на 200 мл и довести объем раствора в колбе до метки дистиллированной водой. Точную нормальность Трилона Б можно установить по фиксанальному раствору MgSO4.
Для установки титра Трилона Б применяют химически чистый карбонат кальция, химически чистый оксид цинка или химически чистый металлический цинк. Рассчитанную навеску этих веществ растворяют в хлористоводородной или серной кислоте, нейтрализуют NaOH или аммиаком, разбавляют аммиачным буферным раствором и тируют раствором Трилона Б в присутствии индикатора эриохром черный.
Титр раствора Трилона Б можно установить по нитрату или хлориду кальция.
Лабораторная работа 3
ПРИГОТОВЛЕНИЕ РАСТВОРА ХЛОРИДА КАЛЬЦИЯ
Цель работы: приготовить 200 мл 0,1 н раствора CaCl2
1. Расчет навески


2. Взвешивание CaCl2
а1 – масса бюкса на технических весах
а2 – теоретическая масса бюкса с навеской (а1 + 1,11)
а3 – масса бюкса с навеской на технических весах
3. Растворение CaCl2
Навеску CaCl2 количественно перенести в мерную колбу на 200 мл, растворить соль в небольшом количестве воды и довести объем до метки дистиллированной водой.
Лабораторная работа 4
ОПРЕДЕЛЕНИЕ ТОЧНОЙ НОРМАЛЬНОСТИ ХЛОРИДА КАЛЬЦИЯ
Цель работы: установить точную нормальность приготовленного раствора CaCl2 по сухому остатку.
Методика проведения анализа
1. Бюкс с крышкой взвесить на аналитических весах
а1 – масса пустого бюкса на технических весах
2. Отмерить пипеткой 10 мл CaCl2 перенести раствор во взвешенный бюкс. Поставить бюкс в сушильный шкаф (+@ 100ºС).
3. Через час поместить бюкс в эксикатор и после охлаждения взвесить
а2, а3, аn – масса бюкса с осадком
После взвешивания поставить бюкс снова в сушильный шкаф. Высушивание осадка проводить до тех пор, пока масса последующая и предыдущая не будут равны (масса аn)
4. Рассчитать массу CaCl2 в бюксе
Рассчитать нормальность CaCl2
Лабораторная работа 5
Видео:8 класс. Составление уравнений химических реакций.Скачать

ОПРЕДЕЛЕНИЕ ТОЧНОЙ НОРМАЛЬНОСТИ ТРИЛОНА Б
Цель работы: определить нормальность Трилона Б по раствору CaCl2
Видео:Химические уравнения. Урок 15. Химия 7 классСкачать

Методика проведения эксперимента
1. Отобрать пипеткой 10 мл приготовленного раствора CaCl2, добавить пипеткой 20 мл дистиллированной воды и 10 мл аммиачной буферной смеси (цилиндром) и 0,1 г индикатора «хромоген черный».
2. Бюретку заполнить 0,1 н раствором
3. Оттитровать CaCl2 Трилоном Б до прехода красной окраски в синюю. Повторить опыт 5 раз. Рассчитать Vтр (среднее).
4. Рассчитать нормальность и титр Трилона Б

Лабораторная работа 6
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДЫ ТРИЛОНОМЕТРИЧЕСКИМ СПОСОБОМ
Материалы и реактивы:
1. 0,02 н раствора
3,36 г Трилона Б растворяют в одном литре воды.
2. Буферный раствор 1 (см. лабораторную работу 1)
3. Раствор индикатора «хромоген черный»
0,5 г химически чистого препарата растворяют в 10 мл буферного раствора и доводят до 100 мл этиловым спиртом.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Методика проведения эксперимента
1. 100 мл анализируемой воды отмерить пипеткой и перенести в колбу для титрования, добавить 5 мл буферного раствора (отмерить цилиндром) и 6-7 капель индикатора «хромоген черный».
2. Бюретку заполнить 0,02 н раствором
3. Оттитровать воду Трилоном Б до перехода розово-малиновой окраски в синевато-серую.
4. Рассчитать общую жестокость воды по формуле:

где V1 – объем израсходованного Трилона Б,
Сн – нормальность Трилона Б,
V(H2O) – объем исследуемой воды, мл.
Если необходимо отдельно определить кальций и магний, сначала определяют их суммарное количество. Затем в отдельной пробе осаждают кальций в виде оксалата кальция (CaC2O4), оттитровывают ионы Mg2+ и определяют магниевую жестокость. Кальциевую жесткость определяют по разности общей и магниевой жесткости.
Определению жесткости воды этим методом мешает присутствие ионов Cu2+, Zn2+ и Mn2+. Ионы меди и цинка переводят в сульфиды прибавлением к раствору 1 мл. 2% раствора Na2S, после чего, не отделяя осадка сульфидов, титруют раствором При наличии в растворе марганца к раствору до титрования прибавляют 5 капель 1%-ного раствора соляно-кислого гидроксиламина NH2OH – HCl.
Лабораторная работа 7
Видео:Эдта - то чего ты не знал, реакция годроксида кальция и трилона Б, динатриевая соль эдтаСкачать

ОПРЕДЕЛЕНИЕ НИКЕЛЯ ТРИЛОНОМЕТРИЧЕСКИМ СПОСОБОМ
Цель работы: приготовить раствор NiSO4 и определить его точную нормальность трилонометрическим способом.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Методика проведения эксперимента
1. 0,26 г NiSO4 растворить в мерную колбу на 100 мл. Полученный раствор перелить в коническую колбу на 200 мл, добавить 10 мл аммиачного буферного раствора и 0,1 г мурексида.
2. Оттитровать 0,1 н раствором Трилона Б до перехода желтой окраски в сине-фиолетовую.
3. Рассчитать нормальность раствора NiSO4 и содержание никеля в растворе NiSO4.
Лабораторная работа 8
Видео:Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

ОПРЕДЕЛЕНИЕ МЕДИ ТРИЛОНОМЕТРИЧЕСКИМ СПОСОБОМ
Цель работы: приготовить раствор CuSO4 и определить содержание меди в нем трилонометрическим способом.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Методика проведения эксперимента
1. 0,0625 г CuSO4 растворить в мерную колбу на 100 мл, разбавить дистиллированной водой до метки. Перенести раствор в коническую колбу на 200 мл, добавить 5 мл буферного раствора II и 0,1 г индикатора глицинтимолового синего.
2. Оттитровать приготовленный раствор 0,1 н раствором Трилона Б до перехода интенсивно синей окраски раствора в желтовато-зеленую.
3. Рассчитать нормальность раствора CuSO4 и содержание меди в этом растворе.
Лабораторная работа 9
Видео:Измерение количества кальция и магнияСкачать

ОПРЕДЕЛЕНИЕ МАРГАНЦА ТРИЛОНОМЕТРИЧЕСКИМ СПОСОБОМ
Цель работы: приготовить раствор MnSO4 и определить содержание марганца трилонометрическим способом.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Методика проведения эксперимента
1. 0,22 г MnSO4 поместить в мерную колбу на 100 мл, прибавить 5 мл гидрохлорида гидроксиламина и 10 мл раствора Трилона Б (0,1 н) из бюретки, довести объем раствора до метки дистиллированной водой. Перенести раствор в коническую колбу на 200 мл, добавить 5 мл буферного раствора I и 0,1 г метилтимолового синего.
2. Оттитровать полученный раствор 0,1 н раствором Трилона Б до перехода синей окраски раствора в серую.
3. Рассчитать нормальность исходного раствора MnSO4 и содержание марганца в этом растворе.
Лабораторная работа 10
Видео:25. Схема реакции и химическое уравнениеСкачать

ОПРЕДЕЛЕНИЕ ЦИНКА ТРИЛОНОМЕТРИЧЕСКИМ СПОСОБОМ
Цель работы: приготовить раствор ZnSO4 и определить содержание цинка в нем трилонометрическим способом.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Реактивы: буферный раствор II (рН 5,5-6,0)
550 г CH3COONa · 3H2O растворяют в горячей Н2О, доводят объем раствора водой до 1 л и прибавляют 10 мл конц. CH3COOH.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Методика проведения эксперимента
1. 0,25 г ZnSO4 поместить в мерную колбу на 100 мл, довести объем раствора в колбе до 100 мл, перенести его в коническую колбу на 200 мл, прибавить 5 мл буферного раствора II и 0,1 г индикатора «эриохром черный».
2. Оттитровать полученный раствор Трилона Б до перехода красно-фиолетовой окраски раствора в синюю.
3. Рассчитать нормальность раствора ZnSO4 (100 мл) и содержание цинка в растворе.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Литература
1. Крешков аналитической химии: в 2 кн / М.: Химия, 1970. Кн 2.
2. Цитович аналитической химии / М.: Высшая школа, 1987. Гл. XXII.
3. , Жихарева анализ / , , Киев.: Гос. изд-во техн. литерат. УССР, 1962.
4. Васильев химия в 2 кн / М.: Высшая школа, 1988. Кн.1.
Методические указания к лабораторным работам
Видео:Химические уравнения. Как составлять химические уравнения.Скачать

Трилонометрический метод определения кальция и магния
Метод основан на свойстве трилона Б (двунатриевой соли этиленди-аминоуксусной кислоты) давать исключительно устойчивые комплексные соединения с ионами двухвалентных металлов, в том числе с кальцием и магнием.
Для этого метода поглощенные основания из почвы надо вытеснять 1,0 н. раствором уксуснокислого аммония при рН 6,5 или 1 н. раствором NaCl. Трилонометрический метод удобнее проводить в условиях невысоких концентраций солей. Поэтому после вытеснения поглощенных оснований разрушают уксуснокислый аммоний выпариванием раствора, затем прокаливают полученный остаток на колбонагревателе или в муфеле при 400-600°, причем получают кальций и магний в форме карбонатов или окислов. Органическое вещество при этом сгорает. Полученный осадок растворяют 10%-ной соляной кислотой и, убедившись в его полном растворении (не видно кристаллов на дне чашки), солянокислый раствор разбавляют горячей водой, фильтруют в мерную колбу емкостью на 200 мл и доводят до метки водой.
Уксуснокислый аммоний вытесняет из почвы небольшое количество полутораокисей, поэтому во многих случаях их не приходится выделять из раствора. Высокие концентрации железа мешают титрованию трилоном — переход окраски теряет четкость; кроме того, можно получить несколько завышенные данные. В таких случаях рекомендуют добавочное разбавление раствора водой для уменьшения концентрации железа либо выделение железа, если его очень много по отношению к кальцию и магнию. Это лучше сделать перед подготовкой раствора к окончательному выпариванию — выделить полутораокиси обычным способом с аммиаком, а затем довести выпаривание до конца и прокалить осадок.
Вредное влияние марганца уничтожается прибавлением солянокислого гидроксиламина (1-2 мл 5%-ного раствора), который препятствует образованию перекиси марганца, мешающей титрованию. Необходимо также устранить вредное действие меди. Все реактивы для этой цели готовятся на дистиллированной воде, не содержащей меди. Дистиллированная вода должна быть получена на аппарате, не имеющем медных частей. Вредное влияние следов меди уничтожают прибавлением к исследуемому раствору 1-2 мл 2%-ной Na2S, что переводит ее в нерастворимый сульфид меди.
Определение производится путем титрования исследуемой пробы раствором трилона Б в присутствии индикатора хромогена черного, причем в комплекс сперва связываются ионы кальция, а затем уже ионы магния. Ионы магния вызывают особенно резкий переход окраски индикатора, в то время как ионы кальция не дают четкого изменения окраски раствора, в связи с чем кальций можно определить только в присутствии магния, т. е. определить сумму кальция и магния.
Определение суммы кальция и магния. Определенную часть анализируемого раствора поглощенных оснований (удобно брать 50 мл) помещают в коническую колбу емкостью 250 мл, разбавляют водой примерно до 100 мл. Раствор подогревают до 60-70°, прибавляют для создания щелочной реакции 5 мл аммиачного буферного раствора, затем 0,5 мл Na2S и 0,5 мл гидроксиламина, 10-15 мг индикатора хромогена черного (или хрома сине-черного) и титруют 0,01 — 0,05 н. раствором трилона Б при энергичном помешивании до перехода окраски раствора от вишнево-красной через фиолетово-синюю в чисто-голубую в точке эквивалентности. При прибавлении избытка трилона окраска не меняется. Поэтому рекомендуется проводить титрование, сравнивая окраску раствора со «свидетелем» — заведомо перетитрованной пробой.
Сумма кальция и магния (в мг-экв на 100 г почвы) равна:
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ - Топ 5 Ошибок в уравнениях химических реакций // Подготовка к ЕГЭ по ХимииСкачать

Определение общей жесткости воды
Лабораторная работа №15
Тема:Приготовление и стандартизация раствора трилона Б.Определение общей жесткости воды.
Цель работы:научиться приготавливать раствор трилона Б и стандартизировать его, определять общую жесткость воды
Общие положения
Химическая формула трилона Б (кислой натриевой соли этилендиаминтетрауксусной кислоты) – Na2H2C10H12O8N2 ∙2H2O (сокращенно – Na2H2Y). Молярная масса составляет 372,30 г/моль. Число эквивалентов равно 2 (независимо от степени окисления катионов металла). Следовательно, молярная масса эквивалента трилона Б равна 1/2 моль, т.е. 186,15 г/моль. Для работы чаще всего используют растворы с молярной концентрацией эквивалента 0,01 – 0,1 моль/дм 3 .
Общая жесткость воды показывает содержание миллимоль гидрокарбонатов, сульфатов, хлоридов кальция и магния в 1 л воды.
Методика выполнения лабораторного исследования
И оформление отчета
1. Приготовление раствора трилона Б:
Для приготовления 100 мл раствора трилона Б, имеющего молярную концентрацию эквивалента 0,1 моль/дм 3 , необходимо взять навеску m тр.Б г, рассчитанную по следующей формуле:
где Nтр.Б – молярная концентрация эквивалента раствора трилона Б, моль/дм 3 ,
Этр.Б – молярная масса эквивалента трилона Б, г/моль,
Vтр.Б – объем приготовляемого раствора трилона Б, мл.
Рассчитанную навеску или близкую к ней по массе точно взвешивают на аналитических весах, переносят через воронку в мерную колбу объемом 100 мл. Пустую пробирку, после пересыпания навески, снова взвешивают на аналитических весах. Оформляют результаты взвешивания следующим образом:
mпробирки на технических весах =
mпробирки с навеской на технических весах =
mпробирки с навеской на аналитических весах =
mпробирки на аналитических весах =
Дистиллированной водой доводят объем раствора в мерной колбе до метки, предварительно полностью растворив навеску. Колбу плотно закрывают и тщательно перемешивают.
Рассчитывают титр приготовленного раствора Ттр.Б г/см 3 , по следующей формуле:
Ттр.Б = 
где mнавески – масса точная навески трилона Б, г,
Vколбы – объем мерной колбы для приготовления раствора, мл.
Далее рассчитываем нормальность приготовленного раствора Nтр.Б моль/дм 3 , по формуле:
Nтр.Б = 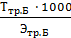
где Ттр.Б – титр приготовленного раствора трилона Б, г/см 3 ,
Этр.Б – молярная масса эквивалента трилона Б, г/моль.
Титр приготовленного раствора проверяют методом пипетирования по стандартному раствору сульфата магния (х.ч.), приготовленному из фиксанала. Молярная концентрация эквивалента раствора сульфата магния — 0,1 моль/дм 3 .
Пипеткой на 10 мл отбирают в 3 конические колбы для титрования приготовленный из фиксанала раствор сульфата магния. Затем в каждую колбу добавляют 5 мл раствора аммонийно-буферной смеси (отмеривают мерным цилиндром) и 3-4 капли спиртового раствора индикатора кислотного хрома темно-синего. Раствор окрасится в винно-красный цвет вследствие образования комплексного соединения индикатора с катионами магния.
Раствор в колбах титруют приготовленным раствором трилона Б (его заливают в бюретку) при тщательном перемешивании до перехода винно-красной окраски в сине-фиолетовую.
Для точного установления точки эквивалентности в титруемый раствор добавляют еще 1 каплю трилона Б. Появление синей окраски свидетельствует о конце титрования и о полном связывании катионов Mg 2+ в прочное внутрикомплексное соединение Na2[MgY]. Титрование проводят 3 раза и находят средний объем трилона Б.
Молярную концентрацию эквивалента трилона Б N(Nа2Н2Y) моль/дм 3 , вычисляют по формуле:
где V(Nа2Н2Y) – объем трилона Б, пошедший на титрование, мл,
N(MgSО4) – молярная концентрация эквивалента раствора магний сульфата, моль/дм 3 ,
V(MgSО4) – аликвотный объем раствора сульфата магния, мл.
Выразив из этой формулы N(Nа2Н2Y), получаем:
Расчет титра трилона Б Т(Nа2Н2Y) г/см 3 , производим по следующей формуле:
где N(Nа2Н2Y) — молярная концентрация эквивалента раствора трилона Б, моль/дм 3 ,
М(1/2Nа2Н2Y) — молярная масса эквивалента трилона Б, г/моль.
Результаты анализа сводят в таблицу:
| Величина | Значение |
| Объем раствора MgSО4, см 3 | |
| Объем раствора трилона Б, см 3 1-е титрование 2-е титрование 3-е титрование | |
| Средний объем раствора трилона Б, см 3 | |
| N(MgSО4), моль/дм 3 | |
| N(Nа2Н2Y), моль/дм 3 | |
| Т(Nа2Н2Y), г/см 3 |
Определение общей жесткости воды.
В коническую колбу на 250 мл вносят 100 мл исследуемой воды, отмеренной мерной колбой (мутную воду предварительно фильтруют).
Затем прибавляют 5 мл аммонийно-буферной смеси, 5-7 капель спиртового раствора индикатора кислотного хрома темно-синего и титруют раствором трилона Б. К концу титрования раствор трилона Б прибавляют по каплям, тщательно встряхивая смесь в колбе. Титрование продолжают до изменения вишнево-красной окраски раствора в фиолетовую и от одной капли – в синюю.
Определение проводят три раза. Результаты заносят в таблицу 1. Если на титрование 100 мл воды расходуется больше 5 мл раствора трилона Б с N(Nа2Н2Y) = 0,1моль/дм 3 , то это указывает, что в отмеренном объеме воды суммарное содержание кальция, магния больше 0,5 ммоль/л.
В таких случаях определение следует повторить, взяв меньший объем воды и разбавив его в мерной колбе до 100 мл дистиллированной водой.
Нечеткое изменение окраски раствора в точке эквивалентности указывает на присутствие в воде катионов Cu 2+ , Zn 2+ , Mn 2+ , мешающих определению. Для устранения влияния мешающих катионов к отмеренной для титрования пробе воды прибавляют 1-2 мл раствора сульфида натрия с массовой доле й Na2S = 1,5 – 2%. После этого, не отделяя осадка сульфидов меди (II), цинка, марганца (II), проводят титрование раствором трилона Б.
Общую жесткость воды Жо мг-экв/л, вычисляют по следующей формуле:
где NNа2Н2Y – нормальность трилона Б, моль/дм 3 ,
VNа2Н2Y – объем трилона Б, израсходованного на титрование, мл,
100 – объем воды, взятый на титрование, мл;
1000 – 1 л воды, в котором определяют жесткость воды.
Результаты определения свести в таблицу.
| Величина | Значение |
| Объем мерной колбы, мл | |
| Объем раствора трилона Б, см 3 1-е титрование 2-е титрование 3-е титрование | |
| Средний объем раствора трилона Б, см 3 | |
| N(Nа2Н2Y), моль/дм 3 | |
| Общая жесткость воды, мг-экв/л |
1. Перечислите известные вам комплексоны.
2. Объясните сущность метода комплексонометрии.
3. Объясните сущность методики общей жесткости воды.
4. Опишите условия титрования трилона Б.
5. Объясните, как фиксируется точка эквивалентности в комплексонометрии.
6. Объясните, что показывает общая жесткость воды.
7. Составьте уравнения реакций, характеризующих общую жесткость воды.
8. Установите преимущества метода комплексонометрии перед другими методами титриметрического анализа.
9. Составьте уравнение реакции, протекающей между трилоном Б и сульфатом магния.
10. Обоснуйте необходимость добавления аммонийно-буферной смеси к титруемому раствору в методе комплексонометрии.
11. Приведите способы расчета титра и нормальности трилона Б.
1. Жванко, Ю. Н. Аналитическая химия и технохимический контроль в общественном питании / Ю. Н. Жванко, Г. В. Панкратова, З. И. Мамедова. – М.: Высшая школа, 1980. – с. 114 – 118.
2. Шапиро, М. А. Аналитическая химия: учебник / М. А. Шапиро, С. А. Шапиро. – М.: Высшая школа, 1979. – с.279 – 281.
🌟 Видео
Химия | Молекулярные и ионные уравненияСкачать

















