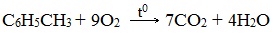Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- Уравнивание окислительно-восстановительных реакций с участием органических веществ методом электронного баланса. статья по химии (11 класс) по теме
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- Толуол с перманганатом калия в кислой среде уравнение реакции
- Реакции замещения
- Реакции присоединения
- Реакции окисления
- 🔍 Видео
Видео:Синтез БЕНЗОЙНОЙ КИСЛОТЫ из ТОЛУОЛА. Реакция ПЕРМАНГАНАТА КАЛИЯ и ТОЛУОЛА. Опыты по химии дома.Скачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать

1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
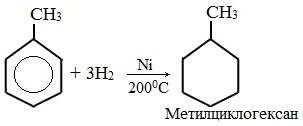
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
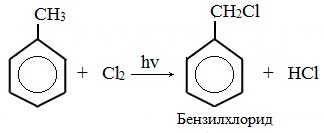
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:ОВР с перманганатом калия.Скачать

2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
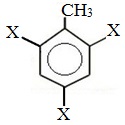
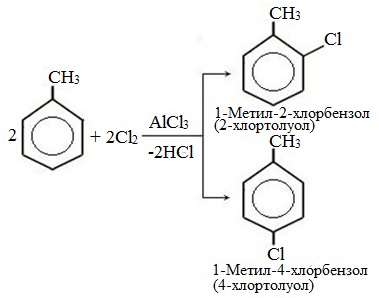
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
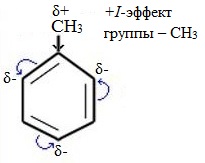
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
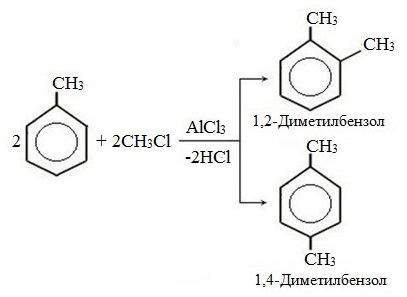
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
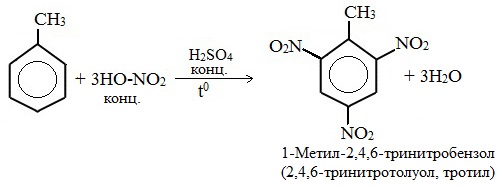
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:Окисление толуола в кислой, нейтральной и щелочной средеСкачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
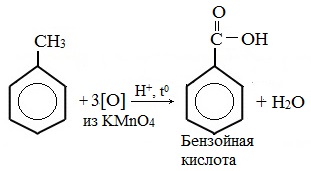
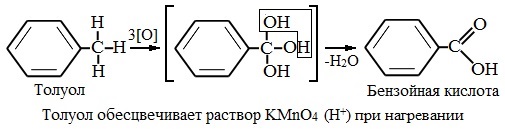
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
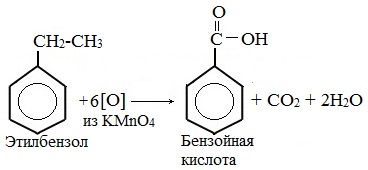
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

Уравнивание окислительно-восстановительных реакций с участием органических веществ методом электронного баланса.
статья по химии (11 класс) по теме
В статье обсуждается возможность описания ОВР с участием органических веществ с помощью метода электронного баланса. Также даны рекомендации по составлению уравнений реакций.
Видео:Окисление органических соединений перманганатом калияСкачать

Скачать:
| Вложение | Размер |
|---|---|
| Uravnivanie_OVR_statya.doc | 35 КБ |
Видео:Реакция этилена с раствором перманганата калияСкачать

Предварительный просмотр:
Уравнивание окислительно-восстановительных реакций с участием органических веществ методом электронного баланса.
Реакции окисления органических веществ часто встречаются в базовом курсе химии. При этом, их запись обычно представляется в виде несложных схем, часть из которых дает лишь общее представление о превращениях веществ различных классов друг в друга, не учитывая конкретных условий протекания процесса (например, реакции среды), которые влияют на состав продуктов реакции. Между тем, требования ЕГЭ по химии в части С таковы, что возникает необходимость записи именно уравнения реакции с определенным набором коэффициентов. В данной работе приведены рекомендации по методике составления таких уравнений.
Для описания окислительно-восстановительных реакций применяют два метода: метод электронно-ионных уравнений и метод электронного баланса. Не останавливаясь на первом, отметим, что метод электронного баланса изучается в курсе химии основной школы и поэтому вполне применим для продолжения изучения предмета.
Уравнения электронного баланса прежде всего описывают процессы окисления и восстановления атомов. Кроме этого, специальные множители указывают на коэффициенты перед формулами веществ, содержащих атомы, которые участвовали в процессах окисления и восстановления. Это, в свою очередь, позволяет находить остальные коэффициенты.
Пример 1. Окисление толуола перманганатом калия в кислой среде.
C 6 H 5 -CH 3 + KMnO 4 + H 2 SO 4 = …
Известно, что боковые метильные радикалы аренов обычно окисляются до карбоксила, поэтому в данном случае образуется бензойная кислота. Перманганат калия в кислой среде восстанавливается до двузарядных катионов марганца. Учитывая наличие сернокислотной среды, продуктами будут сульфат марганца (II) и сульфат калия. Кроме того, при окислении в кислой среде образуется вода. Теперь схема реакции выглядит так:
C 6 H 5 -CH 3 + KMnO 4 + H 2 SO 4 = C 6 H 5 COOH + MnSO 4 + K 2 SO 4 + H 2 O
Из схемы видно, что изменяется состояние атома углерода в метильном радикале, а также атома марганца. Степени окисления марганца определяются по общим правилам подсчета: в перманганате калия +7, в сульфате марганца +2. Степени окисления атома углерода можно легко определить исходя из структурных формул метильного радикала и карбоксила. Для этого нужно рассмотреть смещение электронной плотности исходя из того, что по электроотрицательности углерод занимает промежуточное положение между водородом и кислородом, а связь С-С формально считается неполярной. В метильном радикале атом углерода притягивает три электрона от трех атомов водорода, поэтому его степень окисления равна -3. В карбоксиле атом углерода отдает два электрона карбонильному атому кислорода и один электрон атому кислорода гидроксильной группы, поэтому степень окисления атома углерода +3.
Уравнение электронного баланса:
Mn +7 + 5e = Mn +2 6
Перед формулами веществ, содержащих марганец необходим коэффициент 6, а перед формулами толуола и бензойной кислоты – 5.
5C 6 H 5 -CH 3 +6 KMnO 4 + H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + K 2 SO 4 + H 2 O
Далее уравниваем число атомов калия:
5C 6 H 5 -CH 3 +6 KMnO 4 + H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + H 2 O
И число атомов серы:
5C 6 H 5 -CH 3 +6 KMnO 4 +9H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 +3K 2 SO 4 + H 2 O
На заключительном этапе необходим коэффициент перед формулой воды, который можно вывести подбором по числу атомов водорода или кислорода:
5C 6 H 5 -CH 3 +6 KMnO 4 + H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + K 2 SO 4 + 14H 2 O
Пример 2. Реакция «серебряного зеркала».
Большинство литературных источников указывают, что альдегиды в этих реакциях окисляются до соответствующих карбоновых кислот. При этом окислителем служит аммиачный раствор оксида серебра (I) – Ag 2 O амм.р-р. В действительности реакция протекает в щелочной аммиачной среде, поэтому должна образовываться соль аммония или СО 2 в случае окисления формальдегида.
Рассмотрим окисление уксусного альдегида реактивом Толленса:
CH 3 CHO + Ag(NH 3 ) 2 OH = …
При этом продуктом окисления будет ацетат аммония, а продуктом восстановления – серебро:
CH 3 CHO + Ag(NH 3 ) 2 OH = CH 3 COONH 4 + Ag + …
Окислению подвергается атом углерода карбонильной группы. Согласно строению карбонила, атом углерода отдает два электрона атому кислорода и принимает один электрон от атома водорода, т.е. степень окисления углерода +1. В карбоксильной группе ацетата аммония атом углерода отдает три электрона атомам кислорода и имеет степень окисления +3. Уравнение электронного баланса:
Ag +1 + 1e = Ag 0 2
Поставим коэффициенты перед формулами веществ, содержащих атомы углерода и серебра:
CH 3 CHO + 2Ag(NH 3 ) 2 OH = CH 3 COONH 4 + 2Ag + …
Из четырех молекул аммиака в левой части уравнения, одна будет участвовать в солеобразовании, а три оставшиеся выделяются в свободном виде. Также в составе продуктов реакции будет вода, коэффициент перед формулой которой можно найти подбором (1):
CH 3 CHO + 2Ag(NH 3 ) 2 OH = CH 3 COONH 4 + 2Ag + H 2 O
В заключение отметим, что альтернативный способ описания ОВР – метод электронно-ионных уравнений — при его преимуществах, требует дополнительное учебное время для изучения и отработки, которое, как правило, крайне ограничено. Однако и известный метод электронного баланса при его грамотном использовании приводит к требуемым результатам.
Видео:Окисление Этанола Перманганатом Калия В Сернокислой Среде.Скачать

По теме: методические разработки, презентации и конспекты
Разработка урока по теме «Окислительно- восстановительные реакции с участием органических веществ»
Данная разработка успешно применяется при проведении факультативных занятий,а также при подготовке учащихся к сдаче единого государственного экзамена по химии.
Презентация «Упражнение в расстановке коэффициентов методом электронного баланса»
В презентации представлен алгоритм расстановки коэффициентов методом электронного баланса, а также 18 схем реакций для упражнений в расстановке коэффициентов с проверкой.
Конспект урока «Составление уравнений окислительно-восстановительных реакций методом электронного баланса» (Химия, 8 класс)
Цель урока: обеспечение условий для самостоятельного вывода учащимися и применения ими на практике алгоритма по составлению ОВР методом электронного баланса. Прилагается презентация.
Составление уравнений окислительно – восстановительных реакций методом электронного баланса.
Конспект урока по теме «Составление уравнений окислительно- восстановительных реакций методом электронного баланса».
ИСПОЛЬЗОВАНИЕ МЕТОДА ПОЛУРЕАКЦИЙ В РЕАКЦИЯХ С УЧАСТИЕМ ОРГАНИЧЕСКИХ ВЕЩЕСТВ.
В методическом материале подробно описан метод полуреакций, необходимый для расстановки коэффициентов в органических веществах.
9 класс Тема: «Составление уравнений окислительно-восстановительных реакций методом электронного баланса»
Тема: «Составление уравнений окислительно-восстановительных реакций методом электронного баланса».
Окислительно-восстановительные реакции с участием органических веществ. Алкены. Алкины. Арены. Кислородсодержащие вещества (для педагогов и учащихся)
В связи с введением для выпускников средней школы единого государственного экзамена (ЕГЭ) все большую актуальность приобретает подготовка старшеклассников к выполнению наиболее “дорогих” в балльном от.
Видео:Выделение ТОЛУОЛА из растворителя фирмы АРИКОНСкачать

Толуол с перманганатом калия в кислой среде уравнение реакции
Все реакции толуола (метилбензола) можно подразделить на два типа: реакции, затрагивающие бензольное кольцо и реакции, затрагивающие метильную группу.
Реакции замещения
1. Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большой скоростью.
Метильный радикал, содержащийся в молекуле толуола, является ориентантом I рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара- производные толуола или при избытке реагента – трипроизводные общей формулы:
а) галогениерование
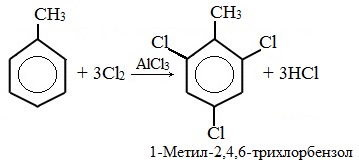
При избытке галогена можно получить ди- и три-замешенные производные в соответствии с правилами ориентации:
б) нитрование
Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях:
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4.
в) сульфирование
г) алкилирование
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π- электронной системой бензольного кольца:
Реакции присоединения
а) гидрирование
Реакции окисления
а) горение
б) неполное окисление
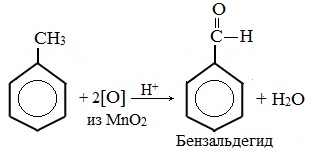
В отличие от бензола его гомологи подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом, в случае толуола — метильная группа. Мягкие окислите (MnО2) окисляют ее до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании).
Любой гомолог бензола с одной боковой цепью окисляется KMnO4 и другим сильным окислителем в бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
🔍 Видео
6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Задание 29 ОВР: перманганат калия в разных средах - видимые признаки реакций | Химия ЕГЭ | УМСКУЛСкачать

Окисление гомологов бензола в кислой средеСкачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Окисление алкенов с Тасей | Химия ЕГЭСкачать

Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

Получение хлората калия, бертолетовой соли из отбеливателя (химия)Скачать

Арены: реакции окисления | Химия 10 класс | УмскулСкачать

Химия ЕГЭ 2022 / Задание 32Скачать