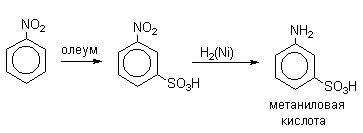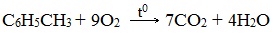Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
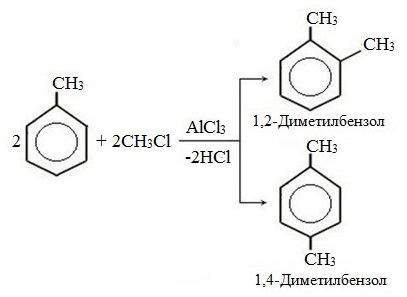
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- Сульфирование бензола и его производных
- Толуол с концентрированной серной кислотой уравнение
- Реакции замещения
- Реакции присоединения
- Реакции окисления
- 💡 Видео
Видео:Концентрированная серная кислота и ее особые свойства | Химия ЕГЭ | УмскулСкачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать

1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
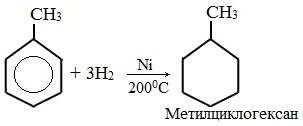
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
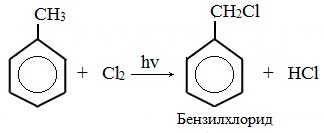
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
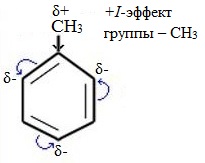
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
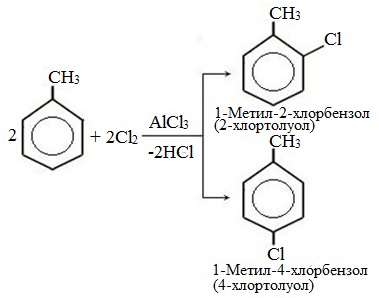
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
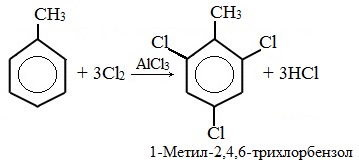
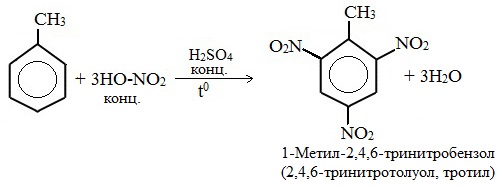
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
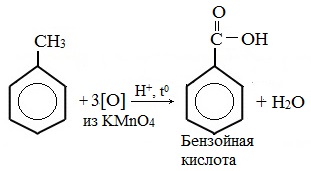
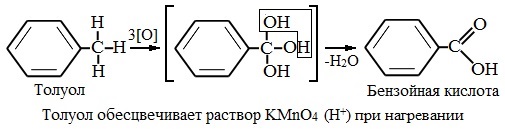
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
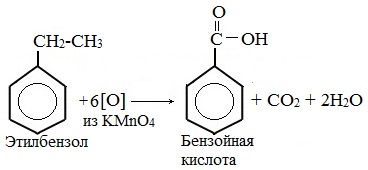
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать

4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

Видео:Взаимодействие сахара с концентрированной серной кислотойСкачать

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:Изучаем химические свойства концентрированной серной кислоты!Скачать

Сульфирование бензола и его производных
СУЛЬФИРОВАНИЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
Замещение водорода в ядре ароматических соединений на сульфогруппу идет значительно легче, чем в соединениях жирного ряда; поэтому реакция сульфирования наряду с реакцией нитрования является одной из характерных для ароматических соединений. Сульфирование ароматических соединений идет несколько труднее, чем нитрование, и требует более жестких условий. Гомологи бензола (толуол, ксилолы) сульфируются легче, чем сам бензол; еще легче сульфируются фенолы и анилин.
Сульфопроизводные ароматических соединений находят широкое применение при синтезе ряда красителей и лекарственных веществ.
Реакция сульфирования осуществляется концентрированной серной кислотой или олеумом (олеум – это раствор серного ангидрида в безводной серной кислоте). В процессе реакции водородный атом замещается сульфогруппой, приводя к моносульфокислоте.


Сульфирование
Введение в ароматическое соединение группы SO3H называется сульфированием, а образующиеся продукты называются аренсульфокислотами.
Сульфирование широко используется в промышленном синтезе органических красителей, поверхностно-активных веществ, сульфамидных препаратов и других физиологически активных соединений. В качестве сульфирующего агента чаще всего употребляют 98-100%-ную серную кислоту (моногидрат), 92-94%-ную кислоту (купоросное масло), а также олеум, содержащий от 20-60% серного ангидрида, растворенного в безводной серной кислоте; иногда для сульфирования используют растворы SO3 в SO2 (жидк.) и SO3 в хлористом метилене. Эффективным сульфирующим агентом является хлорсульфоновая кислота (монохлорангидрид серной кислоты), которую получают при взаимодействии серного ангидрида и хлористого водорода. Сульфирование ароматических соединений хлорсульфоновой кислотой представляет собой двухстадийный процесс. На первой стадии образуется сульфокислота.
Далее она взаимодействует с хлорсульфоновой кислотой с образованием сульфохлорида.
Для того, чтобы сместить равновесие вправо, необходимо использовать 4-5-кратный избыток ClSO3H. Для сульфирования ароматических соединений, содержащих электронодонорные заместители, а также пятичленных ароматических гетероциклических соединений — фурана, пиррола, тиофена и др., нестабильных в сильнокислой среде, используют комплексы серного ангидрида с пиридином, диоксаном или диметилформамидом.
Важной особенностью реакции сульфирования является ее обратимость. Ароматические сульфокислоты расщепляются перегретым водяным паром в кислой среде при 110-180 о С (протодесульфирование представляет собой реакцию электрофильного ароматического ипсо-замещения). На этом свойстве сульфогруппы основано ее использование в качестве защитной группы в синтезе различных полизамещенных бензолов. Например, сульфогруппой можно защитить пара-место бензольного кольца в толуоле, анизоле, анилине и феноле.
Механизм сульфирования
До сих пор нет единого мнения относительно истинной природы электрофильного агента сульфирования. Данные кинетических измерений не дают однозначного ответа на этот вопрос, поскольку в водной и безводной серной кислоте содержится большое число потенциальных электрофильных агентов, относительная концентрация которых зависит от отношения H2O/SO3.
При концентрации серной кислоты ниже 80% устанавливаются главным образом следующие равновесия:

При более высокой концентрации серной кислоты в интервале 85-98% состояние серной кислоты в основном описывается уравнениями
В 100%-ной серной кислоте и в олеуме помимо H2S2O7 существуют и другие полисерные кислоты — H2S3O10; H2S4O13 и т.д. Все это крайне затрудняет интерпретацию данных по кинетике сульфирования.
В водной серной кислоте при концентрации ниже 80% скорость сульфирования линейно коррелирует с активностью иона H3SO4+ . При концентрации серной кислоты выше 85% наблюдается линейная корреляция с активностью H2S2O7. Эти две частицы, по-видимому, и есть два главных реальных электрофильных агента сульфирования ароматических соединений в водной серной кислоте. Их можно рассматривать как молекулу SO3, координированную соответственно с ионом H3O+ или серной кислотой. При переходе от 85%-ной к 100%-ной серной кислоте концентрация иона H3O+ резко уменьшается, а концентрация H2SO4 увеличивается. В 91%-ной кислоте [H3SO4+ ] = [H2S2O7], но так как H2S2O7 (SO3 . H2SO4) более сильный электрофильный агент, чем H3SO4+ (H3O+ . SO3), он доминирует как электрофил не только в 91%-ной, но даже и в 85%-ной серной кислоте.
Таким образом, механизм сульфирования может быть представлен, по-видимому, следующим образом:
Кинетический изотопный эффект kH/kD при концентрации серной кислоты ниже 95% пренебрежимо мал. Но при сульфировании 98-100%-ной H2SO4 или олеумом наблюдается кинетический изотопный эффект kH/kD в диапазоне 1.15-1.7, т.е. определяющей скорость стадией становится уже стадия (2). При концентрации серной кислоты ниже 95% протон от 
В олеуме скорость сульфирования резко возрастает. Электрофильным агентом в этом случае, по-видимому, является не связанный в комплекс SO3. Медленной является стадия (2).
Предположение о наличии нескольких активных частиц сульфирования позволяет объяснить изменение не только скорости, но и ориентации при сульфировании серной или олеумом. Катион H3SO4+ и H2S2O7 должны обладать более высокой селективностью по сравнению с SO3.
При рассмотрении экспериментальных данных по распределению изомерных продуктов сульфирования необходимо иметь в виду, что эта реакция подчиняется не кинетическому, а термодинамическому контролю. Поэтому соотношение орто-, мета- и пара-изомеров при изменении температуры меняется не только потому, что константы скорости сульфирования в орто-, мета- и пара-положения бензольного кольца по-разному меняются с ростом температуры, но и потому, что положение равновесия всех этих процессов также очень сильно зависит от температуры. Так, например, при сульфировании фенола до моносульфокислоты образуется смесь орто- и пара-гидроксибензолсульфокислот. При 20 о С образуется приблизительно равное количество орто- и пара-изомеров. Однако при сульфировании фенола при 100 о С в реакционной смеси преобладает пара-изомер. При нагревании смеси орто- и пара-изомеров в 80-90%-ной серной кислоте также накапливается пара-изомер. Это объясняется тем, что скорость протодесульфирования орто-изомера больше, чем пара-изомера. орто-Гидроксибензолсульфокислота не только образуется быстрее, но и расщепляется обратно до фенола с большей скоростью; пара-гидроксибензолсульфокислота медленнее образуется, но и медленнее расщепляется. Образование орто-изомера при сульфировании фенола 92-98%-ной серной кислотой при 0 о С (условия кинетического контроля сульфирования) указывает на то, что скорость обратной реакции протодесульфирования в этих условиях очень мала. Таким образом пара-изомер при термодинамическом контроле сульфирования фенола становится доминирующим продуктом этой реакции.
Аналогично толуол при сульфировании 100%-ной серной кислотой при 0 о С дает 43% орто-, 4% мета- и 53% пара-толуолсульфокислоты, тогда как при 100 о С в равновесных условиях наблюдается совершенно иное распределение изомеров: 13% орто-, 8% мета- и 79% пара-толуолсульфокислоты.
Другим классическим примером проявления термодинамического контроля является сульфирование нафталина
В очень мягких условиях образуется только 1-нафталинсульфокис-лота. Этому условию отвечает сульфирование нафталина хлорсульфоновой кислотой или раствором SO3 в дихлорэтане при 0 о -(-10 о С). Соотношение изомеров при сульфировании 96%-ной серной кислотой зависит от температуры: в более жестких условиях преобладает термодинамически более стабильная 2-нафталинсульфо-кислота.
Сульфирование бензола и его производных
Бензол при действии 92-94%-ной серной кислоты при 40-50 о С образует бензолсульфокислоту с выходом 90-96%. Введение одной сульфогруппы уменьшает скорость реакции введения второй сульфогруппы в 10 4 раз, поэтому мета-бензолсульфо-кислота получается при сульфировании бензола в жестких условиях избытком 20%-ного олеума при 100 о С или 60%-ного олеума при 60-80 о С. Длительное нагревание мета-бензолсульфокислоты с 90%-ной серной кислотой при 235 о С приводит к равновесной смеси, состоящей из 66% мета- и 34% пара-бензолсульфокислоты.
Дальнейшее сульфирование мета-бензолдисульфокислоты до 1,3,5-бензолтрисульфокислоты удается провести только с 60%-ным олеумом при 250 о С в присутствии сульфата ртути. Толуол сульфируется в несколько раз быстрее бензола. При этом, как правило, образуется смесь всех трех изомерных толуолсульфокислот.
пара-Толуолсульфокислота плохо растворима в конц.HCl и может быть выделена в чистом виде путем насыщения конц. водного раствора смеси полученных сульфокислот хлористым водородом.
Сульфирование хлорбензола и других галогенбензолов протекает в десять раз медленнее, чем сульфирование бензола, в результате образуется пара-хлорбензолсульфокислота, почти не содержащая орто-изомера.
Нитробензол сульфируется 60%-ным олеумом при 80-100 о С исключительно до мета-нитробензолсульфокислоты.
Пара-нитротолуол, как и следовало ожидать, образует при сульфировании 20%-ным олеумом 4-нитро-2-толуолсульфокислоту.
Сульфированием ароматических аминов получают аминосульфокислоты. Аминогруппа является одним из сильнейших электронодонорных ориентантов I-го рода, однако в 90-100%-ной серной кислоте или олеуме она протонируется, причем равновесие практически нацело смещено в сторону протонированной формы. Аммониевая группа NH3+ относится к сильным электроакцепторным заместителям, вызывающим резкое замедление реакции сульфирования и ориентирующим входящий электрофил в мета-положение.
В промышленности метаниловую кислоту получают восстановлением мета-нитробензолсульфокислоты.
Для получения орто- и пара-аминобензолсульфокислот используют обходный метод, который носит название «реакции запекания». Эту реакцию осуществляют при длительном нагревании гидросульфатов ароматических аминов при 100-200 о С в сухом виде или в высококипящих органических растворителях, обычно в орто-дихлорбензоле. При температуре около 100 о С образуется практически чистый орто-изомер (ортаниловая кислота, продукт кинетического контроля), а при 180-200 о С — пара-изомер (сульфаниловая кислота, продукт термодинамического контроля).
Кроме того, имеются данные, что при высоких температурах может протекать конкурентный процесс образования сульфаминовой кислоты, которая затем изомеризуется с переходом сульфогруппы в пара-положение кольца.
Видео:Серная кислота и ее соли. 9 класс.Скачать

Толуол с концентрированной серной кислотой уравнение
Все реакции толуола (метилбензола) можно подразделить на два типа: реакции, затрагивающие бензольное кольцо и реакции, затрагивающие метильную группу.
Реакции замещения
1. Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большой скоростью.
Метильный радикал, содержащийся в молекуле толуола, является ориентантом I рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара- производные толуола или при избытке реагента – трипроизводные общей формулы:
а) галогениерование
При избытке галогена можно получить ди- и три-замешенные производные в соответствии с правилами ориентации:
б) нитрование
Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях:
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4.
в) сульфирование
г) алкилирование
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π- электронной системой бензольного кольца:
Реакции присоединения
а) гидрирование
Реакции окисления
а) горение
б) неполное окисление
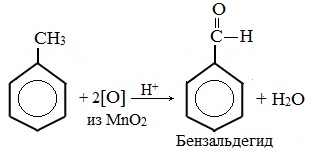
В отличие от бензола его гомологи подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом, в случае толуола — метильная группа. Мягкие окислите (MnО2) окисляют ее до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании).
Любой гомолог бензола с одной боковой цепью окисляется KMnO4 и другим сильным окислителем в бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
💡 Видео
Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Нитрование разных производных бензола. Химический опытСкачать

Выделение ТОЛУОЛА из растворителя фирмы АРИКОНСкачать

Правило разбавления концентрированной серной кислоты водойСкачать

Опыты по химии. Обугливание сахара концентрированной серной кислотойСкачать

Реакция концентрированной серной кислоты с серойСкачать

Окислительные свойства концентрированной серной кислотыСкачать

Взаимодействие сахара с концентрированной серной кислотой - 9 - 11 классСкачать

Опыты по химии. Обугливание лучины в концентрированной серной кислотеСкачать

Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Реакция Концентрированной Серной Кислоты и Хлората Натрия. Реакция H2SO4 и NaClO3. Выделение ClO2.Скачать

Взаимодействие серной кислоты с металламиСкачать