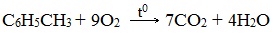Все реакции толуола (метилбензола) можно подразделить на два типа: реакции, затрагивающие бензольное кольцо и реакции, затрагивающие метильную группу.
- Реакции замещения
- Реакции присоединения
- Реакции окисления
- Химические свойства аренов
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- Физико-химические свойства толуола, уравнения реакций
- Немного истории
- Общие сведения
- Основные химические свойства
- Образование бензойной кислоты
- Получение вещества
- Толуол и бензол
- Реакция Фриделя-Крафтса
- Пожарная опасность
- Опасность для человека
- Применение
- 🎦 Видео
Реакции замещения
1. Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большой скоростью.
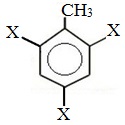
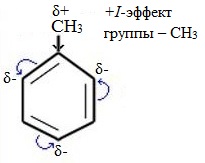
Метильный радикал, содержащийся в молекуле толуола, является ориентантом I рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара- производные толуола или при избытке реагента – трипроизводные общей формулы:
а) галогениерование
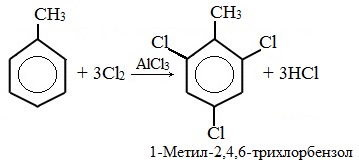
При избытке галогена можно получить ди- и три-замешенные производные в соответствии с правилами ориентации:
б) нитрование
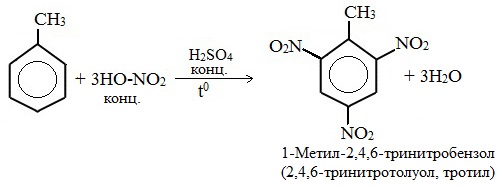
Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях:
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4.
в) сульфирование
г) алкилирование
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π- электронной системой бензольного кольца:
Реакции присоединения
а) гидрирование
Реакции окисления
а) горение
б) неполное окисление
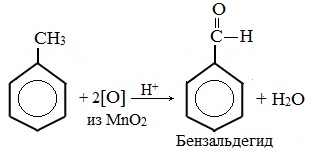
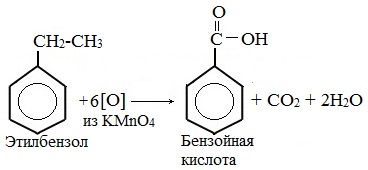
В отличие от бензола его гомологи подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом, в случае толуола — метильная группа. Мягкие окислите (MnО2) окисляют ее до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании).
Любой гомолог бензола с одной боковой цепью окисляется KMnO4 и другим сильным окислителем в бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
Видео:Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать

Химические свойства аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Видео:Синтез БЕНЗОЙНОЙ КИСЛОТЫ из ТОЛУОЛА. Реакция ПЕРМАНГАНАТА КАЛИЯ и ТОЛУОЛА. Опыты по химии дома.Скачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:Опыты по химии. Соляная кислота и металлыСкачать

1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
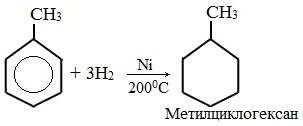
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
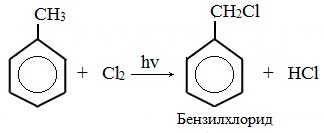
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:Хлороводородная кислота. 9 класс.Скачать

2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
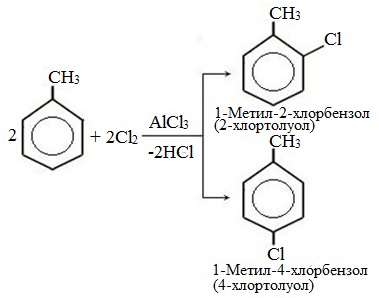
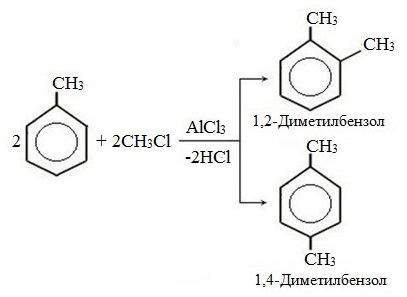
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:Реакция Соляной Кислоты, Дихромата Аммония и Сульфита Натрия. Реакция HCl, (NH4)2Cr2O7 и Na2SO3.Скачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
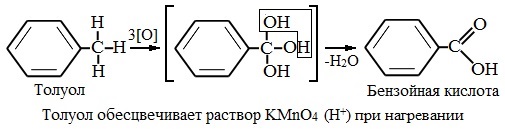
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
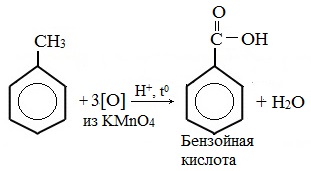
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:Алюминий против соляной кислоты #химия #опыты #кислоты #scienceСкачать

Физико-химические свойства толуола, уравнения реакций
Толуол – это метилбензол, представляющий собой бесцветную жидкость, относящуюся к классу аренов, которые являются органическими соединениями с ароматической системой в составе.
Ключевой особенностью данного вещества можно считать его специфический запах. Впрочем, это не единственная «отличительная черта» вещества. Свойств и характеристик у толуола много, и обо всех них стоит вкратце рассказать.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Немного истории
Химические свойства толуола начали изучать чуть меньше 200 лет тому назад, когда его и получили впервые. Вещество обнаружил в 1835 году французский фармацевт и химик Пьер Жозеф Пеллетье. Ученый получил толуол при перегонке сосновой смолы.
А спустя три года французский физикохимик Анри Сент-Клер Девиль выделил данное вещество из бальзама, который он привез из колумбийского города Толу. В честь этого напитка, собственно говоря, соединение и получило свое название.
Видео:Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

Общие сведения
Что можно сказать о характеристиках и химических свойствах толуола? Вещество представляет собой летучую подвижную жидкость с резким запахом. Оказывает легкое наркотическое действие. Реагирует с неограниченным количеством углеводородов, взаимодействует с простыми и сложными эфирами, со спиртами. С водой не смешивается.
- Вещество обозначается формулой С7Н8.
- Его молярная масса равна 92,14 г/моль.
- Плотность составляет 0,86694 г/см³.
- Температуры плавления и кипения равны −95 ℃ и 110,6 ℃ соответственно.
- Удельная теплота испарения составляет 364 кДж/кг.
- Критическая температура фазового перехода равна 320 °C.
Еще это вещество отличается горючестью. Сгорает коптящим пламенем.
Видео:Получение бензойной кислоты (synthesis of benzoic acid) C6H5COOHСкачать

Основные химические свойства
Толуол – это вещество, которому свойственны реакции электрофильного замещения. Они происходят в так называемом ароматическом кольце, проявляющим анормально высокую стабильность. Эти реакции идут, в основном, в пара- и орто-положениях относительно метильной группы -CH3.
Относятся к химическим свойствам толуола реакции озонолиза и присоединения (гидрирование). Под воздействием некоторых окислителей метильная группа становится карбоксильной. Чаще всего для этого используется щелочной раствор калийного перманганата или неконцентрированная азотная кислота.
Еще стоит отметить, что толуол способен самовоспламеняться. Для этого необходима температура в 535 °C. Вспышка происходит при 4 °C.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Образование бензойной кислоты
Способность обсуждаемого вещества участвовать в этом процессе также обусловлена его химическими свойствами. Толуол, реагируя с сильными окислителями, образует простейшую одноосновную бензойную карбоновую кислоту, относящуюся к ароматическому ряду. Ее формула – С6Н5СООН.
Кислота имеет вид белых кристаллов, которые хорошо растворяются в диэтиловом эфире, хлороформе и этаноле. Ее получают посредством следующих реакций:
- Толуол и перманганат калия, взаимодействующие в кислой среде. Формула следующая: 5С6Н5СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5СООН + 6MnSO4 + 3K2SO4 + 14Н2О.
- Толуол и перманганат калия, взаимодействующие в нейтральной среде. Формула такая: С6Н5СН3 + 2KMnO4 → С6Н5СООК + 2MnO2 + КОН + Н2О.
- Толуол, взаимодействующий на свету с галогенами, энергичными окислителями. Происходит по формуле: С6Н5СН3 + Х2 → С6Н5СН2Х + НХ.
Полученная вследствие этих реакций бензойная кислота применяется во многих сферах. В основном ее используют для получения реактивов – бензоилхлорида, бензоатных пластификаторов, фенола.
Также ее применяют при консервировании. Добавки Е213, Е212, Е211 И Е210 изготовлены именно на основе бензойной кислоты. Она блокирует ферменты и замедляет обмен веществ, подавляет рост дрожжей, плесени и бактерий.
А еще бензойная кислота используется в медицине для лечения кожных заболеваний, и как отхаркивающее средство.
Видео:Реакция Хлората Натрия и Соляной Кислоты. Реакция NaClO3 и HCl. Выделение Хлора.Скачать

Получение вещества
Демонстрирующие химические свойства толуола уравнения реакций, представленные выше – это еще не все, что хотелось бы рассмотреть. Важно поговорить и о процессе получения данного вещества.
Толуол является продуктом промышленной переработки бензиновых фракций нефти. Это еще называется каталитическим риформингом. Вещество выделяют селективной экстракцией, после чего проводят ректификацию – разделяют смесь посредством противоточного тепло- и массообмена между жидкостью и паром.
Нередко данный процесс заменяется каталитическим дегидрированием гептана. Это органический алкан с формулой СН3(СН2)5СН3. Дегидрирование происходит через метилциклогексан – циклоалкан с формулой С7Н14. Это моноциклический углеводород, у которого метильной группой замещен один атома водорода.
Очищают толуол так же, как и бензол. Вот только если применяется серная кислота, нужно учесть – это вещество сульфируется легче. Значит, при очищениитолуола надо поддерживать более низкую температуру. Ниже 30 °C, если быть точнее.
Видео:Выделение ТОЛУОЛА из растворителя фирмы АРИКОНСкачать

Толуол и бензол
Поскольку эти два вещества похожи, стоит выполнить сравнение химических свойств. Бензол и толуол оба вступают в реакции замещения. Однако скорости их протекания отличаются. Поскольку в молекуле толуола метальная группа влияет на ароматическое кольцо, он реагирует быстрее.
Но бензол, в свою очередь, проявляет устойчивость к окислению. Так, например, когда на него воздействует перманганат калия, ничего не происходит. Зато толуол при такой реакции образует бензойную кислоту, о чем уже упоминалось ранее.
В то же время, известно, что предельные углеводороды не реагируют с раствором калиевого перманганата. Так что окисление толуола объясняется влиянием, оказываемым бензольным кольцом на метильную группу. Данное утверждение подтверждается теорией Бутлерова. В соответствии с ней атомы и их группы в молекулах оказывают взаимное влияние.
Видео:Реакция между соляной кислотой HCl и алюминиевой фольгой Al В результате реакция образуется хлоридСкачать

Реакция Фриделя-Крафтса
Выше было многое сказано о формуле и химических свойствах толуола. Но еще не упоминалось о том, что данное вещество вполне реально получить из бензола, если выполнить реакцию Фриделя-Крафтса. Так называется способ ацилирования и алкилирования ароматических соединений с использованием кислотных катализаторов. К ним относится трифторид бора (BF3), хлорид цинка (ZnCl2), алюминия (AlCl3) и железа (FeCI3).
Вот только в случае с толуолом можно использовать только один катализатор. И это трибромид железа, который представляет сбой сложное бинарное соединение неорганического характера с формулой FeBr3. А реакция выглядит следующим образом: С6Н6 + CH3Br à FeBr 3 С6Н5СН3 + HBr. Так что не только химические свойства бензол и толуол объединяют, но еще и возможность получить одно вещество из другого.
Видео:ДЫМ В СТАКАНЕ - РЕАКЦИЯ АММИАКА И СОЛЯНОЙ КИСЛОТЫСкачать

Пожарная опасность
Нельзя не упомянуть и о ней, рассказывая про химические и физические свойства толуола. Ведь это очень огнеопасное вещество.
Оно относится к классу 3,1 легковоспламеняющихся жидкостей. В эту же категорию входит дизельное топливо, газойль, десенсибилизированные взрывчатые соединения.
Нельзя допускать возникновения рядом с толуолом открытого огня, курения, искр. Даже смесь паров этого вещества с воздухом является взрывоопасной. Если выполняются сливно-наливные операции, то соблюдение правил защиты от статического электричества приобретает первостепенную важность.
Производственные помещения, предназначенные для проведения работ, связанных с толуолом, обеспечиваются приточно-вытяжной вентиляцией, а техника – отсосами. Запрещен использование инструментов, которые могут при ударе дать искру. А если происходит возгорание вещества, то тушить его нужно лишь тонкораспыленной водой, воздушно-механической или химической пеной. Разлитый толуол обезвреживают песком.
Видео:Станнан - SnH4. Реакция Станнида Лития LiSn и Соляной Кислоты HCl.Скачать

Опасность для человека
Характеристики и химические свойства толуола определяют его токсичность. Как уже было сказано, его пары оказывают наркотическое воздействие. Оно особенно сильно в повышенных концентрациях. У человека, вдохнувшего пары, появляются сильные галлюцинации. Мало кто знает, но до 1998 года это вещество входило в состав клея «Момент». Именно поэтому он был так популярен среди токсикоманов.
Высокие концентрации данного вещества также отрицательно влияют на нервную систему, слизистые оболочки глаз, кожу. Нарушается функция кроветворения, поскольку толуол – это высокотоксичный яд. Из-за этого может возникнуть такие заболевания, как гипоксия и цианоз.
Существует даже понятие толуольной токсикомании. Она имеет и канцерогенное влияние. Ведь пару, попадая через кожу или органы дыхания в организм человека, поражают нервную систему. Порой, данные процессы обратить невозможно.
Кроме того, пары могут вызвать заторможенность и нарушить работу вестибулярного аппарата. Поэтому люди, работающие с данным веществом, трудятся в хорошо проветриваемых помещениях, обязательно под тягой, и используют специальные резиновые перчатки.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Применение
Завершить тему физико-химических свойств толуола стоит рассмотрением областей, в которых данное вещество активно задействовано.
В основном оно используется в качестве сырья для производства нитротолуолов, бензилхлорида, бензойной кислоты, а также прочих органических веществ.
Также это соединение – эффективный растворитель для многих полимеров (аморфных кристаллических высокомолекулярных веществ). И еще его нередко добавляют в состав товарных растворителей для красок и лаков, некоторых лекарственных медикаментов. Даже в производстве взрывчатых веществ это соединение применимо. С его добавлением изготавливают тринитротолуол и тротилтол.
🎦 Видео
Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать