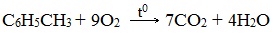Все реакции толуола (метилбензола) можно подразделить на два типа: реакции, затрагивающие бензольное кольцо и реакции, затрагивающие метильную группу.
- Реакции замещения
- Реакции присоединения
- Реакции окисления
- Ароматические УВ. Бензол
- Арены ряда бензола (моноциклические арены)
- Электронное строение молекулы бензола
- Физические свойства бензола
- Химические свойства бензола
- I. Реакции замещения
- II. Реакции присоединения
- III. Реакции окисления
- Получение бензола
- Изомерия и номенклатура гомологов бензола
- Физические свойства толуола
- Химические свойства толуола
- I. Реакции замещения
- II. Реакции присоединения
- III.Реакции окисления
- Получение толуола:
- Похожее
- Добавить комментарий Отменить ответ
- Физико-химические свойства толуола, уравнения реакций
- Немного истории
- Общие сведения
- Основные химические свойства
- Образование бензойной кислоты
- Получение вещества
- Толуол и бензол
- Реакция Фриделя-Крафтса
- Пожарная опасность
- Опасность для человека
- Применение
- 🔍 Видео
Реакции замещения
1. Реакции с участием бензольного кольца
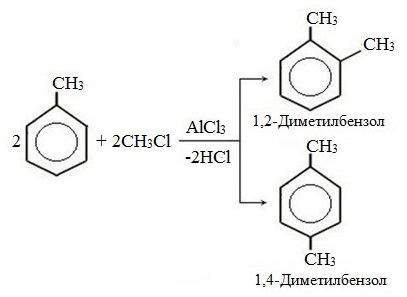
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большой скоростью.
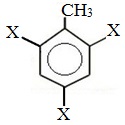
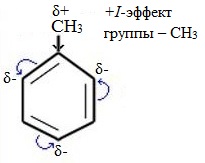
Метильный радикал, содержащийся в молекуле толуола, является ориентантом I рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара- производные толуола или при избытке реагента – трипроизводные общей формулы:
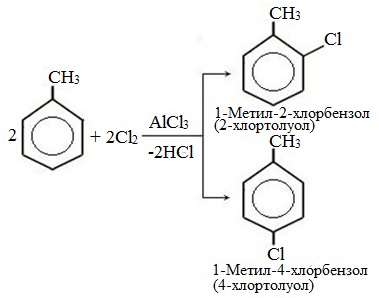
а) галогениерование
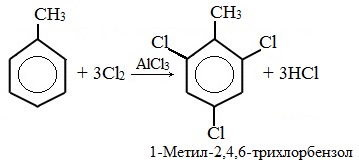
При избытке галогена можно получить ди- и три-замешенные производные в соответствии с правилами ориентации:
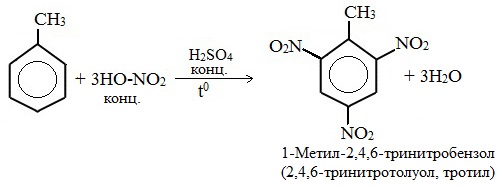
б) нитрование
Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях:
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4.
в) сульфирование
г) алкилирование
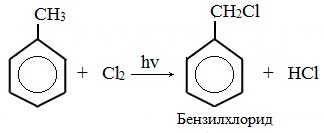
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π- электронной системой бензольного кольца:
Реакции присоединения
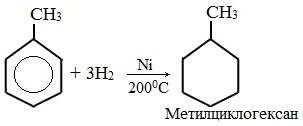
а) гидрирование
Реакции окисления
а) горение
б) неполное окисление
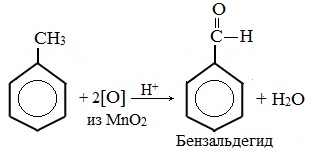
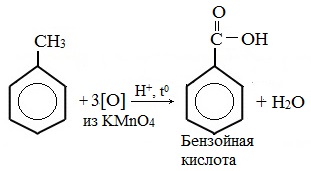
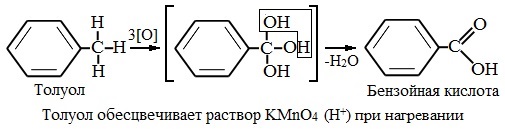
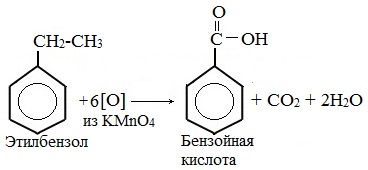
В отличие от бензола его гомологи подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом, в случае толуола — метильная группа. Мягкие окислите (MnО2) окисляют ее до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании).
Любой гомолог бензола с одной боковой цепью окисляется KMnO4 и другим сильным окислителем в бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Ароматические УВ. Бензол
Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Примеры ароматических УВ:
Арены ряда бензола (моноциклические арены)
Общая формула: CnH2n-6, n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С6Н6.
Электронное строение молекулы бензола
Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1856 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи) — циклогексатриен-1,3,5:
Такая структура молекулы бензола не объясняла многие свойства бензола:
- для бензола характерны реакции замещения, а не реакции присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов;
- бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором КМnО4).
Проведенные позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С—С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 120 о . Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Атомы углерода в бензоле находятся в состоянии sp 2 -гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости:
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизованные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряженная π-система (вспомните эффект сопряжения р-электронов в молекуле бутадиена-1,3, рассмотренный в теме «Диеновые углеводороды»):
Сочетание шести σ-связей с едиой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
В соответствии с современными представлениями об электронном строении бензола молекулу С6Н6 изображают следующим образом:
Физические свойства бензола
Бензол при обычных условиях — бесцветная жидкость; t o пл= 5,5 о С; t o кип. = 80 о С; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Химические свойства бензола
Ароматическая связь определяет химические свойства бензола и других ароматических УВ.
6π-электронная система является более устойчивой, чем обычные двухэлектроиные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения.
I. Реакции замещения
1.Галогенирование
2.Нитрование
Реакцию осуществляют смесью концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
3.Сульфирование
4.Алкилирование (замещение атома «Н» на алкильную группу) – реакции Фриделя-Крафтса, образуются гомологи бензола:
Вместо галогеналканов можно использовать алкены (в присутствии катализатора – AlCl3 или неорганической кислоты):
II. Реакции присоединения
1.Гидрирование
2.Присоединение хлора
III. Реакции окисления
2. Неполное окисление (KMnO4 или K2Cr2O7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
1) переработка нефти и угля;
2) дегидрирование циклогексана:
3) дегидроциклизация (ароматизация) гексана:
В лаборатории:
Сплавление солей бензойной кислоты со щелочами:
Изомерия и номенклатура гомологов бензола
Любой гомолог бензола имеет боковую цепь, т.е. алкильные радикалы, связанные с бензольным ядром. Первый гомолог бензола представляет собой бензольное ядро, связанное с метильным радикалом:
Толуол не имеет изомеров, поскольку все положения в бензольном ядре равноценны.
Для последующих гомологов бензола возможен один вид изомерии – изомерия боковой цепи, которая может быть двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей.
Физические свойства толуола
Толуол — бесцветная жидкость с характерным запахом, не растворимая в воде, хорошо растворяется в органических растворителях. Толуол менее токсичен, чем бензол.
Химические свойства толуола
I. Реакции замещения
1.Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью.
Метильный радикал, содержащийся в молекуле толуола, является заместителем рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара-производные толуола или при избытке реагента — трипроизводные общей формулы:
а) галогенирование
При избытке галогена можно получить ди- и три- замещенные производные в соответствии с правилами ориентации:
б) нитрование
в) сульфирование
г) алкилирование
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
При дальнейшем хлорировании можно получить дихлорметилбензол и трихлорметилбензол:
II. Реакции присоединения
Гидрирование
III.Реакции окисления
2. Неполное окисление
В отличие от бензола его гомологи окисляются некоторыми окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа MnO2 окисляют его до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа KMnO4 в бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением отщепившейся части ее до СО2; например:
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты, например:
Получение толуола:
В промышленности:
1) переработка нефти и угля;
2) дегидрирование метилциклогексана:
3) дегидроциклизация гептана:
В лаборатории:
1) алкилирование по Фриделю-Крафтсу;
2) реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана):
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Видео:Химия, 11-й класс, Химические свойства бензола. Толуол как гомолог бензолаСкачать

Физико-химические свойства толуола, уравнения реакций
Толуол – это метилбензол, представляющий собой бесцветную жидкость, относящуюся к классу аренов, которые являются органическими соединениями с ароматической системой в составе.
Ключевой особенностью данного вещества можно считать его специфический запах. Впрочем, это не единственная «отличительная черта» вещества. Свойств и характеристик у толуола много, и обо всех них стоит вкратце рассказать.
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Немного истории
Химические свойства толуола начали изучать чуть меньше 200 лет тому назад, когда его и получили впервые. Вещество обнаружил в 1835 году французский фармацевт и химик Пьер Жозеф Пеллетье. Ученый получил толуол при перегонке сосновой смолы.
А спустя три года французский физикохимик Анри Сент-Клер Девиль выделил данное вещество из бальзама, который он привез из колумбийского города Толу. В честь этого напитка, собственно говоря, соединение и получило свое название.
Видео:Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать

Общие сведения
Что можно сказать о характеристиках и химических свойствах толуола? Вещество представляет собой летучую подвижную жидкость с резким запахом. Оказывает легкое наркотическое действие. Реагирует с неограниченным количеством углеводородов, взаимодействует с простыми и сложными эфирами, со спиртами. С водой не смешивается.
- Вещество обозначается формулой С7Н8.
- Его молярная масса равна 92,14 г/моль.
- Плотность составляет 0,86694 г/см³.
- Температуры плавления и кипения равны −95 ℃ и 110,6 ℃ соответственно.
- Удельная теплота испарения составляет 364 кДж/кг.
- Критическая температура фазового перехода равна 320 °C.
Еще это вещество отличается горючестью. Сгорает коптящим пламенем.
Видео:Уравнивание реакций горения углеводородовСкачать

Основные химические свойства
Толуол – это вещество, которому свойственны реакции электрофильного замещения. Они происходят в так называемом ароматическом кольце, проявляющим анормально высокую стабильность. Эти реакции идут, в основном, в пара- и орто-положениях относительно метильной группы -CH3.
Относятся к химическим свойствам толуола реакции озонолиза и присоединения (гидрирование). Под воздействием некоторых окислителей метильная группа становится карбоксильной. Чаще всего для этого используется щелочной раствор калийного перманганата или неконцентрированная азотная кислота.
Еще стоит отметить, что толуол способен самовоспламеняться. Для этого необходима температура в 535 °C. Вспышка происходит при 4 °C.
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Образование бензойной кислоты
Способность обсуждаемого вещества участвовать в этом процессе также обусловлена его химическими свойствами. Толуол, реагируя с сильными окислителями, образует простейшую одноосновную бензойную карбоновую кислоту, относящуюся к ароматическому ряду. Ее формула – С6Н5СООН.
Кислота имеет вид белых кристаллов, которые хорошо растворяются в диэтиловом эфире, хлороформе и этаноле. Ее получают посредством следующих реакций:
- Толуол и перманганат калия, взаимодействующие в кислой среде. Формула следующая: 5С6Н5СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5СООН + 6MnSO4 + 3K2SO4 + 14Н2О.
- Толуол и перманганат калия, взаимодействующие в нейтральной среде. Формула такая: С6Н5СН3 + 2KMnO4 → С6Н5СООК + 2MnO2 + КОН + Н2О.
- Толуол, взаимодействующий на свету с галогенами, энергичными окислителями. Происходит по формуле: С6Н5СН3 + Х2 → С6Н5СН2Х + НХ.
Полученная вследствие этих реакций бензойная кислота применяется во многих сферах. В основном ее используют для получения реактивов – бензоилхлорида, бензоатных пластификаторов, фенола.
Также ее применяют при консервировании. Добавки Е213, Е212, Е211 И Е210 изготовлены именно на основе бензойной кислоты. Она блокирует ферменты и замедляет обмен веществ, подавляет рост дрожжей, плесени и бактерий.
А еще бензойная кислота используется в медицине для лечения кожных заболеваний, и как отхаркивающее средство.
Видео:Выделение ТОЛУОЛА из растворителя фирмы АРИКОНСкачать

Получение вещества
Демонстрирующие химические свойства толуола уравнения реакций, представленные выше – это еще не все, что хотелось бы рассмотреть. Важно поговорить и о процессе получения данного вещества.
Толуол является продуктом промышленной переработки бензиновых фракций нефти. Это еще называется каталитическим риформингом. Вещество выделяют селективной экстракцией, после чего проводят ректификацию – разделяют смесь посредством противоточного тепло- и массообмена между жидкостью и паром.
Нередко данный процесс заменяется каталитическим дегидрированием гептана. Это органический алкан с формулой СН3(СН2)5СН3. Дегидрирование происходит через метилциклогексан – циклоалкан с формулой С7Н14. Это моноциклический углеводород, у которого метильной группой замещен один атома водорода.
Очищают толуол так же, как и бензол. Вот только если применяется серная кислота, нужно учесть – это вещество сульфируется легче. Значит, при очищениитолуола надо поддерживать более низкую температуру. Ниже 30 °C, если быть точнее.
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Толуол и бензол
Поскольку эти два вещества похожи, стоит выполнить сравнение химических свойств. Бензол и толуол оба вступают в реакции замещения. Однако скорости их протекания отличаются. Поскольку в молекуле толуола метальная группа влияет на ароматическое кольцо, он реагирует быстрее.
Но бензол, в свою очередь, проявляет устойчивость к окислению. Так, например, когда на него воздействует перманганат калия, ничего не происходит. Зато толуол при такой реакции образует бензойную кислоту, о чем уже упоминалось ранее.
В то же время, известно, что предельные углеводороды не реагируют с раствором калиевого перманганата. Так что окисление толуола объясняется влиянием, оказываемым бензольным кольцом на метильную группу. Данное утверждение подтверждается теорией Бутлерова. В соответствии с ней атомы и их группы в молекулах оказывают взаимное влияние.
Видео:Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

Реакция Фриделя-Крафтса
Выше было многое сказано о формуле и химических свойствах толуола. Но еще не упоминалось о том, что данное вещество вполне реально получить из бензола, если выполнить реакцию Фриделя-Крафтса. Так называется способ ацилирования и алкилирования ароматических соединений с использованием кислотных катализаторов. К ним относится трифторид бора (BF3), хлорид цинка (ZnCl2), алюминия (AlCl3) и железа (FeCI3).
Вот только в случае с толуолом можно использовать только один катализатор. И это трибромид железа, который представляет сбой сложное бинарное соединение неорганического характера с формулой FeBr3. А реакция выглядит следующим образом: С6Н6 + CH3Br à FeBr 3 С6Н5СН3 + HBr. Так что не только химические свойства бензол и толуол объединяют, но еще и возможность получить одно вещество из другого.
Видео:НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

Пожарная опасность
Нельзя не упомянуть и о ней, рассказывая про химические и физические свойства толуола. Ведь это очень огнеопасное вещество.
Оно относится к классу 3,1 легковоспламеняющихся жидкостей. В эту же категорию входит дизельное топливо, газойль, десенсибилизированные взрывчатые соединения.
Нельзя допускать возникновения рядом с толуолом открытого огня, курения, искр. Даже смесь паров этого вещества с воздухом является взрывоопасной. Если выполняются сливно-наливные операции, то соблюдение правил защиты от статического электричества приобретает первостепенную важность.
Производственные помещения, предназначенные для проведения работ, связанных с толуолом, обеспечиваются приточно-вытяжной вентиляцией, а техника – отсосами. Запрещен использование инструментов, которые могут при ударе дать искру. А если происходит возгорание вещества, то тушить его нужно лишь тонкораспыленной водой, воздушно-механической или химической пеной. Разлитый толуол обезвреживают песком.
Видео:Ароматические углеводороды. Бензол | Органическая химия ЕГЭ, ЦТСкачать

Опасность для человека
Характеристики и химические свойства толуола определяют его токсичность. Как уже было сказано, его пары оказывают наркотическое воздействие. Оно особенно сильно в повышенных концентрациях. У человека, вдохнувшего пары, появляются сильные галлюцинации. Мало кто знает, но до 1998 года это вещество входило в состав клея «Момент». Именно поэтому он был так популярен среди токсикоманов.
Высокие концентрации данного вещества также отрицательно влияют на нервную систему, слизистые оболочки глаз, кожу. Нарушается функция кроветворения, поскольку толуол – это высокотоксичный яд. Из-за этого может возникнуть такие заболевания, как гипоксия и цианоз.
Существует даже понятие толуольной токсикомании. Она имеет и канцерогенное влияние. Ведь пару, попадая через кожу или органы дыхания в организм человека, поражают нервную систему. Порой, данные процессы обратить невозможно.
Кроме того, пары могут вызвать заторможенность и нарушить работу вестибулярного аппарата. Поэтому люди, работающие с данным веществом, трудятся в хорошо проветриваемых помещениях, обязательно под тягой, и используют специальные резиновые перчатки.
Видео:Получение ТолуолаСкачать

Применение
Завершить тему физико-химических свойств толуола стоит рассмотрением областей, в которых данное вещество активно задействовано.
В основном оно используется в качестве сырья для производства нитротолуолов, бензилхлорида, бензойной кислоты, а также прочих органических веществ.
Также это соединение – эффективный растворитель для многих полимеров (аморфных кристаллических высокомолекулярных веществ). И еще его нередко добавляют в состав товарных растворителей для красок и лаков, некоторых лекарственных медикаментов. Даже в производстве взрывчатых веществ это соединение применимо. С его добавлением изготавливают тринитротолуол и тротилтол.
🔍 Видео
Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Арены: реакции замещения | Химия ЕГЭ для 10 класса | УмскулСкачать

Бензол - представитель ароматических углеводородов | Химия 10 класс #19 | ИнфоурокСкачать

Бромирование ТОЛУОЛА спиртовым раствором БРОМА. Опыты по органической химии Химические экспериментыСкачать

Химия 10 класс (Урок№4 - Арены (ароматические углеводороды).)Скачать

Бензол и его гомологи | Химические свойства | ПолучениеСкачать

Арены (бензол, толуол): цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать