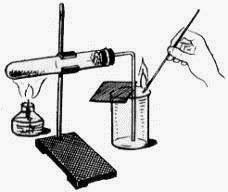
Цель работы : Получить кислород (методом вытеснения воздуха) и изучить его свойства.
Необходимое оборудование и реактивы
штатив лабораторный с лапкой или пробиркодержатель;
два химических стакана;
пробка с газоотводной трубкой;
ложка для сжигания веществ;
перманганат калия (твердый) KMnO 4 ;
известковая вода — Са(ОН) 2.
Меры предосторожности
Работа со спиртовкой:
Не переносите горящую спиртовку с места на место.
Гасите спиртовку только с помощью колпачка.
При нагревании не забудьте прогреть пробирку. Для этого пробирку, закрепленную в лапке штатива, медленно проведите сквозь пламя от донышка до отверстия и обратно. Эту операцию повторите несколько раз: чтобы стекло равномерно прогрелось. Признаком прогрева стекла можно считать исчезновение запотевания на стенках пробирки.
Дно пробирки должно находиться в верхней части пламени.
Дно пробирки не должно касаться фитиля.
Работа со стеклом:
Помните, что горячее стекло по внешнему виду не отличается от холодного. Не прикасайтесь к горячей пробирке. Закрепляя пробирку в лапке штатива, не закручивайте сильно винт. При нагревании стекло расширяется и пробирка может треснуть
Проверка прибора на герметичность:
Закройте пробирку пробкой с газоотводной трубкой, опустите конец трубки в стакан с водой. Плотно обхватите ладонью пробирку и внимательно следите за появлением пузырьков воздуха.
Загрузите по очереди два следующих видео — опыта и внимательно наблюдайте за экспериментом:
1. Получение кислорода (нажмите «Посмотреть опыт»)
Кислород( O 2 ) в лаборатории получают разложением перманганата калия KMnO 4 (марганцовки). Для опыта понадобится пробирка с газоотводной трубкой. В пробирку насыпаем кристаллический перманганат калия. Для сбора кислорода приготовим колбу. При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Тлеющая лучинка вспыхивает в колбе: значит нам удалось собрать кислород.
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑
Чистый кислород впервые получили независимо друг от друга шведский химик Шееле (при прокаливании селитры) и английский ученый Пристли (при разложении оксидов ртути и свинца). До их открытия ученые считали, что воздух ‑ однородная субстанция. После открытия Шееле и Пристли Лавуазье создал теорию горения и назвал новый элемент Oxygenium (лат.) – рождающий кислоту, кислород. Кислород — необходим для поддержания жизни. Человек может выдержать без кислорода всего несколько минут.
2. Обнаружение кислорода
Кислород поддерживает горение — это свойство кислорода используется для его обнаружения
Кислород активно взаимодействует со многими веществами. Посмотрим, как реагирует кислород с углем. Для этого раскалим кусочек угля на пламени спиртовки. На воздухе уголь едва тлеет, потому что кислорода в атмосфере около двадцати процентов по объему. В колбе с кислородом уголь раскаляется. Горение углерода становится интенсивным. При сгорании углерода образуется углекислый газ:
С+О 2 = СО 2
Добавим в колбу с газом известковую воду – она мутнеет. Известковая вода обнаруживает углекислый газ. Вспомните, как разжигают гаснущий костер. Дуют на угли или интенсивно обмахивают их для того, чтобы увеличить подачу кислорода в зону горения.
- Тлеющая лучинка и кислород уравнение
- Таблица Менделеева
- Универсальная таблица растворимости
- Коллекция таблиц к урокам по химии
- Практическая работа по теме: «Получение и свойства кислорода»
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 🎬 Видео
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Тлеющая лучинка и кислород уравнение
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Практическая работа по теме: «Получение и свойства кислорода»
Цель работы
- Получить кислород (методом вытеснения воздуха) и изучить его свойства.
Необходимое оборудование и реактивы
- штатив лабораторный с лапкой или пробиркодержатель;
- спиртовка;
- два химических стакана;
- стеклянная пластинка;
- пробирка;
- пробка с газоотводной трубкой;
- ложка для сжигания веществ;
- спички;
- лучинка;
- вата.
- перманганат калия (твердый) KMnO4;
- уголь С;
- известковая вода — Са(ОН)2.
Работа со спиртовкой:
- Не переносите горящую спиртовку с места на место.
- Гасите спиртовку только с помощью колпачка.
- При нагревании не забудьте прогреть пробирку. Для этого пробирку, закрепленную в лапке штатива, медленно проведите сквозь пламя от донышка до отверстия и обратно. Эту операцию повторите несколько раз: чтобы стекло равномерно прогрелось. Признаком прогрева стекла можно считать исчезновение запотевания на стенках пробирки.
- Дно пробирки должно находиться в верхней части пламени.
- Дно пробирки не должно касаться фитиля.
Работа со стеклом:
- Помните, что горячее стекло по внешнему виду не отличается от холодного. Не прикасайтесь к горячей пробирке.Закрепляя пробирку в лапке штатива, не закручивайте сильно винт. При нагревании стекло расширяется и пробирка может треснуть.
Проверка прибора на герметичность:
- Закройте пробирку пробкой с газоотводной трубкой, опустите конец трубки в стакан с водой. Плотно обхватите ладонью пробирку и внимательно следите за появлением пузырьков воздуха.
ВЫПОЛНЕНИЕ РАБОТЫ
Загрузите по очереди три следующих видео — опыта и внимательно наблюдайте за экспериментом:
1. Получение кислорода (нажмите «Посмотреть опыт»)
Кислород( O 2 ) в лаборатории получают разложением перманганата калия KMnO 4(марганцовки). Для опыта понадобится пробирка с газоотводной трубкой. В пробирку насыпаем кристаллический перманганат калия. Для сбора кислорода приготовим колбу. При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Тлеющая лучинка вспыхивает в колбе: значит нам удалось собрать кислород.
Чистый кислород впервые получили независимо друг отдруга шведский химик Шееле (при прокаливании селитры) и английский ученый Пристли (при разложении оксидов ртути и свинца). До их открытия ученые считали, что воздух ‑ однородная субстанция. После открытия Шееле и Пристли Лавуазье создал теорию горения и назвал новый элемент Oxygenium (лат.) – рождающий кислоту, кислород. Кислород — необходим для поддержания жизни. Человек может выдержать без кислорода всего несколько минут.
2. Обнаружение кислорода
Кислород поддерживает горение — это свойство кислорода используется для его обнаружения
Кислород активно взаимодействует со многими веществами. Посмотрим, как реагирует кислород с углем. Для этого раскалим кусочек угля на пламени спиртовки. На воздухе уголь едва тлеет, потому что кислорода в атмосфере около двадцати процентов по объему. В колбе с кислородом уголь раскаляется. Горение углерода становится интенсивным. При сгорании углерода образуется углекислый газ: С+О2= СО2
Добавим в колбу с газом известковую воду – она мутнеет. Известковая вода обнаруживает углекислый газ. Вспомните, как разжигают гаснущий костер. Дуют на угли или интенсивно обмахивают их для того, чтобы увеличить подачу кислорода в зону горения.
Оформите и сдайте отчёт о проделанной работе
Практическая работа №3
Получение и свойства кислорода
Цель работы :
Получить кислород (методом вытеснения воздуха) и изучить его свойства.
Приборы и оборудование : KMnO4 – перманганат калия (марганцовка), С – древесный уголь , известковая вода, пробка с газоотводной трубкой, лучинка, спиртовка, спички, колба, вата, пробирка.
Ход работы :
Название опыта, рисунок
Наблюдения, выводы
Уравнение химической реакции
1. Получение и собирание кислорода
2. Обнаружение кислорода тлеющей лучиной
3. Сжигание древесного угля в кислороде
C + O2 t = . (назовите продукты)
Вывод: __________________________________________
Видео:Тлеющая лучинаСкачать

Please wait.
Видео:Химия | КислородСкачать

We are checking your browser. gomolog.ru
Видео:Химические свойства кислорода. Урок 18. Химия 7 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Кислород. 8 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e20db8aed5a7a48 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
🎬 Видео
получение кислородаСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химия 8 класс. Кислород.Скачать

Получение кислорода из пероксида водородаСкачать

Кислород. Физические свойства. Получение. Урок 17. Химия 7 класс.Скачать

Общая характеристика халькогенов. КислородСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Кислород химический элемент и простое вещество Получение кислородаСкачать

Свойства кислорода. 8 класс.Скачать

Разложение пероксида водорода I ЕГЭ по химииСкачать

Кислород - Самый НУЖНЫЙ газ на ЗЕМЛЕ!Скачать

8 класс. Химия. Кислород.Скачать

Кислород/oxygen (часть 1). Химия – Просто.Скачать

9 класс, урок химии, тема "Кислород" (учитель Швецова Елена Евгеньевна)Скачать