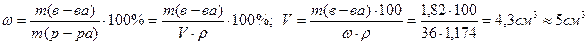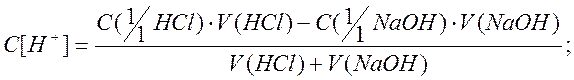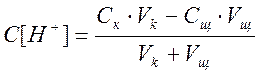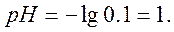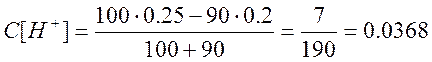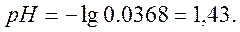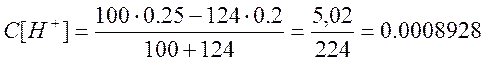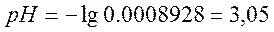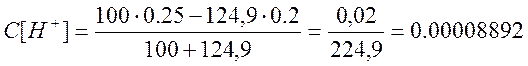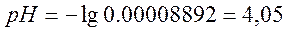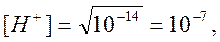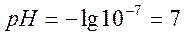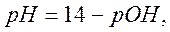Кафедра химии
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ
Лабораторные работы № 1 – 7
по дисциплине «Аналитическая химия»
| Проверил | Выполнил |
| _____________________________ | студент группы ____________ |
| __________________________ | |
| «_____» ________________ 2013 г | «_____» ______________ 2013 г |
Лабораторная работа № 1
Приготовление рабочего раствора соляной кислоты
1.1 Цель работы: освоить расчет и методику приготовления рабочего раствора соляной кислоты заданной концентрации путем разбавления более концентрированного раствора.
Приборы и реактивы
Мерный цилиндр вместимостью 10 мл, склянка для хранения раствора вместимостью 500 мл, концентрированный 36% раствор соляной кислоты.
Порядок выполнения работы
Рабочий раствор 0,1 н соляной кислоты готовят разбавлением концентрированного 36 % раствора (ρ = 1,174 г/мл).
Расчет: При разбавлении раствора масса растворенного вещества остается постоянной. Найдем массу чистой соляной кислоты, необходимую для приготовления 500 мл 0,1н раствора:
Найдем объем 36% раствора, который содержит такую же массу соляной кислоты:
Для приготовления 500 см 3 0,1н раствора соляной кислоты необходимо взять 5 мл концентрированного раствора.
Приготовление раствора. Мерным цилиндром (в вытяжном шкафу) отбирают 5 мл 36 % раствора соляной кислоты, переносят в склянку и разбавляют дистиллированной водой до объема 500 мл. На склянку приклеивают этикетку с указанием названия и концентрации раствора, фамилии студента, номера группы, даты приготовления.
Результаты работы
Лабораторная работа № 2
Определение концентрации раствора соляной кислоты (стандартизация) по стандартному раствору тетрабората натрия.
2.1 Цель работы: освоить технику титрования, овладеть методикой кислотно-основного титрования, определить концентрацию соляной кислоты по стандартному раствору тетрабората натрия.
2.2 Приборы и реактивы: бюретка вместимостью 50 мл, колба для титрования, пипетка Мора вместимостью 10, 15 или 20 мл, химический стакан вместимостью 250 мл, рабочий раствор соляной кислоты, стандартный раствор тетрабората натрия, раствор индикатора метилового красного.
Порядок выполнения работы
Перед началом работы следует внимательно изучить правила пользования бюреткой и правила титрования (см. приложение).
Титрование тетрабората натрия соляной кислотой можно представить следующим уравнением:
Тетраборат натрия – это соль, образованная катионом сильного основания и анионом слабой кислоты, поэтому ее раствор имеет сильно щелочную реакцию. Титрование ведут в присутствии индикатора метилового красного, интервал перехода которого 4,4 – 6,2.
Бюретку укрепляют в штативе в строго вертикальном положении, сливают дистиллированную воду и споласкивают рабочим раствором соляной кислоты. Затем бюретку наполняют раствором соляной кислоты выше нулевой отметки, заполняют носик раствором и устанавливают уровень кислоты на нулевое деление, сливая избыток кислоты в стакан.
Тщательно вымытую пипетку дважды ополаскивают приготовленным стандартным раствором буры и переносят в чистую колбу для титрования. Добавляют 2–3 капли индикатора метилового-красного (раствор приобретает бледно-желтую окраску).
В колбу для титрования прибавляют по несколько капель соляной кислоты из бюретки, непрерывно перемешивая жидкость плавными круговыми движениями. Титрование продолжают до перехода окраски раствора из желтой в бледно-розовую от одной капли. Титрование повторяют 3–5 раз, расхождение в результатах не должно превышать 0,05 мл. После каждого титрования оттитрованный раствор выливают, колбу ополаскивают дистиллированной водой и набирают новую аликвотную часть. Полученные результаты титрования заносят в таблицу 2.1:
Таблица 2.1 – Результаты титрования тетрабората натрия соляной кислотой
| № титрования | V(Na2B4O7), мл | V(HCl), пошедший на титрование, мл | V(HCl)ср, мл |
Расчет среднего объема, пошедшего на титрование, проводят по уравнению6:

где V1, V2, V3, Vn – объемы титранта, пошедшие на титрование, n – число полученных объемов.
По закону эквивалентов рассчитывается нормальная концентрация соляной кислоты:

Полученное значение концентрации соляной кислоты записывают в рабочий журнал и на этикетку склянки для хранения HCl.
2.4 Результаты работы:
Лабораторная работа № 3
Определение содержания гидроксида натрия в анализируемом растворе
3.1 Цель работы: определение массы гидроксида натрия в анализируемом растворе (ω, г).
3.2 Приборы и реактивы: бюретка вместимостью 50 мл, мерная колба вместимостью 100 мл, колба для титрования, пипетка Мора вместимостью 10, 15 или 20 мл, химический стакан, стандартизированный раствор соляной кислоты, анализируемый раствор гидроксида натрия, раствор индикатора метилового красного.
Порядок выполнения работы
Титрование соляной кислотой гидроксида натрия можно представить следующим уравнением:
NaOH + HCl → NaCl + H2O
Na + + OH – + H + + Cl – → Na + + Cl – + H2O
В мерную колбу объемом 100 мл в соответствии с вариантом набирают задачу на NaOH и доводят до метки дистиллированной водой. Колбу закрывают пробкой и тщательно перемешивают.
Подготовленную к работе бюретку (см. приложение) заполняют стандартизированным раствором соляной кислоты. Пипетку ополаскивают раствором гидроксида натрия. В колбу для титрования отмеряют пипеткой аликвотную часть анализируемого раствора NaOH, добавляют 2–3 капли индикатора метилового красного и титруют раствором соляной кислоты. Титрование продолжают до перехода окраски раствора из желтой в бледно-розовую от одной капли. Титрование продолжают 3–5 раз. Полученные результаты заносят в таблицу 3.1
Таблица 3.1 – Результаты титрования гидроксида натрия соляной кислотой
| № титрования | V(NaOH), мл | V(HCl), пошедший на титрование, мл | V(HCl)ср, мл |
По полученным данным рассчитывают процентную концентрацию гидроксида натрия и по уравнению 7 находят массу гидроксида натрия в анализируемом растворе:
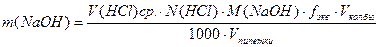
Результаты работы
Список литературы
1.Общие требования и правила оформления текстовых документов: СТП 15-06-2004. – Введ. 30.11.04. – Могилев: Могилевский государственный университет продовольствия, 2004. – 41 с.
2.Методические указания по курсу аналитическая химия: Задачи по количественному анализу, часть 2, для студентов технологических специальностей / Могилевский технологический институт; сост. О.Г. Поляченок, Е.А. Трилинская. – Могилев, 1997. – 39 с.
3.Алексеев, В.Н. Количественный анализ / В.Н. Алексеев. – М.: Химия. – 1972. – 504 с.
4.Васильев, В.П. Аналитическая химия в 2 ч. – Ч. 1: Гравиметрический и титриметрический методы анализа / В.П. Алексеев. – М.: Высшая школа. – 1989. – 320 с.
5.Коренман, Я.И. Практикум по аналитической химии / Я.И. Коренман, Р.П. Лисицкая. – Воронеж: Воронеж. гос. технол. акад. – 2002. – 408 с.
Правила титрования
1. При анализе пользоваться только чистой посудой. Жидкость при выливании из бюретки и пипетки не должна оставлять капель на стенках.
2. Перед употреблением бюретку необходимо ополоснуть раствором, которым будете титровать (титрантом).
3. Пипетку ополаскивают титруемым раствором. Для этого сначала небольшим количеством раствора ополаскивают стакан, наливают в стакан еще немного раствора, которым ополаскивают внутри и снаружи пипетку.
4. Бюретка должна быть установлена строго вертикально.
5. Раствор в бюретку заливают через воронку, которую сразу же удаляют.
6. Удаляют пузырьки воздуха из носика бюретки. Для этого приподнимают носик бюретки, направляя его в стакан, и открывают зажим.
7. Перед каждым титрованием бюретку заполняют титрантом на 5 мл выше нулевого уровня, ждут одну минуту, чтобы дать стечь раствору со стенок бюретки.
8. Доводят уровень жидкости до нуля. Отсчет по бюретки производят по нижнему краю мениска для неокрашенных и слабоокрашенных жидкостей, и по верхнему краю мениска для сильноокрашенных жидкостей.
9. При отсчете по бюретке глаза должны находится на уровне мениска. Отсчет следует производить с точностью до сотых долей миллилитра через 30 с после окончания титрования.
10. При титровании необходимо сливать жидкость с такой скоростью, чтобы можно было считать капли.
11. Жидкость в пипетку набирают выше метки примерно на 2 см и быстро закрывают указательным пальцем. Чуть приоткрывая отверстие пипетки, дают жидкости стечь до тех пор, пока нижний край мениска не совпадет с отметкой. Кончиком пипетки касаются стенок сосуда, чтобы снять последнюю каплю. Раствор из пипетки переносят в колбу, жидкости дают свободно стечь. Затем касаются кончиком пипетки стенки или дна колбы и ждут 10–20 секунд. Выдувать последнюю каплю нельзя.
12. При титровании подачу раствора регулируют левой рукой, раствор в колбе аккуратно перемешивают правой рукой.
13. Для получения правильного результата титрование повторяют не менее трех раз. Разница между параллельными результатами не должна превышать 0,05 мл. При дальнейших расчетах пользуются средним значением.
14. Каждое последующее титрование начинают от нуля.
15. После окончания титрования бюретку следует вымыть и оставить заполненной дистиллированной водой.
Видео:Определение концентрации вещества в растворе методом титриметрииСкачать

Расчет кривой титрования хлороводородной кислоты раствором гидроксида натрия
| Прибавлено NaOH, мл | Остаток HCl, мл | Концентрация H + в растворе, моль/л | pH = -lg[H + ] |
| 20,00 | 0,1 | 1,0 | |
| 10,00 | 10,00 | 0,05 | 1,3 |
| 18,00 | 2,00 | 0,01 | 2,0 |
| 19,8 | 0,20 | 0,001 | 3,0 |
| 19,98 | 0,02 | 0,0001 | 4,0 |
| 20,00 | 10 -7 | 7,0 | |
| Прибавлено NaOH, мл | Избыток NaOH, мл | Концентрация OH — в растворе, моль/л | pH = 14 — lg[OH — ] |
| 20,02 | 0,02 | 0,0001 | 10,0 |
| 20,20 | 0,20 | 0,001 | 11,0 |
| 22,00 | 2,00 | 0,01 | 12,0 |
| 40,00 | 20,00 | 0,1 | 13,0 |
Рис. 2.1. Рассчитанная кривая титрования 20 мл 0,1 моль/л раствора HCl 0,1 моль/л раствором NaOH
Резкое изменение рН раствора (скачок титрования) наблюдается вблизи точки эквивалентности. Величину скачка титрования измеряют высотой вертикального участка кривой титрования. Область скачка на кривой титрования лежит в диапазоне 3-11 единиц рН, поэтому для фиксирования точки эквивалентности можно использовать кислотно-основные индикаторы, меняющие окраску в данном интервале. Например, метиловый красный (рТ = 5,25), метиловый оранжевый (рТ=4,0) или фенолфталеин (рТ=9,1), см. таблицу. У этих индикаторов величина рТ лежит в интервале от 3 до 11. Чем больше скачок титрования тем больше число индикаторов, которые можно использовать для определения конечной точки титрования.
Титрование слабой кислоты сильным основанием
Рассмотрим титрование уксусной кислоты гидроксидом натрия. CH3COOH + NaOH = CH3COONa + H2O
В начале титрования в растворе находится только слабая кислота и рН раствора этой кислоты может быть определено по формулам:
До точки эквивалентности при титровании получается сопряжённое основание и раствор представляет собой буферную смесь. Вычислить рН можно по формулам:
где константа Кк – константа кислотности .
В точке эквивалентности вся кислота оттитрована и рН раствора опрделяется наличием сопряжённого основания.
Ацетат натрия подвергается гидролизу.
После точки эквивалентности рОН равняется – lg CKOH
Кривая титрования уксусной кислоты гидроксидом натрия представлена на рисунке:
Рис.2. Рассчитанная кривая титрования 20 мл 0,1 моль/л растворауксусной кислоты 0,1 моль/л раствором гидроксида натрия
Рассмотрение кривой титрования уксусной кислоты гидроксидом натрия (рис.2) позволяет сделать некоторые заключения. Точка эквивалентности на кривой титрования не совпадает с точкой нейтральности. Из-за гидролиза ацетата натрия в точке эквивалентности среда щелочная. Скачок на кривой титрования меньше скачка титрования сильной кислоты щёлочью при одинаковых концентрациях титруемого раствора и титранта:
следовательно для определения конечной точки титрования можно использовать индикаторы у которых рТ лежит в указанном интервале изменений рН. К таким индикаторам относятся (см. таблицу) бромтимоловый синий рТ =7, фенолфталеин рТ = 9, индикатор метилоранжевый применять при данном титровании нельзя, так как у него значение рТ =4, то есть выходит за пределы скачка титрования (см. рис.).
Ацидиметрия.
Титрование сильного основания сильной кислотой
При титровании сильного основания сильной кислотой, например, гидроксида натрия раствором хлороводородной кислоты, протекают процессы, аналогичные рассмотренным при титровании сильной кислоты сильной щёлочью, но только в обратном порядке. При прибавлении титранта к исходному раствору значение рН раствора уменьшается. Расчёт проводится по формулам. аналогичным рассмотренным выше (с. ) , для исходного раствора
рН =14 – рОН = 14 + lg
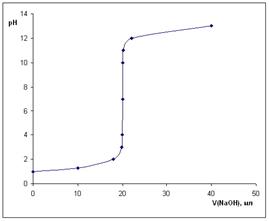
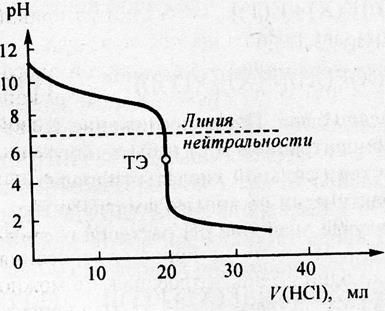
В точке эквивалентности рН=7, так как гидролиз соли отсутствует, после точки эквивалентности величина рН обусловлена присутствием избыточного титранта, то есть сильной кислоты. Точка эквивлентности совпадает в данном случае с точкой нейтральности. На рис. 3 показана в качестве примера кривая титрования 0,1 раствора гидроксида натрия 0,1 молярным раствором хлороводородной кислоты.
Рис.3 Рассчитанная кривая титрования 20 мл 0,1 моль/л раствора NaOH 0,1 моль/л раствором HCl
Титрование слабого основания сильной кислотой
Рассмотрим титрование гидрата аммиака хлороводородной кислотой.
В растворе гидрата аммиака устанавливается следующее протолитическое равновесие:
Исходный раствор имеет рН больше 7 и значение рН рассчитывается по формулам:
При прибавлении к раствору аммиака сильной кислоты, например, HCl
Образуется соль, содержащая катион слабого основания
После начала титрования в растворе присутствует как само слабое основание, так и его соль, то есть раствор представляет собой буферную смесь.
Расчёт рН выполняется по формулам:
А К — константа кислотности кислоты, сопряжённой с титруемым основанием.
В точке эквивалентности источником оксония иона является сопряжённая кислота
За точкой эквивалентности значение рН определяется только добавленной сильной кислотой, то есть
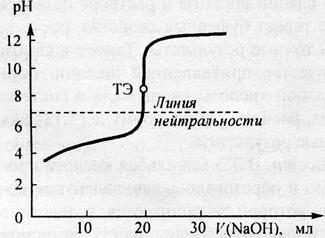
Рис.4. Рассчитанная кривая титрования 20 мл 0,1 моль/л раствора аммиака 0,1 моль/л раствором HCl
Рассматривая кривую титрования, мы видим, что точка эквивалентности лежит ниже линии нейтральности, величина скачка (от рН= 7,5 до рН= 3) значительно меньше, чем при титровании сильной щёлочи сильной кислотой (см. предыдущий рис.).
Для определения конечной точки титрования могут быть использованы следующие индикаторы: метиловый оранжевый (рТ =4), метиловый красный (рТ= 5,5) и другие см. таблицу. Фенолфталеин в данном случае использовать нельзя, так как у него рТ =9, что выходит за пределы скачка.
Титрование солей слабых кислот
Как было отмечено выше на с по теории Брёнстеда кислотные остатки слабых кислот являются основаниями, следовательно они могут присоединять протоны и могут быть оттитрованы растворами сильных кислот. Например, рассмотрим титрование ратвора карбоната натрия раствором хлороводородной кислоты. При растворении карбоната натрия в воде происходят следующие процессы:
Карбонат натрия как сильный электролит в воде диссоциирует нацело, а карбонат ион в растворе гидролизуется
Расчёт рН исходного раствора проводится по формуле:
На кривой титрования фиксируется два скачка титрования, которым соответствуют две точки эквивалентности. Первая из них связана с образованием амфолита – гидрокарбоната натрия. Расчёт рН амфолита проводится по формуле:
От первой до второй точки эквивалентности расчёт проводится по формуле
Во второй точке эквивалентности карбонат натрия полностью оттитрован до угольной кислоты, которая диссоциирует как слабая одноосновная кислота и расчёт рН проводится по формуле
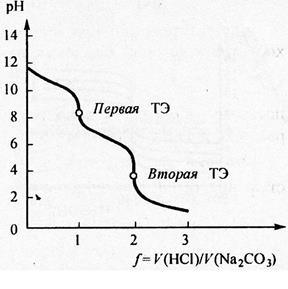
Рис.5.Расссчитанная кривая титрования раствора карбоната натрия Na2CO3 с молярной концентрацией эквивалента 0,1 моль/л раствором HCl с молярной концентрацией 0,1 моль/л; f – степень оттитрованности.
Величина рН после второй точки эквивалентности определяется значением избытка прибавленной кислоты (см. рис. ). Для фиксации конечной точки титрования первой точки используется фенолфталеин, для фиксации второй точки титрования – метиловый оранжевый.
Титрование многоосновных кислот
Многоосновные кислоты, например, ортофосфорная диссоциируют последовательно, ступенчато. Константа диссоциации по первой ступени всегда больше константы диссоциации по второй, а константа диссоциации по второй ступени всегда больше константы диссоциации по третьей ступени.
Диссоциация кислот по первой ступени подавляет диссоциацию кислот по последующим ступеням. Поэтому при титровании растворов многоосновных кислот растворами сильных оснований, вначале оттитровываются ионы водорода, соответствующие первой ступени диссоциации, затем второй и т.д. при условии, что константы кислотности отличаются друг от друга в 10 000 раз.
На кривой титрования могут проявляться скачки для каждой последовательной ступени нейтрализации кислоты.
Разделение и отчётливое проявление этих скачков на кривой титрования зависит от величин констант последовательных ступеней диссоциации и от концентрации кислоты в титруемом растворе.
Если Кк – 6 , то скачки на кривой титрования проявляются отчётливо.
Ортофосфорная кислота – трёхосновная:
Теоретически при взаимодействии фосфорной кислоты со щёлочью существуют три точки эквивалентности
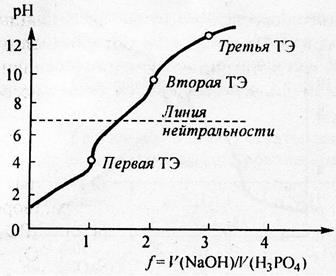
Различие в константах ступенчатой диссоциации достаточно, чтобы скачки на кривой титрования разделились, но сами величины К2 и К3 малы. Поэтому даже при достаточной концентрации кислоты С> 10 –2
второй скачёк проявляется слабо, третий не проявляется (см. рис.5).
Поэтому фосфорную кислоту титруют как одноосновную с индикатором метиловым оранжевым, либо как двухосновную с индикатором фенолфталеином.
Рис.6. Рассчитанная кривая титрования раствора ортофосфорной кислоты H3PO4 с молярной концентрацией эквивалента 0,1 моль/л раствором гидроксида натрия с молярной концентрацией 0,1 моль/л; f – степень оттитрованности.
Дата добавления: 2016-01-09 ; просмотров: 4749 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Расчёт кривых титрования соляной кислоты раствором гидроксида натрия
Страницы работы
Содержание работы
Федеральное агентство по образованию Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
”Сибирский Государственный технологический университет”
Кафедра аналитической химии и технологии электрохимических производств
Факультет Химических Технологий
РАСЧЁТ КРИВЫХ ТИТРОВАНИЯ
Студент группы 62-3
________________Калинин Н. С.
Рассмотрим титрование сильной кислоты сильным основанием на примере титрования соляной кислоты раствором гидроксида натрия.
HCl+NaOH → NaCl+H2O — в молекулярной форме,
H + + OH — → H2O — в ионной форме.
Пусть титруется 100см 3 раствора соляной кислоты с молярной концентрацией эквивалента 0,25 моль/дм 3 раствором основания NaOH с молярной концентрацией эквивалента 0,2 моль/дм 3 . При расчете кривой титрования необходимо рассмотреть и определить значение pH в начальный момент, в процессе титрования, в точке эквивалентности, и за точкой эквивалентности.
1. В начальный момент у нас имеется раствор сильной кислоты. Не учитывая изменения ионной силы раствора, определим водородный показатель раствора pH по формуле:
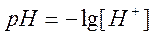
где [H + ]- молярная концентрация эквивалента кислоты, моль/дм 3 .
С[1/1HCl]=0.25 моль/дм 3 . 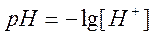
2 В процессе титрования, при добавлении к кислоте раствора гидроксида натрия часть кислоты расходуется на образование поваренной соли- хлорида натрия NaCl, поэтому концентрация ионов водорода до точки эквивалентности начинает уменьшаться. Молярную концентрацию эквивалента кислоты в процессе титрования рассчитываем по формуле:
где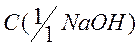
добавленной в процессе титрования. Обозначим её через Сщ;
V(HCl)- объем кислоты, взятой для анализа, см 3 , V(HCl)= Vк;
V(NaOH)- объем щелочи, добавленной в процессе титрования, см 3 , V(NaOH)=Vщ.
Тогда формула (1.2) примет вид:
а) Пусть добавлено 50 см 3 NaOH, тогда
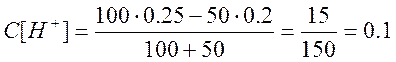
Аналогично рассчитываем pH в точках, когда добавлено 90; 99; 99,9 см 3 раствора NaOH.
б) Добавлено 90 см 3 NaOH,
в)добавлено 124 см
г)добавлено 124,9 см
3. В точке эквивалентности добавлено 125 см 3 раствора NaOH, т.е. в раствор вводят как раз эквивалентное имевшейся кислоте количество щелочи, т.е. достигают точки эквивалентности. В этот момент раствор будет содержать только образовавшуюся при реакции соль NaCl. Но так как последняя не подвергается гидролизу, pH раствора можно определить, исходя из ионного произведения воды.
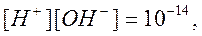
4. За точкой эквивалентности наблюдается избыток щелочи. В этом случае расчет pH, без учета разбавления, проводится по формуле расчета pH сильного основания
где 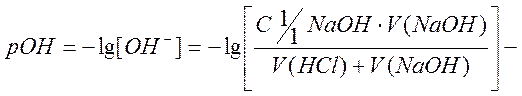
а) Пусть добавлено125,1 см 3 раствора NaOH,
🌟 Видео
Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать

Занятие 2. Стандартизация гидроксида натрия по соляной кислоте. Калибровка пипетки Мора.Скачать

Взаимодействие уксусной кислоты с гидроксидом натрияСкачать

Титриметрический анализ гидроксида натрия соляной кислотойСкачать

Кондуктометрическое титрование (NaOH + HCl → NaCl + H₂O)Скачать

Опыт 3 Взаимодействие гидроксида натрия с соляной кислотойСкачать

Взаимодействие фенола с гидроксидом натрияСкачать

Опыты по химии. Реакция нейтрализацииСкачать

Титрование 👌🏼Скачать

Кислотно-основное титрованиеСкачать

Получение соляной кислотыСкачать

ГИДРОКСИД НАТРИЯ | NaOH | Химические свойства ГИДРОКСИДА НАТРИЯ | Качественные реакции | ХимияСкачать

Реакция гидроксида натрия и соляной кислоты, как окрашиваетсяиндикатр фенолфталеинЙющексен художеземСкачать

Кислотно основное титрованиеСкачать

Титр раствора (Т). Решение задач. Часть 1.Скачать

Приготовление и стандартизация децимолярного раствора соляной кислоты.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Задача на кислотно-основное титрование (видео 16) | Титриметрический анализ | ХимияСкачать