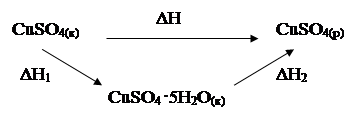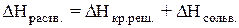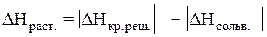Дисциплина: Химия
Раздел 2. Общие закономерности химических процессов
УЧЕБНОЕ ЗАДАНИЕ № 5 «ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ ХИМИЧЕСКОЙ РЕАКЦИИ НА ОСНОВАНИИ ДАННЫХ ОПЫТА»
Лабораторная работа № 4 «Определение энтальпии гидратации безводного cульфата меди»
Этап индивидуальной работы
1. Разместите структурированную информацию (результат работы с информационными источниками) в ниже приведенную Табл. 1.
Таблица 1. Результаты работы с информационными источниками
| тема | «Определение энтальпии реакции присоединения кристаллизационной воды к безводной соли (энтальпия гидратации)» |
| форма организации информации | Энтальпию реакции присоединения кристаллизационной воды к безводной соли можно определить, зная изменение энтальпии при растворении безводной солии изменение энтальпии при растворении кристаллогидрата этой соли. В термохимии под энтальпией растворения понимают изменение энтальпии процесса растворения 1 моля вещества в большом количестве растворителя, т.е. в таком его количестве, когда дальнейшее разбавление раствора не влияет на величину энтальпии растворения (это так называемая дифференциальная энтальпия растворения). Энтальпия растворения веществ состоит в основном из двух слагаемых: энтальпии процесса перехода твердого или газообразного вещества в то состояние, в котором оно существует в растворе ∆Hр, и энтальпии процесса взаимодействия вещества с растворителем (энтальпия сольватации) ∆Hс. В зависимости от величины и знака этих двух слагаемых процесс растворения может быть эндотермическим или экзотермическим. Для газов ∆Hр 0, т.к. при их растворении затрачивается энергия на разрушение кристаллической решетки. Таким образом, процесс растворения соли может быть представлен в виде двух этапов: разрушение кристаллической решетки соли с образованием раствора ее и взаимодействия частиц соли с растворителем. Процесс же растворения кристаллогидрата соли состоит только из разрушения кристаллической решетки, т.к. взаимодействия частиц кристаллогидрата с растворителем, можно считать, не происходит (молекулы соли уже связаны с молекулами растворителя). Следовательно, энтальпия растворения безводной соли и ее кристаллогидрата отличается на величину энтальпии гидратации ∆Hгидр. |
2. Заполните таблицу 2, для этого рассмотрите схемы процесса растворения безводного сульфата меди (II), запишите термохимические уравнения и обозначения энтальпий для каждой стадии процесса:
Таблица 2. Стадии процесса растворения безводного сульфата меди (II)
| Схема и энтальпии процесса растворения | |||||||
| ΔH = ΔH1 + ΔH2 ΔН2 = – 11,48 кДж | ||||||
| Стадии процесса растворения CuSO4 | |||||||
| гидратация безводного сульфата меди (II) | CuSO4(к) + 5H2O(ж) = CuSO4 · 5H2O(к), ΔН1 | ||||||
| растворение кристаллогидрата меди (II) | CuSO4 ·5H2O(к) = CuSO4(р) + 5H2O(ж), ΔН2 |
3. Напишите отчет по лабораторной работе.Впишите в табл. 3 результаты наблюдений, формулы соединений, значения параметров и справочные данные, расчеты по формулам, выводы:
Результаты индивидуальных наблюдений и предварительные соображения
| Результаты наблюдений | ||
| вещество | формула с обозначением агрегатного состояния | цвет |
| безводный сульфат меди (II) | CuSO4(к) | белый |
| растворенный сульфат меди (II) | CuSO4 (р) | голубой |
| Расчеты | ||
| Значения параметров и справочные данные | ||
| Масса безводной соли (m1), г | ||
| масса воды (m2), г | ||
| масса раствора (m), г | 100+5=105 | |
| начальная температура (t1), 0 C | 25 о С | |
| конечная температура (t2), 0 C | 27 о С | |
| удельная теплоемкость раствора (c), Дж/(г·К) | 4,18 | |
| молярная масса CuSO4 (M), г/моль | ||
| Расчеты по формулам | ||
| Количество теплоты, выделившейся при растворении соли, кДж | 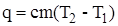 = =  | |
| Количество теплоты, выделяющейся при растворении 1 моль CuSO4, кДж/ моль |   | |
| Энтальпия растворения безводного сульфата меди (II), кДж/ моль | ΔН = – Q = – 26,8 кДж/моль | |
| Энтальпия гидратации безводного сульфата меди (II), кДж/ моль | ΔH1 = ΔH — ΔН2 ΔH1= –26,8 – 11,48 = – 38,28 | |
| Выводы | ||
| Гидратация безводного сульфата меди является экзотермическим процессом. | ||
| Термохимическое уравнение гидратации безводного сульфата меди (II): CuSO4(к) + 5H2O(ж) = CuSO4 · 5H2O(к), ΔН1= – 38,28 кДж/моль |
Количество теплоты, выделившейся при растворении соли, кДж
q=cm(T2−T1)= 
4. Прикрепить свою работу в разделе «Загрузка файла» для проверки.
Видео:65. Что такое реакция гидратации и реакция дегидратацииСкачать

ЛАБОРАТОРНАЯ РАБОТА № 4.определение теплоты гидратации сульфата меди (II)
Цель: познакомиться с законом Гесса и используя его, определить тепловой эффект гидратации безводного сульфата меди (II).
Как известно, большинство химических реакций сопровождаются выделением (экзотермические реакции) либо поглощением (эндотермические реакции) теплоты. Первое начало термодинамики дает возможность рассчитать тепловой эффект химической реакции при различных условиях её проведения.
Тепловой эффект (теплота) химической реакции– количество теплоты, выделившейся либо поглотившейся в ходе реакции. Уравнения процессов, в которых указаны тепловые эффекты, называютсятермохимическими.
Чтобы отнести тепловой эффект или энтальпию реакции к 1 молю какого-либо вещества, термохимические уравнения иногда имеют дробные коэффициенты:
2 Al+ 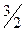
2 Al+ 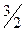
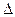
Тепловые эффекты, сопровождающие протекание химических реакций, являются предметом одного из разделов химической термодинамики – термохимии. Долгое время тепловой эффект было принято обозначать буквой Q. В настоящее время тепловой эффект принято обозначать ∆H. H – энтальпия системы, мера энергии, накапливаемой веществом при его образовании. При экзотермических реакциях тепло выделяется, при этом энтальпия системы уменьшается. В случае эндотермических реакций теплота поглощается, следовательно, энтальпия увеличивается. Очевидно Q = — ∆H.
Теплота образования вещества – тепловой эффект реакции образования 1 моля сложного вещества из простых. Теплоты образования простых веществ принимаются равными нулю.
Теплота сгорания вещества – тепловой эффект реакции окисления 1 моля вещества в избытке кислорода до высших устойчивых оксидов.
Теплота растворения – тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Теплота растворения складывается из двух составляющих: теплоты разрушения кристаллической решетки (для твердого вещества) и теплоты сольватации:
Поскольку ΔНкр.реш. всегда положительно (на разрушение кристаллической решетки необходимо затратить энергию), а ΔНсольв. всегда отрицательно, знак
ΔНраств. определяется соотношением абсолютных величин ΔНкр.реш. и ΔНсольв.:
Основным законом термохимии является закон Гесса, являющийся частным случаем первого начала термодинамики:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Изменение энтальпии ΔН (тепловой эффект изобарного процесса Qp) и изменение внутренней энергии ΔU(тепловой эффект изохорного процесса Qv) не зависят от пути, по которому система переходит из начального состояния в конечное.
Работа проводится в калориметрической установке. В качестве калориметра используется сухой пластмассовый стакан с теплозащитной оболочкой (термос), мешалка и термометр. В калориметрический стакан налить 100 мл дистиллированной воды и, выждав 5-7 минут, измерить ее температуру с точностью до 0,1 о С (t1). Получить у преподавателя навеску безводного сульфата меди (II) (массой 3 грамма), насыпать соль в стакан, растворить ее при перемешивании мешалкой, отметить максимальную температуру(t2).
Расчеты суммарной теплоты гидратации и растворения безводного сульфата меди (II) вести в следующей последовательности:
1) Вычислить величину изменения температуры: ∆t 
2) Вычислить массу раствора: m = mсоли + mводы. Массу воды рассчитать, учитывая, что плотность воды равна 1 г/см 3
3) Вычислить количество теплоты, затраченной на растворение сульфата меди (II) по формуле:
где с – удельная теплоемкость (принять равной 4,184 Дж/( г . К).
4) Пересчитать тепловой эффект растворения безводного сульфата q1 на 1 моль вещества Q1.
После этого повторить опыт, взяв медный купорос CuSO4 ∙ 5Н2О в количестве 5 г. Опыт и расчеты провести так же, как с безводным сульфатом меди. В этом опыте определить теплоту растворения медного купороса q2. Пересчитать на 1 моль кристаллогидрата Q2 и определить теплоту гидратации по разности теплот растворения безводной соли и кристаллогидрата, пересчитанных на 1 моль вещества: Qгидратации = Q1 — Q2. Все результаты и проведенные расчеты записать в таблицу 1.
Таблица 1 — Результаты определения теплоты гидратации
| Вещество | Мас-са, г | Темпера-тура, С | Вычислен-ная теплота, Дж | Пересчитан-ная теплота Дж/моль | Теплота гидратацииДж | |
| t2 | t2 | q1 | q2 | Q1 | Q2 | Qгидратации |
| CuSO4 | ||||||
| CuSO4 ∙ 5Н2О |
1) Какие расчеты можно проводить на основе закона Гесса?
2) Как используя теплоты образования рассчитать тепловой эффект реакции?
3) Как используя теплоты сгорания рассчитать тепловой эффект реакции?
4) Что такое теплота растворения и гидратации?
5) Как связаны между собой тепловой эффект реакции и энтальпия?
5 ЛАБОРАТОРНАЯ РАБОТА № 5. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Цель: Экспериментально изучить зависимость скорости протекания химических реакций от концентрации, температуры и катализатора.
Дата добавления: 2015-01-21 ; просмотров: 2237 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Практическое занятие №3, №4 Тема 1. Первое начало термодинамики. Термохимия (Раздел 2 — Термохимия) продолжение
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №3, №4
Тема 1. Первое начало термодинамики. Термохимия
(Раздел 2 — Термохимия) продолжение
Общая цель: Вам необходимо овладеть учебной программой данного занятия и научиться применять учебный материал в своей будущей профессии.
Сделайте записи в рабочей тетради по плану:
- дата; номер занятия; тема занятия; цель занятия; основные вопросы темы. конспект лабораторной работы:
— аппаратура и материалы;
— методика выполнения (рисунки, таблицы, основные формулы);
— экспериментальные результаты (расчеты);
— ответы на контрольные вопросы для защиты лабораторной работы.
Учебные вопросы занятия:
Выполнение лабораторной работы №1. Расчет. Защита лабораторной работы №1 по контрольным вопросам.
Ваши действия при подготовке к занятию и отработке программы занятия
При подготовке к данному занятию
Повторите раздел 2 (Термохимия) темы 1 (Химическая термодинамика. Термохимия) рабочей учебной программы дисциплины «Физическая химия».
Это очень важно, так как этот материал является базовой основой для получения новых знаний и на нем строится программа занятия.
Обратите внимание на:
Закон Гесса. Следствия из закона Гесса (три следствия) Теплота образования. Теплота сгорания. Влияние температуры на тепловые эффекты. Закон Кирхгофа. Рабочее уравнение Кирхгофа.
При отработке 1-го учебного вопроса обратите внимание на: технику безопасности при работе в химической лаборатории.
При отработке 2-го учебного вопроса обратите внимание на: расчет мольной теплоты нейтрализации, растворения, кристаллизации и диссоциации; таблицы с термодинамическими свойствами органических и неорганических соединений.
При отработке 3-го учебного вопроса обратите внимание на: Примеры решения задач на заданные темы (Сборник примеров и задач по физической химии).
Лабораторная работа № 1
Определение теплоты нейтрализации сильной кислоты сильным основанием. Определение теплоты растворения и теплоты гидратации соли. Определение теплоты диссоциации слабой кислоты.
Цель работы. Овладеть навыками измерения тепловых эффектов химических реакций и ознакомиться с методом определения теплоемкости твердых образцов в массивном калориметре.
Аппаратура и материалы
Для опытов 1–3: Калориметрическая установка, 1 М растворы КОН NaOH, HC1 и HN03, мерный цилиндр на 500 мл, безводный сульфат меди (II) CuSO4, безводный карбонат натрия Na2CO3, аналитические весы, пробирка с делением «10 мл», термометр от 0 до 50 °С, секундомер, растворы 4 М NaOH, 0,1 М НС1, HNO3, СН3СООН, НСООН, химический стакан на 500 мл, мешалка.
Работа состоит из трех опытов.
Опыт 1. Определение теплоты нейтрализации сильной кислоты сильным основанием
Для измерения тепловых эффектов реакций используют калориметры или калориметрические установки (рис. 1). В наружный сосуд (стакан на 0,8 л) вставляется калориметрический стакан меньшей вместимости (0,5 л). Во избежание потерь теплоты через стенки калориметрического стакана между сосудами помещают пробковые прокладки. Калориметрический стакан закрывают деревянной крышкой с отверстиями для термометра (цена деления 0,1 К), мешалки и воронки. Мешалку присоединяют к электромотору или приводят в движение вручную.
Теплоту, выделяющуюся или поглощающуюся в калориметре, вычисляют по формуле

где Т2 и T1 – конечная и начальная температуры жидкости в калориметрическом стакане; 
Рисунок 1 – Калориметрическая установка: 1 – мешалка, 2 – воронка, 3 – калориметрический стакан, 4 – наружный сосуд, 5 – крышка, 6 – термометр
Согласно теории электролитической диссоциации нейтрализация сильной кислоты сильным основанием в разбавленном растворе отвечает уравнению Н+ + ОН — = Н2О. Стандартная теплота нейтрализации сильной кислоты сильным основанием равна при 298 К -55,9 кДж на один моль образующейся воды. Термохимическое уравнение реакции нейтрализации имеет вид
Н+(ж) + ОН-(ж) = Н20(ж), ДH °298 = — 55,9 кДж/моль
В опыте используют 1 М растворы КОН, NaOH, HC1 и HN03. Для нейтрализации берут равные объемы (120 – 180 мл) растворов кислоты и щелочи.
Получите у преподавателя задание и запишите его в лабораторный журнал. Взвесьте сухой калориметрический стакан (c точностью до 0,1 г) или узнайте его массу у лаборанта. Соберите калориметрическую установку (рис. 2.1) и через воронку 2 налейте в сосуд заданный объем 1 М раствора щелочи; запишите температуру раствора щелочи Тщ с точностью до 0,1 К.
Налейте в мерный цилиндр такой же объем 1 М раствора кислоты и измерьте температуру раствора Тк с той же точностью. Начальная температура смеси кислоты и щелочи Т1 — среднее арифметическое от Тщ и Тк. При работающей мешалке 1 через воронку 2 быстро влейте кислоту в калориметрический стакан и отметьте самую высокую температуру Т2, которую покажет термометр 6 после сливания растворов.
🎦 Видео
Решение задач на термохимические уравнения. 8 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

CuSO4+NH4OHСкачать

Окисление иодида калия KI + H2O2, KI + CuSO4, KI + Fe(NO3)3, KI + KMnO4Скачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

CuSO4 + NaOH Взаимодействие сульфата меди (II) с гидроксидом натрия в водном раствореСкачать

Уравнивание реакций горения углеводородовСкачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Задача на термохимические уравнения: разбор задания 27 | ХИМИЯ ЕГЭ 2022Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Химия ЦТ | Задачи по термохимическим уравнениямСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Тепловой эффект химических реакций. Термохимические уравненияСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать