Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Ваш ответ
Видео:Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

решение вопроса
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Похожие вопросы
- Все категории
- экономические 43,415
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,066
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Расчеты по термохимическим уравнениям реакций
Задача 1.5.
При сгорании 8,96 л (н.у.) бутана согласно термохимическому уравнению:
2С4Н10 + 13О2 = 8СО2 + 10Н2О + 5757 кДж выделилось:
1) 1151,4 кДж; 2) 2302,8кДж; 3) 4605,6 кДж; 4) 575,7кДж.
Дано: объем ацетилена: V(С4Н10) = 8,96 л.
Найти: количество выделившейся теплоты.
Р е ш е н и е:
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
8,96 л бутана дают х кДж (по условию)
44,8 л бутана дают 5757 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 1.
Ответ: № 1.
Задача 1.6
При полном сгорании некоторого количества бутена выделилось 541,4 кДж. При этом согласно термохимическому уравнению:
2С4Н8 + 12О2 = 8СО2 + 8Н2О + 5414 кДж объем образовавшегося СО2 (н.у.) составил:
1) 4,48 л; 2) 8,96 л; .3) 17,92 л; 4) 22,4 л.
Дано: Количество выделившейся теплоты: Q = 541,4 кДж.
Найти: объем углекислого газа (н.у.): V (CO2) = ?
Р е ш е н и е :
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления объема углекислого газа составляем пропорцию:
х л бутена дают 444 кДж (по условию)
179,2 л бутана дают 5414 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 3.
Ответ: V(CO2) = 17,92л.
Задача 1.7
При сгорании порции пропана выделилось 444 кДж теплоты. Согласно термохимическому уравнению:
С3Н8 + 502 = ЗСО2 + 4Н2О + 2220 кДж, объем (н.у.) затраченного кислорода равен:
1)44,8 л; 2) 17,92 л; 3) 22,4 л; 4) 11,2 л.
Дано: Количество выделившейся теплоты: Q = 444 кДж.
Найти: объем углекислого газа (н.у.): V (O2) = ?
Р е ш е н и е :
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления объема углекислого газа составляем пропорцию:
х моль кислорода требуется для получения 444 кДж (по условию)
5 моль кислорода требуется для получения 2220 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 3.
Ответ: V(O2) = 22,4л.
Видео:Химия | Задачи на термохимиюСкачать

Тренировочный вариант №2 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года
Тренировочная работа №5 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года, вариант 2, вариант ХИ2110502 с ответами и решениями. Ответы на тренировочный вариант Статград №5 ЕГЭ по химии 20.04.2022.
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) S, 2) Al, 3) O, 4) Fe, 5) Te Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1. Какие из указанных элементов имеют в возбуждённом состоянии конфигурацию внешнего уровня ns 2 np 3 nd 1 ? Запишите номера выбранных элементов в порядке возрастания. 2. Из указанного ряда выберите три элемента, принадлежащие одной подгруппе Периодической системы. Расположите их в порядке увеличения полярности связи в водородном соединении. Запишите в поле ответа номера выбранных элементов в нужной последовательности. 3. Из указанного ряда выберите два элемента, которые во многих соединениях проявляют степень окисления +3. Запишите в поле ответа номера выбранных элементов в порядке возрастания. 4. Из предложенного перечня выберите два вещества, в молекулах которых имеется тройная связь. Запишите номера выбранных ответов в порядке возрастания. 5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) амфотерного оксида; Б) сильного основания; В) кислой соли. Запишите в поле ответа выбранные цифры в нужной последовательности. 6. В двух колбах находился раствор сульфида аммония. В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выделился газ и выпал осадок, а во второй выделился газ, а раствор остался прозрачным. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. Запишите в поле ответа выбранные цифры в нужной последовательности. 7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 8. Установите соответствие между исходными веществами, вступающими в реакцию и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 9. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа номера выбранных веществ в нужной последовательности. 10. Установите соответствие между структурной формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 11. Из предложенного перечня выберите два вещества, в молекулах которых есть только σ-связи. 12. Из предложенного перечня выберите все вещества, способные окислять альдегиды. Запишите номера выбранных ответов в порядке возрастания. 13. Из предложенного перечня выберите два вещества, которые реагируют с пропиламином. Запишите номера выбранных ответов в порядке возрастания. 14. Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 15. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 16. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа выбранные цифры в нужной последовательности. 17. Из предложенного перечня выберите все реакции, которые происходят без изменения степеней окисления элементов. 18. Из предложенного перечня выберите все реакции, скорость которых возрастает при увеличении pH среды. Запишите номера выбранных ответов в порядке возрастания. 1) Cl2 + KOH → KCl + KClO + H2O 19. Установите соответствие между схемой реакции и свойством, которое проявляет элемент азот в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности. 20. Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности.
|
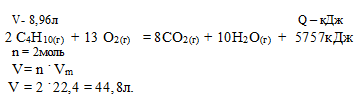
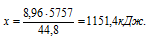
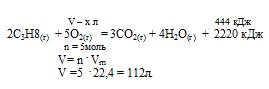
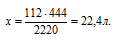






 MnO2 + 2NO2↑
MnO2 + 2NO2↑
 2CH3CHO
2CH3CHO CH3CH=CHC6H5
CH3CH=CHC6H5













