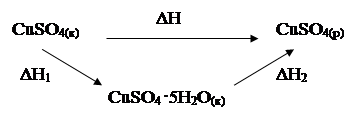Теплота, которая поглощается или выделяется при растворении одного моля вещества в таком количестве растворителя, чтобы образовался раствор с определенной моляльность m, называется интегральной теплотой растворения. Она зависит от концентрации химического соединения в растворе.
Примерная зависимость интегральной теплоты растворения от моляльности приведена на рисунке. Значение DH0 – первая интегральная теплота растворения. Она равна тепловому эффекту при растворении 1 моль вещества в бесконечно большом количестве растворителя. DH0 находят графической экстраполяцией DHm к m=0. Отрезок DHs на рисунке соответствует последней или полной интегральной теплоте растворения. Она равна теплоте растворения моля вещества в таком количестве растворителя, чтобы образовался насыщенный раствор.
Пользуясь интегральными теплотами растворения, можно найти теплоту образования кристаллогидрата из безводной соли и воды, например CuSO4 × 5H2O из CuSO4 и H2O. Рассмотрим процесс образования раствора сульфата меди, осуществляемый двумя путями.
В соответствии с законом Гесса DH2 = DHг + DH1. Определив экспериментально интегральную теплоту растворения кристаллогидрата и такого же количества безводной соли, можно найти теплоту (энтальпию) гидратообразования соли.
Цель работы: Определить интегральную теплоту растворения кристаллогидрата и безводной соли и рассчитать теплоту гидратообразования сульфата меди.
Приборы, посуда и реактивы:
Сосуд Дьюара
· Термометр с ценой деления 0,1°С
· Колба мерная на 250 мл
· Колба мерная на 50 мл
· Стакан термостойкий для нагревания воды
· Стакан для настройки термометра Бекмана на требуемую температуру
· Фарфоровая ступка с пестиком
· Сульфат меди (кристаллогидрат)
Опыт № 1.Определение теплоты (энтальпии) растворения кристаллогидрата CuSO4 × 5H2O
1. Медный купоросCuSO4 × 5H2O измельчают в фарфоровой ступке, взвешивают около 6,5 г с точностью до 0,01 г.
2. В калориметр наливают 250 мл дистиллированной воды комнатной температуры.
3. Помещают термометр в калориметр. Производят отсчет температуры через каждые 30 сек. до установления постоянного хода температуры (см. работу 1).
4. Вносят навеску CuSO4×5H2O в калориметр, быстро закрывают пробку, тщательно перемешивают и продолжают отсчет температуры до установления ее равномерного хода.
5. Строят график на миллиметровой бумаге, находят Dt по графику и рассчитывают теплоту растворения соли по формуле

где К – постоянная калориметра, n — количество растворенной соли, моль.
Опыт № 2. Определение теплоты (энтальпии) растворения безводного сульфата меди CuSO4
1. Около 8 г медного купороса измельчают в фарфоровой чашке. Нагревают, помешивая, пока не образуется белая безводная соль.
2. Полученную безводную соль немедленно пересыпают в бюкс с притертой крышкой.
3. Готовят калориметр к измерению: наливают в него 250 мл дистиллированной воды, устанавливают настроенный термометр Бекмана.
4. После охлаждения соли берут навеску 4,5 г с точностью до 0,01 г.
5. Определяют изменение температуры, сопровождающее растворение безводной соли, как описано в опыте №1.
6. По формуле (1) рассчитывают Q2 теплоту растворения безводной соли.
7. По разности Q1 иQ2рассчитывают теплоту (энтальпию) гидратообразования сульфата меди.
1. Дать определение понятий: «термодинамическая система», «открытая система», «закрытая система», «изолированная система». Привести примеры.
2. Дать определение понятия «процесс»? Дать определение изотермических, адиабатических, изобарических и изохорических процессов.
3. Дать определение понятий: работа, теплота, внутренняя энергия. Каковы общие черты теплоты и работы? Их отличия?
4. Что такое функция состояния? Привести примеры.
5. Содержание и формулировка 1-го начала термодинамики.
6. Первый закон термодинамики для различных процессов. Вывести математические выражения для теплоты в изохорном и изобарном процессах.
7. Что такое энтальпия, её физический смысл.
8. Закон Гесса, следствия из него (на примерах реакций).
9. Термодинамическая и термохимическая системы знаков для тепловых эффектов реакций.
10. Теплота образования, стандартная теплота образования. Расчет теплового эффекта по теплотам образования. Пример.
11. Теплота сгорания, стандартная теплота сгорания. Расчет теплового эффекта по теплотам сгорания. Пример.
12. Физический смысл постоянной калориметра.
13. Рассмотреть термохимическую схему расчета теплоты гидратации медного купороса на основе закона Гесса.
14. Теплота растворения. Почему процессы растворения веществ могут протекать не только с экзотермическим, но и с эндотермическим эффектом.
15. Дать определение следующим понятия: теплота нейтрализации, теплота электролитической диссоциации.
16. Сформулируйте закон постоянства теплот нейтрализации и объясните его.
17. Стандартная теплота образования СО (г) равна -111 кДж/моль. При сгорании 1 моль СО выделяется 283 кДж теплоты. Не прибегая к другим справочным данным, вычислите стандартную энтальпию образования углекислого газа.
18. Вычислить теплоту образования оксида мышьяка (III), если при образовании 39,6 г оксида мышьяка (III) выделилось 131,0 кДж тепла.
19. Рассчитать тепловой эффект реакции образования кристаллогидрата
если известны интегральные теплоты растворения MgSO4 

20. Тепловой эффект реакции С (тв.) + 1 /2О2 (г) = СО (г), протекающей при постоянном объеме и температуре 20°С, равен -108,9 кДж/моль. Определить тепловой эффект данной реакции при постоянном давлении при той же температуре.
21. При полном сгорании этилена С2Н4 + 3О2 → 2СО2 + 2Н2О(ж) выделилось 6226 кДж. Рассчитайте объем вступившего в реакцию кислорода (н.у.).
22. Исходя из термохимических уравнений
рассчитайте значение стандартной энтальпии реакции образования Н2О (ж):
23. Определите тепловой эффект химической реакции НNО2 (г) + 1 /2О2 (г) = HNO3 (г) по следующим данным и запишите термохимическое уравнение:
24. Для химической реакции СН3ОН (ж) + Н2 (г) → СН4 (г) + Н2О (г) рассчитайте тепловой эффект реакции, используя данные теплот сгорания веществ, и запишите термохимическое и термодинамическое уравнения.
25. Вычислить, какое количество теплоты выделится при нейтрализации 10 кг 15%-го раствора гидроксида натрия раствором азотной кислоты при стандартных условиях.
26. Для ниже записанных реакций вычислите тепловые эффекты и запишите термохимические уравнения:
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Этап индивидуальной работы
Дисциплина: Химия
Раздел 2. Общие закономерности химических процессов
УЧЕБНОЕ ЗАДАНИЕ № 5 «ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ ХИМИЧЕСКОЙ РЕАКЦИИ НА ОСНОВАНИИ ДАННЫХ ОПЫТА»
Лабораторная работа № 4 «Определение энтальпии гидратации безводного cульфата меди»
Этап индивидуальной работы
1. Разместите структурированную информацию (результат работы с информационными источниками) в ниже приведенную Табл. 1.
Таблица 1. Результаты работы с информационными источниками
| тема | «Определение энтальпии реакции присоединения кристаллизационной воды к безводной соли (энтальпия гидратации)» |
| форма организации информации | Энтальпию реакции присоединения кристаллизационной воды к безводной соли можно определить, зная изменение энтальпии при растворении безводной солии изменение энтальпии при растворении кристаллогидрата этой соли. В термохимии под энтальпией растворения понимают изменение энтальпии процесса растворения 1 моля вещества в большом количестве растворителя, т.е. в таком его количестве, когда дальнейшее разбавление раствора не влияет на величину энтальпии растворения (это так называемая дифференциальная энтальпия растворения). Энтальпия растворения веществ состоит в основном из двух слагаемых: энтальпии процесса перехода твердого или газообразного вещества в то состояние, в котором оно существует в растворе ∆Hр, и энтальпии процесса взаимодействия вещества с растворителем (энтальпия сольватации) ∆Hс. В зависимости от величины и знака этих двух слагаемых процесс растворения может быть эндотермическим или экзотермическим. Для газов ∆Hр 0, т.к. при их растворении затрачивается энергия на разрушение кристаллической решетки. Таким образом, процесс растворения соли может быть представлен в виде двух этапов: разрушение кристаллической решетки соли с образованием раствора ее и взаимодействия частиц соли с растворителем. Процесс же растворения кристаллогидрата соли состоит только из разрушения кристаллической решетки, т.к. взаимодействия частиц кристаллогидрата с растворителем, можно считать, не происходит (молекулы соли уже связаны с молекулами растворителя). Следовательно, энтальпия растворения безводной соли и ее кристаллогидрата отличается на величину энтальпии гидратации ∆Hгидр. |
2. Заполните таблицу 2, для этого рассмотрите схемы процесса растворения безводного сульфата меди (II), запишите термохимические уравнения и обозначения энтальпий для каждой стадии процесса:
Таблица 2. Стадии процесса растворения безводного сульфата меди (II)
| Схема и энтальпии процесса растворения | |||||||
| ΔH = ΔH1 + ΔH2 ΔН2 = – 11,48 кДж | ||||||
| Стадии процесса растворения CuSO4 | |||||||
| гидратация безводного сульфата меди (II) | CuSO4(к) + 5H2O(ж) = CuSO4 · 5H2O(к), ΔН1 | ||||||
| растворение кристаллогидрата меди (II) | CuSO4 ·5H2O(к) = CuSO4(р) + 5H2O(ж), ΔН2 |
3. Напишите отчет по лабораторной работе.Впишите в табл. 3 результаты наблюдений, формулы соединений, значения параметров и справочные данные, расчеты по формулам, выводы:
Результаты индивидуальных наблюдений и предварительные соображения
| Результаты наблюдений | ||
| вещество | формула с обозначением агрегатного состояния | цвет |
| безводный сульфат меди (II) | CuSO4(к) | белый |
| растворенный сульфат меди (II) | CuSO4 (р) | голубой |
| Расчеты | ||
| Значения параметров и справочные данные | ||
| Масса безводной соли (m1), г | ||
| масса воды (m2), г | ||
| масса раствора (m), г | 100+5=105 | |
| начальная температура (t1), 0 C | 25 о С | |
| конечная температура (t2), 0 C | 27 о С | |
| удельная теплоемкость раствора (c), Дж/(г·К) | 4,18 | |
| молярная масса CuSO4 (M), г/моль | ||
| Расчеты по формулам | ||
| Количество теплоты, выделившейся при растворении соли, кДж | 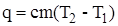 = =  | |
| Количество теплоты, выделяющейся при растворении 1 моль CuSO4, кДж/ моль |   | |
| Энтальпия растворения безводного сульфата меди (II), кДж/ моль | ΔН = – Q = – 26,8 кДж/моль | |
| Энтальпия гидратации безводного сульфата меди (II), кДж/ моль | ΔH1 = ΔH — ΔН2 ΔH1= –26,8 – 11,48 = – 38,28 | |
| Выводы | ||
| Гидратация безводного сульфата меди является экзотермическим процессом. | ||
| Термохимическое уравнение гидратации безводного сульфата меди (II): CuSO4(к) + 5H2O(ж) = CuSO4 · 5H2O(к), ΔН1= – 38,28 кДж/моль |
Количество теплоты, выделившейся при растворении соли, кДж
q=cm(T2−T1)= 
4. Прикрепить свою работу в разделе «Загрузка файла» для проверки.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Практическое занятие №3, №4 Тема 1. Первое начало термодинамики. Термохимия (Раздел 2 — Термохимия) продолжение
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №3, №4
Тема 1. Первое начало термодинамики. Термохимия
(Раздел 2 — Термохимия) продолжение
Общая цель: Вам необходимо овладеть учебной программой данного занятия и научиться применять учебный материал в своей будущей профессии.
Сделайте записи в рабочей тетради по плану:
- дата; номер занятия; тема занятия; цель занятия; основные вопросы темы. конспект лабораторной работы:
— аппаратура и материалы;
— методика выполнения (рисунки, таблицы, основные формулы);
— экспериментальные результаты (расчеты);
— ответы на контрольные вопросы для защиты лабораторной работы.
Учебные вопросы занятия:
Выполнение лабораторной работы №1. Расчет. Защита лабораторной работы №1 по контрольным вопросам.
Ваши действия при подготовке к занятию и отработке программы занятия
При подготовке к данному занятию
Повторите раздел 2 (Термохимия) темы 1 (Химическая термодинамика. Термохимия) рабочей учебной программы дисциплины «Физическая химия».
Это очень важно, так как этот материал является базовой основой для получения новых знаний и на нем строится программа занятия.
Обратите внимание на:
Закон Гесса. Следствия из закона Гесса (три следствия) Теплота образования. Теплота сгорания. Влияние температуры на тепловые эффекты. Закон Кирхгофа. Рабочее уравнение Кирхгофа.
При отработке 1-го учебного вопроса обратите внимание на: технику безопасности при работе в химической лаборатории.
При отработке 2-го учебного вопроса обратите внимание на: расчет мольной теплоты нейтрализации, растворения, кристаллизации и диссоциации; таблицы с термодинамическими свойствами органических и неорганических соединений.
При отработке 3-го учебного вопроса обратите внимание на: Примеры решения задач на заданные темы (Сборник примеров и задач по физической химии).
Лабораторная работа № 1
Определение теплоты нейтрализации сильной кислоты сильным основанием. Определение теплоты растворения и теплоты гидратации соли. Определение теплоты диссоциации слабой кислоты.
Цель работы. Овладеть навыками измерения тепловых эффектов химических реакций и ознакомиться с методом определения теплоемкости твердых образцов в массивном калориметре.
Аппаратура и материалы
Для опытов 1–3: Калориметрическая установка, 1 М растворы КОН NaOH, HC1 и HN03, мерный цилиндр на 500 мл, безводный сульфат меди (II) CuSO4, безводный карбонат натрия Na2CO3, аналитические весы, пробирка с делением «10 мл», термометр от 0 до 50 °С, секундомер, растворы 4 М NaOH, 0,1 М НС1, HNO3, СН3СООН, НСООН, химический стакан на 500 мл, мешалка.
Работа состоит из трех опытов.
Опыт 1. Определение теплоты нейтрализации сильной кислоты сильным основанием
Для измерения тепловых эффектов реакций используют калориметры или калориметрические установки (рис. 1). В наружный сосуд (стакан на 0,8 л) вставляется калориметрический стакан меньшей вместимости (0,5 л). Во избежание потерь теплоты через стенки калориметрического стакана между сосудами помещают пробковые прокладки. Калориметрический стакан закрывают деревянной крышкой с отверстиями для термометра (цена деления 0,1 К), мешалки и воронки. Мешалку присоединяют к электромотору или приводят в движение вручную.
Теплоту, выделяющуюся или поглощающуюся в калориметре, вычисляют по формуле

где Т2 и T1 – конечная и начальная температуры жидкости в калориметрическом стакане; 
Рисунок 1 – Калориметрическая установка: 1 – мешалка, 2 – воронка, 3 – калориметрический стакан, 4 – наружный сосуд, 5 – крышка, 6 – термометр
Согласно теории электролитической диссоциации нейтрализация сильной кислоты сильным основанием в разбавленном растворе отвечает уравнению Н+ + ОН — = Н2О. Стандартная теплота нейтрализации сильной кислоты сильным основанием равна при 298 К -55,9 кДж на один моль образующейся воды. Термохимическое уравнение реакции нейтрализации имеет вид
Н+(ж) + ОН-(ж) = Н20(ж), ДH °298 = — 55,9 кДж/моль
В опыте используют 1 М растворы КОН, NaOH, HC1 и HN03. Для нейтрализации берут равные объемы (120 – 180 мл) растворов кислоты и щелочи.
Получите у преподавателя задание и запишите его в лабораторный журнал. Взвесьте сухой калориметрический стакан (c точностью до 0,1 г) или узнайте его массу у лаборанта. Соберите калориметрическую установку (рис. 2.1) и через воронку 2 налейте в сосуд заданный объем 1 М раствора щелочи; запишите температуру раствора щелочи Тщ с точностью до 0,1 К.
Налейте в мерный цилиндр такой же объем 1 М раствора кислоты и измерьте температуру раствора Тк с той же точностью. Начальная температура смеси кислоты и щелочи Т1 — среднее арифметическое от Тщ и Тк. При работающей мешалке 1 через воронку 2 быстро влейте кислоту в калориметрический стакан и отметьте самую высокую температуру Т2, которую покажет термометр 6 после сливания растворов.
🌟 Видео
Решение задач на термохимические уравнения. 8 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Решение задач на первое начало термодинамики. ТермохимияСкачать

Внутренняя энергия и энтальпия. Расчет энтальпии. Практическая часть. 10 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химия | Задачи на термохимиюСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

ВАРИАНТ 13-2 РАЗБОР | CHEMISTRY LEONCHUKСкачать

ЕГЭ. Химия. Задания № 21 - 34. Подробный разбор демо-версии ФИПИСкачать

Занятие 10. ЕГЭ по химии. Неорганическая химияСкачать

МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Энтальпия реакции. Решение задачи.Скачать

ЕГЭ. Химия. #Урок12. Задачи на последовательность химических реакцийСкачать