Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Видео:78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Особенности термохимических уравнений.
Тепловые эффекты химических реакций
Тепловой эффект реакции —количество теплоты, которое выделяется или поглощается системой в результате протекания химической реакции. Это может быть DН (Р,Т = const) или DU (V,T = const).
Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается (DН 0),называются эндотермическими.
Как и другие функции состояния, энтальпия зависит от количества вещества, поэтому ее велечену (DН) обычно относят к 1 моль вещества и выражают в кДж/моль.
Обычно функции системы определяют при стандартных условиях, в которые, кроме параметров стандартного состояния, входит стандартная температура T = 298,15 К (25°C). Часто температуру указывают в виде нижнего индекса ( 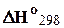
Термохимические уравнения
Термохимические уравнения реакций — уравнения, в которых указан тепловой эффект, условия реакций и агрегатные состояния веществ. Обычно в качестве теплового эффекта указывается энтальпия реакции. Например,
Тепловой эффект можно записать в уравнении реакции:
В химической термодинамике первая форма записи употребляется чаще.
Особенности термохимических уравнений.
1.Тепловой эффект зависит от массы реагирующего вещества, поэ-
тому его обычно рассчитывают на один моль вещества. В связи с этим в термохимических уравнениях можно использовать дробные коэффициенты. Например, для случая образования одного моля хлороводорода термохимическое уравнение записывается так:
или Н2 + Cl2 = 2HСl, DH 0 298 = -184 кДж.
2. Тепловые эффекты зависят от агрегатного состояния реагентов; оно указывается в термохимических уравнениях индексами: ж — жидкое, г — газообразное, т — твердое или к – кристаллическое, р – растворенное.
3.С термохимическими уравнениями можно производить алгебраические действия (их можно складывать, вычитать, умножать на любые коэффициенты вместе с тепловым эффектом).
Термохимические уравнения более полно, чем обычные, отражают происходящие при реакции изменения — они показывают не только качественный и количественный состав реагентов и продуктов, но и количественные превращения энергии, которыми данная реакция сопровождается.
Дата добавления: 2016-07-05 ; просмотров: 7788 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
Решая которое, находим, что:
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
📸 Видео
Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Задача на термохимические уравнения: разбор задания 27 | ХИМИЯ ЕГЭ 2022Скачать

Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать

Тепловой эффект реакции. ЗадачиСкачать

Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

Решение задач по термохимическим уравнениям. Практическое занятие. Видеоурок 40. Химия 9 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Термохимическое уравнение | ХимияСкачать

ЭКЗО- и ЭНДО- термические реакции. Химия – ПростоСкачать

Решение задач на термохимические уравнения | Химия | Курсы подготовки к ЦЭ /ЦТ 2024 | АдукарСкачать

79. Тепловой эффект реакции. Термохимические уравнения (часть 2)Скачать

Термохимические уравнения. Экзо- и эндотермические реакции. Задачи на тепловой эффект | Урок 17Скачать

Химия ЦТ | Задачи по термохимическим уравнениямСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Тепловой эффект реакции. Термохимические уравненияСкачать
