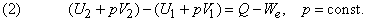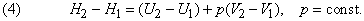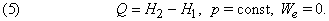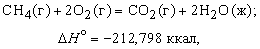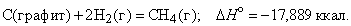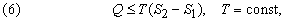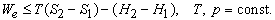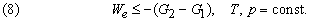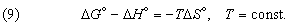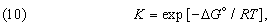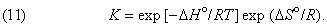ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА, рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям. Поскольку химическое превращение обычно сопровождается высвобождением или поглощением определенного количества теплоты, оно, как и другие явления природы (в том числе электрические и магнитные), сопровождающиеся тепловыми эффектами, подчиняется фундаментальным принципам (началам) термодинамики. Химическая термодинамика определяет, в первую очередь, условия (такие, как температура и давление) протекания химических реакций и равновесных состояний, которых они достигают. Анализ тепловых явлений базируется на трех фундаментальных принципах, подтвержденных данными многочисленных наблюдений. См. также ТЕРМОДИНАМИКА.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Первое начало термодинамики.
Первое начало термодинамики по существу выражает закон сохранения энергии. Для системы, окруженной замкнутой границей, через которую не происходит переноса вещества, справедливо соотношение
где U1 и U2 – энергии системы в состояниях 1 и 2; Q – теплота, полученная от внешних источников; W – работа, совершенная системой над внешними телами в процессе, посредством которого система переходит из состояния 1 в состояние 2. Если процесс – химическая реакция, то обычно ее проводят в таких условиях, чтобы можно было отделить энергию химического превращения от энергии, связанной с одновременными изменениями температуры или давления. Поэтому энергию (теплоту) химической реакции обычно определяют в условиях, в которых продукты находятся при тех же температуре и давлении, что и реагенты. Энергия химической реакции тогда определяется теплотой Q, полученной от окружающей cреды или переданной ей. Измерение Q может быть проведено с помощью калориметра подходящего типа. Реакцию можно было бы провести, например, в металлическом сосуде, погруженном в теплоизолированный объем воды, изменение температуры которой (обычно на несколько градусов) соответствует теплоте реакции. Для количественных измерений калориметр обычно градуируют с помощью независимого электронагревателя или проведения в сосуде химической реакции, теплота которой известна.
Медленные реакции особенно трудны для калориметрических измерений, поскольку нужны сложные меры предосторожности для защиты калориметра от теплообмена с окружающей средой. Так называемый адиабатический калориметр целиком погружается в изотермическую оболочку с независимым нагревом, температура которой во время опыта поддерживается как можно более близкой к температуре внутри калориметра. Реакции, высвобождающие теплоту (отрицательная Q в уравнении (1)), называются экзотермическими, а реакции, в процессе которых теплота поглощается, – эндотермическими.
Как показывает уравнение (1), внутренняя энергия реагирующей системы определяется не только количеством высвобожденной или поглощенной теплоты. Она также зависит от того, сколько энергии система затрачивает или приобретает посредством произведенной работы. При постоянном давлении p полная работа, совершенная системой, описывается выражением p (V2 – V1) +We, где первый член – работа расширения, связанная с изменением объема от V1 до V2 , а We – дополнительная, или т.н. «полезная», работа, совершенная системой помимо работы расширения. Если работа совершается над системой, то оба члена имеют отрицательный знак. Поэтому уравнение (1) можно преобразовать к виду
Вводят вспомогательную меру энергии системы Н, определяемую общим соотношением
Если давление постоянно (обычно в качестве стандартного берется давление 1 атм), то изменение функции Н, называемой энтальпией системы, отличается от изменения ее внутренней энергии на величину работы расширения:
За исключением газофазных систем, это отличие пренебрежимо мало по сравнению с типичными тепловыми эффектами реакций. Однако для общего случая из формулы (2) следует, что теплота Q , измеренная при постоянном давлении и We = 0 (обычное условие протекания химической реакции, если она не происходит, например, в аккумуляторе или гальваническом элементе), равна изменению энтальпии системы:
В любом случае, поскольку разность H2 – H1, как и U2 – U1 , определяется, согласно первому началу термодинамики, исключительно начальным и конечным состояниями системы и не зависит от способа перехода из начального состояния в конечное, суммарное количество теплоты, поглощенное в процессе химического превращения при постоянных температуре и давлении (при We = 0), зависит только от исходных реагентов и конечных продуктов и не зависит от того, через какие промежуточные стадии протекает реакция.
Этот вывод был сделан Г.И.Гессом в 1840 на основе экспериментальных фактов еще до классических опытов Джоуля, продемонстрировавших эквивалентность теплоты и других форм энергии. Гесс показал, что теплота реакции, протекающей через несколько последовательных стадий, равна алгебраической сумме теплот отдельных промежуточных реакций. Закон Гесса, как отметил Г.Гельмгольц в 1847, служит прямым экспериментальным подтверждением применимости закона сохранения энергии к энергетике химических реакций. В пределах ограничений, налагаемых уравнением (5), этот закон был многократно подтвержден многочисленными дальнейшими исследованиями.
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Термохимические уравнения.
Теплота, высвобождаемая или поглощаемая конкретной химической реакцией, пропорциональна степени превращения реагентов, определяемой по количеству любого из расходуемых либо образующихся продуктов. Изменение внутренней энергии или энтальпии реагирующей системы определяют по химическому уравнению реакции. Например, сгорание смеси газообразных метана и кислорода описывается термохимическим уравнением
Здесь буквы в скобках обозначают агрегатные состояния веществ (газ или жидкость). Символом D H ° обозначается изменение энтальпии в химическом превращении при стандартных давлении 1 атм и температуре 298 K (25 ° С) (знак градуса в верхнем индексе H указывает, что данная величина относится к веществам в стандартных состояниях (при p = 1 атм и T = 298 K)). Химическая формула каждого вещества в таком уравнении обозначает вполне определенное количество вещества, а именно его молекулярную массу, выраженную в граммах. Молекулярная масса получается сложением атомных масс всех элементов, входящих в формулу, с коэффициентами, равными числу атомов данного элемента в молекуле. Молекулярная масса метана равна 16,042, и, согласно предыдущему уравнению, при сгорании 16,042 г (1 моля) метана получаются продукты, энтальпия которых на 212,798 ккал меньше энтальпии реагентов. В соответствии с уравнением (5) такое количество теплоты высвобождается, когда 1 моль метана сгорает в кислороде при постоянном давлении 1 атм. Соответствующее уменьшение внутренней энергии системы в ходе реакции составляет 211,615 ккал. Разница между D H ° и D U ° равна – 1,183 ккал и представляет работу p (V2 – V1), совершаемую, когда 3 моля газообразных реагентов сжимаются при давлении 1 атм до 1 моля газообразного диоксида углерода и 2 молей жидкой воды.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Стандартная теплота образования.
Из закона сохранения энергии следует, что, когда вещество образуется из атомов и (или) более простых веществ, внутренняя энергия или энтальпия системы меняется на определенную величину, называемую теплотой образования данного вещества. Теплота образования может быть определена различными способами, в том числе прямыми калориметрическими измерениями и путем косвенного расчета (на основе закона Гесса) из теплоты реакции, в которой участвует данное вещество. При проведении расчетов пользуются стандартными (при p = 1 атм и T = 298 K) теплотами образования веществ, входящих в уравнение реакции. Например, стандартную теплоту (энтальпию) образования метана можно вычислить с помощью термохимического уравнения
Хотя эта реакция практически неосуществима при 25 ° С, стандартная теплота образования метана косвенно рассчитывается по измеренным теплотам сгорания метана, водорода и графита. На основе закона Гесса устанавливается, что теплота реакции равна разности между теплотами сгорания веществ, указанных в левой части уравнения, и теплотами сгорания веществ, указанных в правой части уравнения реакции (взятых с соответствующими знаками и стехиометрическими коэффициентами).
Помимо использования термохимических данных для решения проблем практического использования тепловой энергии, они широко применяются при теоретической оценке энергий химических связей. Этот вопрос подробно рассмотрен Л.Полингом в книге Природа химической связи (The Nature of the Chemical Bond, 1960).
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Второе начало термодинамики.
Второе начало термодинамики по существу определяет однонаправленность переноса теплоты в разнообразных процессах, происходящих спонтанно при определенных условиях, а именно – направление переноса теплоты от тел с высокой температурой к телам с низкой температурой. Второе начало термодинамики может быть сформулировано следующим образом: не может быть спонтанного общего переноса теплоты от тел менее нагретых к телам более нагретым.
Перенос теплоты Q от источника с температурой Т можно охарактеризовать величиной Q/T. Для любого спонтанного процесса переноса теплоты, при котором источник с температурой Т1 отдает количество теплоты Q1, а в результате переноса система с температурой Т2 получает количество теплоты Q2, справедливо неравенство Клаузиуса Q1/Т1 Ј Q2 /Т2 . Таким образом, для того чтобы мог происходить перенос теплоты, Т1 должна быть больше Т2. Для перехода системы из одного состояния в другое более общая формулировка второго начала термодинамики гласит, что направление переноса теплоты определяется условием
где S2 – S1 – разность энтропий системы в двух состояниях. Если скомбинировать это условие с уравнениями (2) и (3), получим соотношение, имеющее важное значение для описания химической реакции при постоянных температуре и давлении:
Если ввести функцию состояния системы
то формулировка второго начала термодинамики примет следующую форму:
Это значит, что для системы, находящейся при постоянных температуре и давлении, могут происходить только такие переходы из одного состояния в другое, для которых полезная работа We не превышает определенной максимальной величины, равной разности D G двух значений G. Если G1 > G2, то переход из состояния 1 в состояние 2 (скажем, от реагентов к продуктам) может происходить самопроизвольно даже при We = 0. Если G2 > G1, то переход из состояния 1 в состояние 2 может быть осуществлен только за счет внешней полезной работы; это значит, что работа We должна быть отрицательной величиной, как, например, электрическая энергия, затрачиваемая при электролитическом разложении воды. Если G1 = G2, то система находится в равновесии.
Функция G называется гиббсовой энергией, или изобарно-изотермическим потенциалом. Разнообразными методами было показано, что величина D G ° , «стандартная гиббсова энергия образования», по аналогии со стандартной энтальпией образования может быть определена для химических соединений относительно элементов из данных по химическим равновесиям и химическим процессам. Стандартная гиббсова энергия образования D G ° , характеризующая какую-либо химическую реакцию, может быть установлена с помощью таблиц стандартных гиббсовых энергий образования путем вычитания суммы их значений для реагентов из суммы значений для продуктов. Значения D G ° для чистых химических элементов при 25 ° С и давлении 1 атм принимаются равными нулю.
Стандартная гиббсова энергия химической реакции по существу является мерой того, насколько реагенты и продукты далеки от равновесия друг с другом при данной температуре и стандартном давлении 1 атм. Согласно второму началу термодинамики, все самопроизвольные изменения системы и ее окружения стремятся привести их в конечное состояние равновесия. Следовательно, именно изменение гиббсовой энергии, а не изменение энтальпии или внутренней энергии определяет возможность протекания химической реакции. В частности, от изменения гиббсовой энергии в ходе химической реакции зависит разность потенциалов между электродами химических источников тока.
Стандартное изменение гиббсовой энергии связано со стандартным изменением энтальпии, согласно (7), соотношением
Можно показать, что функциональная связь между D G ° для данной химической реакции и константой равновесия К, определяемой законом действующих масс, имеет вид
где R – универсальная газовая постоянная, равная 1,987 Ч 10 — 3 ккал/(K Ч моль). С учетом формулы (9) это соотношение можно представить в эквивалентной форме:
Таким образом, константа равновесия состоит из двух множителей, один из которых содержит энтальпию реакции (или, при определенных условиях, внутреннюю энергию реакции), а другой – энтропию.
Важное следствие общей термодинамической теории состоит в том, что можно вывести уравнение, связывающее зависимость D G ° (и следовательно, К) от температуры со значением D H ° . Поэтому можно точно установить направление и равновесное состояние химической реакции при одной температуре из известных данных по химическому равновесию при другой температуре. В частности, изменение D G ° с температурой пропорционально величине D H ° и имеет противоположный знак. Так, все эндотермические реакции ( D H ° положительна) ускоряются (большая отрицательная величина D G ° и большее значение К) с ростом температуры. Соответственно все экзотермические реакции замедляются с ростом температуры.
Видео:Основы химической термодинамикиСкачать

Третье начало термодинамики.
Еще один важный принцип химической термодинамики был установлен в первой четверти 20 в. В.Нернстом. Он экспериментально установил, что, когда температура приближается к абсолютному нулю, стандартные энтропии D S ° для многих химических реакций стремятся к нулю. Поскольку этот результат не следует из первого и второго начал термодинамики, он получил название третьего начала термодинамики. Оно не имеет столь же общего характера, как первые два начала, однако большинство очевидных исключений или аномалий получило удовлетворительное объяснение с учетом особенностей кристаллического строения конкретных веществ.
Значение принципа Нернста состоит в том, что зависимость энтропии реакции от температуры может быть выведена, согласно термодинамической теории, исключительно из данных по теплоемкости для отдельных участвующих в реакции веществ. Это значит, что, если известно значение D S ° при какой-либо одной температуре (при T = 0 D S ° = 0), значения энтропии реакции при других температурах вычисляются исключительно из тепловых измерений. Аналогично этому, величина D H ° может быть получена из калориметрических данных путем непосредственного измерения теплоты данной реакции либо косвенно, путем измерения теплот других реакций и применения закона Гесса. Следовательно, подстановка полученных значений D H ° и D S ° в уравнение (9) или (11) дает гиббсову энергию или константу химического равновесия исключительно из тепловых измерений. Это позволяет предвидеть направление и равновесное состояние химической реакции еще до того, как найден способ ее проведения.
Для практического применения третьего начала термодинамики требуются точные результаты измерений теплоемкости вплоть до самых низких доступных температур, желательно до температуры жидкого гелия (около 4 К). Это направление термодинамических исследований химических явлений стимулировали криогенные исследования, выполненные в последние десятилетия. См. также ФИЗИКА НИЗКИХ ТЕМПЕРАТУР.
Исаев С.И. Курс химической термодинамики. М., 1975
Киреев В.А. Методы практических расчетов в термодинамике химических реакций. М., 1975
Еремин Е.Н. Основы химической термодинамики. М., 1978
Термодинамика и кинетика химических процессов. Л., 1981
Глазов В.М., Павлова Л.М. Химическая термодинамика и фазовые равновесия. М., 1988
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Конспект лекции на тему «Химическая термодинамика»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
ЛЕКЦИЯ № 4 ПОНЯТИЕ О ХИМИЧЕСКОЙ ТЕРМОДИНАМИКЕ
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Термодинамика – это наука, изучающая превращения одних видов энергии в другие. Изучением этих превращений, применительно к химическим реакциям и физико-химическим процессами занимается химическая термодинамика.
Химические процессы могут протекать с поглощением или выделением энергии, причем эта энергия может поглощаться или выделяться в виде теплоты, света, электричества. Чаще всего это тепловая энергия. Раздел химии, изучающий тепловые эффекты химических реакций, называется термохимией.
Количество тепла, которое может выделяться или поглощаться в химическом процессе, называется тепловым эффектом реакции Q. Тепловой эффект реакции выражается в КДж/моль. В зависимости от знака Q различают экзотермические и эндотермические реакции.
Экзотермические реакции протекают с выделением теплоты (Q>0). В них внутренняя энергия реагирующих частиц переходит в тепловую энергию окружающей среды.
Эндотермические реакции с поглощением теплоты (Q
Уравнения химических реакций с указанием теплового эффекта называют термохимическими уравнениями. В термохимических уравнениях указывается фазовое состояние реагирующих и образующихся веществ, а стехиометрические коэффициенты могут быть дробными.
Выделение теплоты при взаимодействии различных веществ указывает на то, что эти вещества еще до реакции в скрытой форме обладали определенным запасом энергии. Такая форма энергии, высвобождающаяся в ходе химических реакций и физических процессах, называется внутренней энергией U . Внутренняя энергия U выражается в КДж/моль. Внутренняя энергия складывается из потенциальной и кинетической энергии частиц, образующих данное вещество или систему. U = E кин + E потен
Кинетическая энергия — это энергия поступательного, вращательного и колебательного движения ядер и электронов в атомах.
Потенциальная энергия обусловливается силами отталкивания и притяжения между частицами, входящими в состав ядер, атомов, молекул. Внутренняя энергия зависит от природы вещества, массы, температуры. Она является мерой кинетической энергии и объема, от которого зависит потенциальная энергия, т.е. U = f ( V , T ). Определить или рассчитать абсолютную величину U невозможно, т.к. нельзя перевести систему в состояние лишенное энергии, но можно определить изменение ∆ U в любом процессе.
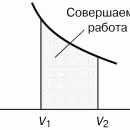
Например, если некоторая система за счет поглощения теплоты Q переходит из состояния 1 в состояние 2, то эта теплота расходуется на изменение внутренней энергии системы ∆ U и на совершение работы против внешних сил (в химических реакциях под А против внешних сил подразумевают А против внешнего давления) А: Q = ∆ U + А . Где ∆ U = U 2 – U 1 , А = р ∆ V , где р -давление, ∆ V изменение объема

Приведенное уравнение выражает закон сохранения энергии.
При изохорном процессе V = const , следовательно А = 0, не совершается никакая работа, тогда тепловой эффект равен изменению внутренней энергии: QV = ∆ U .
При изобарном процессе р = const А = р ( V 2 – V 1 ). Тогда математическое выражение для теплового эффекта химической реакции примет вид:
Где Н2 – энтальпия системы в конечном состоянии
Н1 – энтальпия системы в начальном состоянии
тогда ∆Н – изменение энтальпии.
Т.о. энтальпия – это термодинамическая величина, определяющая энергию необходимую для перевода системы из одного состояния в другое и учитывающая изменение внутренней энергии и совершаемую работу. Энтальпия, как и все термодинамические величины, является функцией состояния, т.к. ее изменение определяется только начальным и конечным состоянием системы и не зависит от путей перехода.

Для экзотермических реакций ∆Н 0, для эндотермических ∆Н > 0, Q
Для сравнения термодинамических величин различных процессов изменение Н и U относят к стандартным условиям (Т = 298 0 К, Р = 101,3 КПа). Изменение энтальпии при образовании в стандартных условиях 1 моля химического соединения из устойчивых простых веществ называется стандартной энтальпией образования ∆Н 0 298 КДж/моль. Энтальпии образования устойчивых простых веществ (Н2, О3, Са) условно приняты равными 0.
Термохимические расчеты осуществляются на основании закона Гесса и 2-х следствий из него.
Закон Гесса: Тепловой эффект химической реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от числа и характера промежуточных стадий.
Классическая термодинамика изучает обратимые процессы, отсюда
1-е следствие: Энтальпия образования химического соединения равна по абсолютной величине и противоположна по знаку энтальпии разложения этого соединения: ∆Н обр. = — ∆Н разл.
2-е следствие: Изменение энтальпии химической реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции. Для реакции общего вида
а А + b B = с С + d D ,
где а, b , с, d – стехиометрические коэффициенты
А, B – исходные вещества,
С, D – продукты реакции,
математическое выражение 2-е следствия из закона Гесса будет иметь вид:
∆Н х.р. = (с ∆Н 0 298С + d ∆Н 0 298 D ) – (а ∆Н 0 298А + b ∆Н 0 298 B )
Можно было бы предположить, что самопроизвольно протекают только те реакции, в которых энтальпия системы уменьшается. Однако известны экзотермические реакции, не протекающие при высоких температурах и эндотермические реакции, происходящие при небольших температурах. Следовательно, возможность самопроизвольного протекания процесса определяется не только изменением энтальпии, но и другой термодинамической величиной, которая называется энтропией.
Энтропия S (Дж /моль К) характеризует стремление системы перейти из более упорядоченного состояния в менее упорядоченное состояние и является количественной характеристикой степени неупорядоченности системы.
Энтропия является функцией состояния и ее изменение подчиняется 2-му следствию из закона Гесса. Для термохимических расчетов изменение энтропии приводят к стандартным условиям. Энтропия в этих условиях называется стандартной и обозначается S 0 298 .
В отличие от энтальпии энтропия простых веществ не равна 0; ее абсолютные значения можно определить экспериментально; энтропия зависит от температуры.
Т.о. система самопроизвольно может переходить в термодинамически более устойчивое состояние 2-мя способами:
1 – уменьшением энтальпии (количественно характеризуется энтальпийным фактором ∆Н),
2 – увеличением энтропии (количественно характеризуется энтропийным фактором Т∆ S ).
В состоянии термодинамического равновесия оба эти фактора компенсируют друг друга и тогда справедливо равенство: ∆Н = Т∆ S , на основании, которого можно рассчитать температуру, при которой установится равновесие: Т = ∆Н / ∆ S .
Возможность самопроизвольного протекания процесса в прямом или обратном направлении определяется разностью ∆Н — Т∆ S . Чем больше эта разность, тем выше вероятность протекания процесса. Поэтому эту разность называют движущей силой процесса или изменением энергии Гиббса и обозначают ∆G (КДж/моль), т.е. ∆G = ∆Н — Т∆ S .
Энергия Гиббса зависит от природы веществ, их количества и температуры. Абсолютную величину энергии Гиббса определить нельзя, но можно определить ее изменение в каком либо процессе, т.е. ∆G является функцией состояния, и к ней применимо второе следствие из закона Гесса. Для сравнения ∆G различных процессов, ∆G приводят к стандартным условиям.
Изменение энергии Гиббса при образовании в стандартных условиях 1 моля химического вещества из устойчивых простых веществ называется стандартной энергией Гиббса и обозначается ∆G 0 298. Размерность этой величины КДжмоль -1 .
Стандартные энергии Гиббса простых веществ принимаются равными 0.
Характер изменения стандартной ∆G 0 298 при химических реакциях позволяет судить о возможности протекания процесса в прямом или обратном направлении.
При ∆G = 0 система находится в состоянии термодинамического равновесия
При ∆G > 0 процесс самопроизвольно протекает в обратном направлении
Т.о. условием самопроизвольного протекания процесса является уменьшение ∆G системы.
Зависимость направленности процессов от соотношения ∆Н и Т∆ S
Из уравнения ∆G = ∆Н — Т∆ S , видно, что самопроизвольно протекают любые реакции (∆G S > 0). При других сочетаниях ∆Н и ∆ S возможность протекания реакции определяется соотношением энтропийного и энтальпийного факторов.
При низких температурах Т∆ S принимает небольшие значения Þ при условии ∆Н > Т∆ S самопроизвольно могут протекать экзотермические реакции.
При высоких температурах, при которых множитель Т∆ S велик, самопроизвольно могут протекать эндотермические реакции, если ∆Н S .
Видео:78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Физическая химия: конспект лекций
Данное учебное пособие предназначено для студентов химических факультетов высших учебных заведений педагогического и технического направления. Изложены основные концепции и процессы, составляющие современную физическую химию. Материал соответствует государственному стандарту. Пособие рекомендовано в помощь студентам при подготовке к экзаменам.
Оглавление
- Введение
- ЛЕКЦИЯ № 1. Идеальный газ. Уравнение состояния реального газа
- ЛЕКЦИЯ № 2. Химическая термодинамика
Приведённый ознакомительный фрагмент книги Физическая химия: конспект лекций предоставлен нашим книжным партнёром — компанией ЛитРес.
ЛЕКЦИЯ № 2. Химическая термодинамика
Химическая термодинамика — наука, изучающая условия устойчивости систем и законы.
Термодинамика — наука о макросистемах.
Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические явления в термодинамике исследуются с помощью основных законов термодинамики. Состояние рассматриваемых объектов в термодинамике определяется непосредственно измеряемыми величинами, характеризующими вещества; механизм процесса и сама структура вещества не рассматриваются.
В химической термодинамике изучается применение законов термодинамики к химическим и физико-химическим явлениям.
В ней рассматриваются главным образом:
1) тепловые балансы процессов, включая тепловые эффекты физических и химических процессов;
2) фазовые равновесия для индивидуальных веществ и смесей;
3) химическое равновесие.
Тепловые балансы составляют на основе первого закона термодинамики. На основе второго и третьего законов проводят анализ фазового и химического равновесий.
Изучение законов, которые описывают химические и физические равновесия, имеет огромное значение в химической термодинамике. Значение их позволяет решать задачи для производственной и научно-исследовательской работы. Рассмотрим основные задачи:
1) определение условий, при которых данный процесс становится возможным;
2) нахождение пределов устойчивости изучаемых веществ в тех или иных условиях;
3) устранение побочных реакций;
4) выбор оптимального режима процесса (давления, концентрации реагентов и т. д.).
Основные понятия и определения
1. Системы и их классификация
Система — тело или несколько тел, находящихся во взаимодействии между собой (диффузия, теплообмен, химическая реакция) и отделенных от окружающей среды.
Состояние системы в термодинамике определяется с помощью набора переменных, называемых параметрами состояния и характеризующих термодинамическое состояние при равновесии. Всякое изменение, происходящее в системе и связанное с изменением хотя бы одного из параметров состояния, называется термодинамическим процессом.
Системы имеют определенные границы, отделяющие их от внешней среды, и могут быть гомогенными или гетерогенными.
Гомогенная система — система, в которой все макроскопические свойства в любых ее частях имеют одно и то же значение или непрерывно меняются от точки к точке. Примеры: ненасыщенные растворы, пар, газовые смеси. Составленные части гомогенной системы не могут быть выделены из нее с помощью простых механических приемов (фильтрования, отбора и т. д.).
Гетерогенная система — система, составные части которой отделены друг от друга видимыми поверхностями раздела, на которых происходят резкие скачкообразные изменения какого-либо свойства. Примеры: насыщенный раствор какой-либо соли, находящийся в равновесии с кристаллами этой соли, две несмешивающиеся жидкости и т. д.). Составные части таких систем могут быть отделены друг от друга с помощью механических операций.
Совокупность тел, энергетически взаимодействующих между собой и с другими телами, обменивающихся с ними веществом, называется термодинамической системой.
Системы делят на изолированные (это те системы, которые не обмениваются энергией и веществом с другими системами), открытые (те системы, которые обмениваются с окружающей средой и веществом, и энергией), закрытые (системы, в которых есть только обмен энергией).
2. Термодинамические параметры. Термодинамические показатели. Баланс напряжений
Любая ТДС характеризуется параметрами: температура, давление, плотность, концентрация, мольный объем. В любой ТДС обязательно протекают процессы, и они могут быть равновесными, неравновесными, обратимыми и необратимыми.
Если в ТДС определенное свойство системы не будет изменяться во времени, т. е. оно будет одинаковым во всех точках объема, то такие процессы — равновесные.
В неравновесных процессах свойство системы будет изменяться во времени без воздействия окружающей среды.
Обратимые процессы — процессы, в которых система возвращается в первоначальное состояние.
Необратимые — когда система не возвращается в первоначальное состояние.
Функции могут зависеть от пути процесса. Функции, которые зависят от начального и конечного состояний системы и не зависят от пути процесса, — функции состояния; внутренняя энергия, энтальпия, энтропия и другие — полные дифференциалы.
Функции, которые зависят от начального и конечного состояний системы и зависят от пути процесса, не являются функциями состояния и не являются полными дифференциалами Q, A.
Функции можно разделить на две группы: экстенсивные и интенсивные.
Экстенсивное свойство системы прямо пропорционально массе системы и обладает аддитивностью (можно складывать): V, H, Uвн, S, G, F.
Интенсивное свойство системы не зависит от массы системы и не обладает свойством аддитивности: Q, A, T, P.
Давление — параметр состояния, определяемый силой, действующей в теле на единицу площади поверхности по нормали к ней. Оно характеризует взаимодействие системы с внешней средой.
Температура определяет меру интенсивности теплового движения молекул.
Значение градуса температуры и начало ее отсчета произвольны. В качестве эталона можно было бы выбрать не воду, а любое другое вещество (лишь бы его свойства однозначно изменялись с температурой, были воспроизводимы и легко поддавались измерению).
Такая произвольность исчезает, если пользоваться термодинамической (абсолютной) шкалой температур, основанной на втором законе термодинамики. Начальной точкой этой универсальной шкалы является значение предельно низкой температуры — абсолютный нуль, равный 273,15 о С.
Уравнение, связывающее термодинамические параметры системы в равновесном состоянии, — уравнение состояния.
Вследствие взаимосвязи между свойствами системы для определения ее состояния достаточно указать лишь некоторое число свойств. Так, состояние газа можно считать заданным, если указаны два параметра, например, температура и объем, а значение третьего параметра — давления — можно определить из уравнения состояния
Графически это уравнение является уравнением поверхности, построенной на трех взаимно перпендикулярных осях, каждая из которых соответствует одному термодинамическому параметру. Таким образом, термодинамическая поверхность — геометрическое место точек, изображающих равновесные состояния системы в функциях от термодинамических параметров.
Пусть дан изолированный сосуд, который разделен полупроницаемой перегородкой (рис. 1). В первой части сосуда температура Т1, во второй — температура Т2; Т1 > Т2.
Молекулы, ударяясь о полупроницаемую перегородку, будут отдавать часть энергии, а другие — принимать ее, без механического перемещения.
Форма передачи энергии от одной части системы к другой называется теплотой Q.
Мера переданной энергии от одной системы к другой — количество теплоты. Q не является функцией состояния и не является полным дифференциалом ΔQ.
Работа процесса — это энергия, передаваемая одним телом другому при их взаимодействии, не зависящая от температуры этих тел и не связанная с переносом вещества от одного тела к другому.
Обмен энергией между системой и внешней средой обуславливается работой, совершаемой этой системой:
Работа (А) определяется суммой произведений сил, действующих на систему сил (давления и изменения объема).
Работа не является полным дифференциалом, ΔА.
Если протекают равновесные процессы, то работа равновесного процесса будет максимальной величиной, по сравнению с неравновесным процессом
Если телу сообщают определенное количество теплоты, то это значит, что тело надо нагреть, а охладить систему — произвести действие, обратное нагреванию, т. е. отвести энергию.
Работа и теплота являются количественными характеристиками двух форм обмена энергией между системой и окружающей средой.
Понятие внутренней энергии
Внутренняя энергия системы Uвнскладывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движений атомов и атомных групп, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия.
Uвнявляется полным дифференциалом, она не зависит от пути процесса, а зависит от начального и конечного состояний системы, она однозначно непрерывна и конечна. Абсолютное значение Uвнопределить нельзя, можно определить только ее изменения.
Q и А качественно и количественно характеризуют форму передачи энергии, взаимосвязь между Q, A, Uвнустанавливает первый закон термодинамики.
К термодинамическим показателям относятся те, которые можно рассчитать, используя законы термодинамики, исходя из условий, что система находится в равновесии. Напряжение разложения:
где ΔG — изменение термодинамического потенциала;
п — число электронов, участвующих в химической реакции;
F — число Фарадея.
где А — максимальная работа, которую способна совершить система в равновесном состоянии.
где Q — тепловой эффект реакций;
Up — термодинамическая характеристика электрохимической системы, которая мало зависит от условий электролиза.
Отклонение системы — поляризация. Электрохимическая реакция является гетерогенным процессом, и ее скорость может лимитироваться одной из стадий:
1) подвод реагирующего вещества к границе раздела фаз;
2) разряд и ионизация;
3) отвод продуктов реакции.
Поляризация, определяемая медленной стадией массопереноса — концентрационная. Если медленной стадией является стадия разряда ионизации, то поляризация называется перенапряжением. Природа и значение поляризации зависят от многих факторов: природа реагирующего вещества, материал электрода, состояние поверхности электрода, плотность тока, состав раствора и режим электролиза. Кинетический параметр — параметр, определяемый в реальных условиях электрохимической системы: ρ тока, ЕАКТИВ, коэффициент диффузии, коэффициент переноса α (на катод), β (на анод) — доля расхода на процесс:
1) сила тока в электрохимическом аппарате J= iKSед загрузки, A, Z, iK — в зависимости от электролита;
2) скорость электролиза — образование массы вещества за единицу времени
где q — электрохимический эквивалент, v электролиза — J тока,
если в 1 см 2 — v — i тока.
Баланс напряжений. Напряжение на электрохимическом аппарате определяет расход электроэнергии при электролизе. Баланс напряжений на электрохимическом аппарате складывается из следующих составляющих:
🔥 Видео
Внутренняя энергия и энтальпия. 10 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химическая термодинамикаСкачать

ЭнтальпияСкачать

ФИЗИКА ЗА 5 МИНУТ - ТЕРМОДИНАМИКАСкачать

Энтальпия реакции. Решение задачи.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Законы Термодинамики. Что Такое Термодинамика?Скачать

Решение задач на первое начало термодинамики. ТермохимияСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

ФИЗИЧЕСКАЯ ХИМИЯ (ТЕРМОДИНАМИКА). ОСНОВНЫЕ ПОНЯТИЯ: СИСТЕМЫ, ПАРАМЕТРЫ, ФУНКЦИИСкачать

Химическая термодинамикаСкачать