- Соли азотной кислоты — нитраты
- Реакция термического разложения нитрата серебра
- Реакция термического разложения нитрата серебра
- Реакция взаимодействия магния и азотной кислоты
- Реакция взаимодействия хлорида серебра (I), пероксида водорода и гидроксида калия
- Реакция взаимодействия оксида иттрия и оксида алюминия
- Выбрать язык
- Популярные записи
- Предупреждение.
- Нитрат серебра I
- Содержание
- Получение
- Физические свойства
- Химические свойства
- Применение
- Использование в медицине
- Токсичность
- 🔍 Видео
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы , причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов ( до Mg в электрохимическом ряду ) разлагаются до нитрита и кислорода.
Например , разложение нитрата натрия:
Исключение – литий .
Видеоопыт разложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов ( от Mg до Cu, включая магний и медь ) и литий разлагаются до оксида металла, оксида азота (IV) и кислорода:
Например , разложение нитрата меди (II):
- Нитраты малоактивных металлов ( правее Cu ) – разлагаются до металла, оксида азота (IV) и кислорода.
Например , нитрат серебра:
Исключения:
Нитрат железа (II) разлагается до оксида железа (III):
Нитрат марганца (II) разлагается до оксида марганца (IV):
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители .
Например , смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
Видео:Термическое разложение нитрата калияСкачать

Реакция термического разложения нитрата серебра
Видео:Разложение нитрата серебра / Decomposition of silver nitrateСкачать

Реакция термического разложения нитрата серебра
Уравнение реакции термического разложения нитрата серебра:
Реакция термического разложения нитрата серебра.
В результате реакции образуются серебро, оксид азота (IV) и кислород.
Реакция протекает при условии: при температуре 300-500 °C.
Формула поиска по сайту: 2AgNO3 → 2Ag + 2NO2 + O2.
Реакция взаимодействия магния и азотной кислоты
Реакция взаимодействия хлорида серебра (I), пероксида водорода и гидроксида калия
Реакция взаимодействия оксида иттрия и оксида алюминия
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:Термическое разложение нитрата калияСкачать

Нитрат серебра I
| Нитрат серебра | |
|---|---|
 | |
| Систематическое наименование | Нитрат серебра |
| Традиционные названия | Адский камень, ляпис |
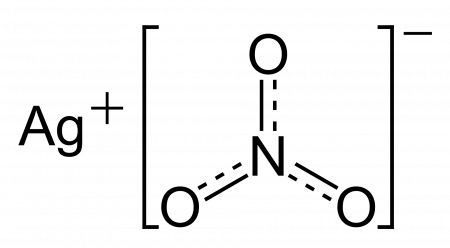
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352 |
| Температура | |
| • плавления | 209,7 |
| • разложения | 440 |
| Мол. теплоёмк. | 93,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | −124,4 кДж/моль |
| Растворимость | |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C) |
| Показатель преломления | 1,744 |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES | |
| RTECS | VW4725000 |
| ChEBI | 32130 |
| Номер ООН | 1493 |
| ChemSpider | 22878 |
| ЛД50 | 20 мг/кг (собака, орально) 800 мг/кг (кролик, орально) |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС | 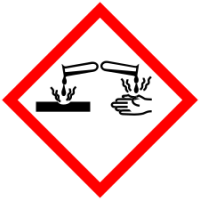    |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Видео:Разложение нитратов за 5 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 4.1 Использование в медицине
- 5 Токсичность
- 6 Галерея
Видео:9. ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ НИТРАТОВ/ Нужно знать/ ЕГЭ химия 2020Скачать

Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O
Видео:Получение нитрата серебра (химия)Скачать

Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г ; растворимость в метиловом спирте — 3,6 г/100 г ; в этиловом спирте — 2,12 г/100 г ; в ацетоне — 0,44 г/100 г ; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Видео:Взаимодействие нитрата серебра и хлорида натрия. Химический опытСкачать

Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
2 AgNO3 → 350∘C 2 Ag + 2 NO2 + O2 Реагирует с щелочью с образованием оксида: 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O в этаноле, при -50 градусах, образуется гидроксид серебра AgNO3 + NaOH → C2H5OH−50 AgOH ↓ + KNO3 ↓
Видео:Термическое разложение солей аммония #химия #химияпросто #химияегэ #огэхимия #easy.chemis.tryСкачать

Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
Видео:Разложение нитрата калия при нагревании. Реакция нитрата калия с углем - 9 - 11 классСкачать

Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
🔍 Видео
Разложение НИТРАТА СЕРЕБРА AgNO3. Получения СЕРЕБРА. Опыты по химии дома. Chemical experiments.Скачать

Смываю посеребрение простым способом.Скачать

Получение НИТРАТА СЕРЕБРАСкачать

Химические уравнения. Как составлять химические уравнения.Скачать

169 Термическое разложение нитрата калияСкачать

разложение нитрата меди при нагреванииСкачать

Очистка серебра. Получение нитрата серебра ~ 99,9Скачать

САМЫЕ ДОРОГИЕ СЕРЕБРЯНЫЕ КОНТАКТЫ! ТЕХНИЧЕСКОЕ СЕРЕБРОСкачать

Разложение нитратовСкачать

Получение СЕРЕБРА из нитрата серебра. Реакция МЕДИ и НИТРАТА СЕРЕБРА. Опыты по химии.Getting SILVER.Скачать

Чистое серебро растет на глазах. Реакция восстановления серебра из нитрата серебра медью.Скачать