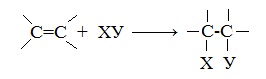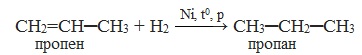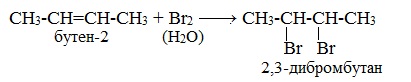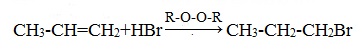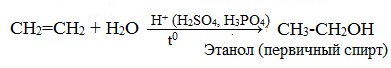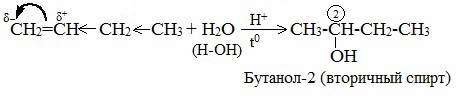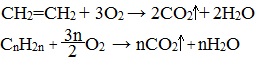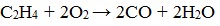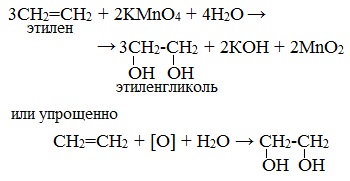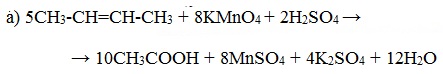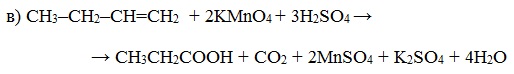Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
- Химические свойства алкенов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкенов
- 1.3. Гидрогалогенирование алкенов
- 1.4. Гидратация
- 1.5. Полимеризация
- 2. Окисление алкенов
- 2.1. Каталитическое окисление
- 2.2. Мягкое окисление
- 2.2. Жесткое окисление
- 2.3. Горение алкенов
- 3. Замещение в боковой цепи
- 4. Изомеризация алкенов
- Термическое разложение алкенов уравнение реакции
- Реакции присоединения
- Реакции окисления
- Изомеризация алкенов
- Получение и свойства алкенов
- Физические свойства алкенов
- Получение алкенов
- Химические свойства алкенов
- Реакции присоединения
- Изомеризация алкенов
- Полимеризация алкенов
- Реакции окисления
- Применение алканов
- 🎦 Видео
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
Видео:Химия с нуля — Химические свойства АлкеновСкачать

1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |
| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
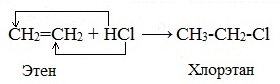
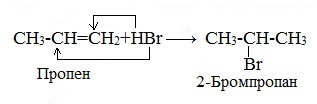
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
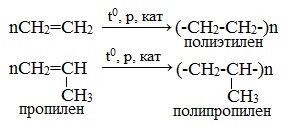
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
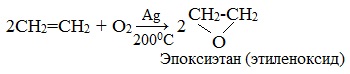
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |
| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Термическое разложение алкенов уравнение реакции
Алкены обладают большой реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи. π–Связь менее прочная, чем σ-связь. Она легко разрушается под воздействием различных реагентов.
Наличие подвижной, легко поляризуемой π–связи приводит к тому, что алкены легко вступают в реакции присоединения.
В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
Реакции присоединения
1. Гидрирование или гидрогенизация (присоединение водорода)
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия при нагревании и повышенном давлении.
При гидрогенизации олефины превращаются в предельные углеводороды.
2. Галогенирование (присоединение галогенов)
Присоединение галогенов по двойной связи С=С происходит легко при обычных условиях (при комнатной температуре, без катализатора). Образуются дигалогеналканы:
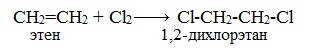
Реакция с бромной водой (р-р Br2 в Н2О) является качественной реакцией на наличие двойной связи. Происходит обесцвечивание красно-бурой окраски бромной воды.
Видеоопыт «Взаимодействие этилена с бромной водой»
3. Гидрогалогенирование (присоединение галогеноводородов)
При взаимодействии алкенов с галогеноводородами (НCl, НBr) образуются галогеналканы.
Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X — галоген).
Присоединение галогеноводородов к алкенам несимметричного строения происходит по правилу В.В. Марковникова.
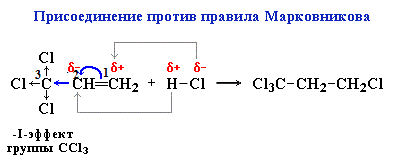
Присоединение против правила Марковникова происходит в том случае, когда заместитель при двойной связи оттягивает электронную плотность на себя, т.е проявляет электроноакцепторные свойства (–I и/или –М-эффект).
В молекуле трихлопропена Сl3C-CH=CH2 группа СCl3 проявляет отрицательный индуктивный эффект и π -электронная плотность связи С=С смещается к менее гидрогенизированному атому углерода. В результате на атоме С(2) возникает частичный отрицательный заряд δ- , а на атоме С(1) – частичный положительный заряд δ+. При взаимодействии с галогеноводородом водород присоединяется к менее гидрогенизированному атому углерода, а галоген – к более гидрогенизированному:
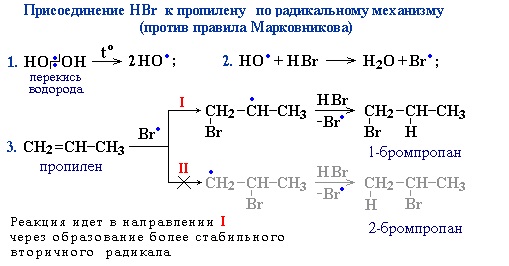
Также в присутствии какого-либо органического пероксида полярные молекулы галогеноводородов реагируют с алкенами не по правилу Марковникова.
Это связано с тем, что в присутствии перекиси реакция присоединения идет не по электрофильному, а по радикальному механизму.
При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются одноатомные спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов.
Присоединение воды к несимметричным алкенам идет по правилу Марковникова.
Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, содержащихся в газах крекинга нефти (попутных газов), а также в коксовых газах.
5. Реакции полимеризации
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и др.
Реакции окисления
1. Горение
А) Полное (избыток О2).
Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
Как и все углеводороды, алкены горят в кислороде, и при этом образуют диоксид углерода и воду:
Б) Неполное (недостаток О2).
2. Неполное каталитическое окисление
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 200 0 С серебряным катализатором, то образуется оксид алкена (эпоксид). Циклические оксиды широко используются в органическом синтезе.
3. Окисление перманганатом калия в нейтральной или щелочной среде (реакция Вагнера)
Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов.
В результате этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4 и выпадает коричневый осадок оксида марганца (IV).
Видеоопыт «Взаимодействие этилена с раствором перманганата калия»
Эта реакция используется как качественная реакция на алкены и другие непредельные углеводорода.
4. Окисление перманганатом калия в кислой среде
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи с образование а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2):
Изомеризация алкенов
Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3).
Изомеризация алкенов приводит или к перемещению π–связи:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение и свойства алкенов
Способы получения и свойства алкенов имеют существенные отличия по сравнению с алканами. Двойная связь в составе углеродной цепи алкенов очень реакционноспособна, поэтому они охотно вступают в реакции присоединения, в отличие от алканов, для которых характерны реакции замещения. Далее подробно рассмотрим способы получения, физические и химические свойства алкенов.
Видео:Уравнивание реакций горения углеводородовСкачать

Физические свойства алкенов
Физические свойства алкенов, такие как температура плавления и кипения немного ниже температуры кипения соответствующих алканов.
Первые представители данного класса с C1по C4 — газообразные вещества, практически не имеющие запаха, C5-C17 – жидкости с резким запахом, более 17 атомов углерода – твердые вещества.
Растворимость. Они плохо растворимы в воде, и хорошо растворимы в органических соединениях. Их плотность меньше плотности воды.
Алкены-неполярные соединения, практически нерастворимые в воде и растворимые в органических растворителях. Они менее плотные, чем вода.
Температура плавления и кипения. Температура кипения/плавления увеличивается прямо пропорционально относительной молекулярной массы соединения. В таблице представлены некоторые физические характеристики алкенов, а на рисунке зависимость температур их кипения/плавления от числа углеродных атомов.
Устойчивость алкенов. В целом цис-алкен менее устойчив, чем его стерео транс-изомер. Это обусловлено нестабильностью цис-изомера вследствие влияния стерического фактора.
Видео:Химические свойства алкеновСкачать

Получение алкенов
Алкены получают следующими способами:
1.Термический крекинг алканов. При Т=450-700°С разложение алканов приводит к образованию более низкомолекулярных алканов и алкенов:
2.Дегидрирование алканов. Реакция протекает в присутствии катализаторов Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO при Т
3.Неполное гидрирование алкинов в присутствии катализатора (Ni, Pt, Pd) при T
4.Реакция отщепления (элиминирование) – дегидратация, дегалогенирование, дегидрогалогенирование.
- Дегидратация спиртов при Т≥ 150°С, в присутствии водоотнимающего агента — серной кислоты:
- Дегидрогалогенирование моногалогеналкановпод действием спиртового раствора щелочи:
- Дегалогенирование дигалогеналканов при действии активных металлов:
При протекании реакций элиминирования с участием спиртов и моногалогеналканов отщепление атома водорода происходит от менее гидрогенизированного атома углерода (т.е. того атома углерода, который соединен с наименьшим числом атомов водорода). Это правило известно, как правило Зайцева.
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Химические свойства алкенов
Химические свойства алкенов обусловлены наличием двойной связи, которая состоит из сильной сигма (σ) связи и слабой пи (π) связи. Типичные реакции алкенов протекают с разрывом этой более слабой π-связи и формированием двух σ-связей. При взаимодействии электофильного агента (E + ) с алкеном образуется очень реакционноспособный карбкатион, который очень быстро присоединяет нуклеофильный агент (Nu — ):
1 стадия – образование карбкатиона протекает медленно:
2 стадия – присоединение нуклеофила протекает очень быстро:
Реакции присоединения
1.Гидрирование алкенов в присутствии платинового или никелевого катализатора. Реакция является экзотермической.
2.Галогенирование алкенов в инертном растворителе, например, четыреххлористый углерод. Алкены реагируют с галогенами с образованием дигалоалканов. Реакционная способность галогенов уменьшается в ряду: хлор > бром > йод.
Для обнаружения двойной углерод-углеродной связи используют бром. При добавлении к алкену 5% раствора брома в тетрахлорметане, последний обесцвечивается, что указывает на наличие двойной связи в молекуле.
3.Гидрогалогенирование алкенов концентрированными водными растворами галогенводородов. Реакционная способность растет в ряду HI > HBr > HCl.
Симметричные алкены дают только один продукт из-за эквивалентности двух атомов углерода.
В несимметричных алкенах добавление галогенводорода происходит таким образом, что атом галогена (отрицательная часть молекулы) присоединяется к атому углерода, который соединен с меньшим количеством атомов водорода (т.е. наименее гидрогенезированный). Это правило известно как правило Марковникова (1869 г.):
Однако в некоторых случаях присоединение галогенводорода происходит против правила Марковникова. Например, в присутствии кислорода и пероксидов проявляется пероксидный эффект:
Присоединение против правила Марковникова может также идти в случае наличия в молекуле алкена электронноакцепторных групп, например, -СООН, –СN, –CHal3 (Hal–галоген), –C(O)–R, –COOR, –NO2, –N=O, –SO3H и т.п.:
4.Гидратация алкенов в присутствии разбавленных кислот и катализатора. Например, при пропускании смеси этена и пара над фосфорной кислотой и кремнеземом под давлением 65 атм, а при 300С получают этанол.
5.Сульфирование алкенов концентрированной серной кислотой протекает в соответствии с правилом Марковникова:
6.Гипогалогенирование алкенов происходит по правилу Марковникова:
7.Алкилирование алкенов в кислой среде:
8.Присоединение альдегидов алкенами (реакция Принса):
Изомеризация алкенов
Полимеризация алкенов
Полиприсоединение — это процесс, с помощью которого большое количество молекул одного вида объединяются (без выделения простых молекул, таких как НHal, Н2О и т.д.) для образования гигантской молекулы, называемой полимером. Алкены подвергаются полимеризации при нагревании под давлением в присутствии подходящих катализаторов. Например, при нагревании этена до 1000 о С под давлением 1000 атм. в присутствии кислорода получают полиэтилен.
Реакции окисления
Окисление алкенов происходит легко, но продукт окисления зависит от окисляющего агента. Существует множество вариантов окисления алкенов. Рассмотрим основные из них:
- Горение алкенов. Алкены, как и алканы, очень горючие. Алкены горят светящим пламенем. Реакции их горения являются экзотермическими.
- Окисление кислородом воздуха при Т=200-500 о С, в присутствии серебряного катализатора или надкислотами (реакция Прилежаева) ведет к образованию эпоксидов:
- Окисление алкенов под действием холодного щелочного раствора перманганата калия приводит к образованию дигидроксильных соединений (диолы или гликоли). Перманганат калия при этом обесцвечивается, поэтому реакция является качественной на присутствие кратных связей. Такая реакция носит имя Вагнера:
- Окисление алкенов под действием подкисленного раствора перманганата или бихромата калия или окиси хрома (III) приводит к образованию кислоты и кетона:
- Озонирование алкенов приводит к образованию озонидов, которые далее под действием воды в присутствии восстановителя образуют альдегиды (Реакция Гарриеса). Окисление алкенов озоном с последующим разложением образовавшегося озонида водой называют озонолизом. Характер продуктов (альдегидов и кетонов), образующихся вследствие озонолиза, зависит от расположения двойной связи в материнском алкене. Поэтому такая реакция обеспечивает очень удобный способ определения положения двойной связи в любой молекуле:
Более высокомолекулярные алкены, содержащие длинную С-С цепь, обладают алкан-подобной структурой. Вследствие этого они могут вступать в реакции замещения подобно алканам.
Применение алканов
Где применяются представители ненасыщенных соединений -алкены? Этилен — ценное сырье для химического производства. Из него получают стирол, винилхлорид, этанол, уксусный альдегид, уксусную кислоту, и также дихлорэтан.
Полимеризацией алкенов получают различные полимеры, смазочные материалы и резиновые изделия.
В среднем мировое производство полиэтилена составляет 100 миллионов тонн в год. В промышленных объемах из пропилена получают полипропилен. Кроме того, пропилен — стартовый материал для производства окиси, изопропилового спирта, кумола, бутиральдегида, глицерина.
Бутены, главным образом, необходимы производстве полиизобутилена, метилэтилкетона, бутилкаучука, изопрена. Изобутилен — превосходное химическое сырье для производства третичного бутанола, бутилкаучука, а также изопрена. Применяется при алкилировании фенолов для изготовления сурфактантов (особые вещества, покрывающие альвеолы легких).
Сополимеры с бутенами используются в качестве изолятора и добавок для масел.
Высшие алкены используются не только в производстве полимерных материалов, но также и в производстве высших органических спиртов.
🎦 Видео
Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Как написать уравнения реакции полимеризации?Скачать

Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакции разложения. Как понять?Скачать

2.3. Алкены: Химические свойстваСкачать

Физические и химические свойства алкенов. 1 часть. 10 класс.Скачать

7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать

29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

65. Что такое реакция гидратации и реакция дегидратацииСкачать

Реакции присоединения в алкенах | Химия 10 класс | УмскулСкачать

Правило Марковникова В.В. в реакциях присоединения у алкЕнов и алкИнов.Скачать