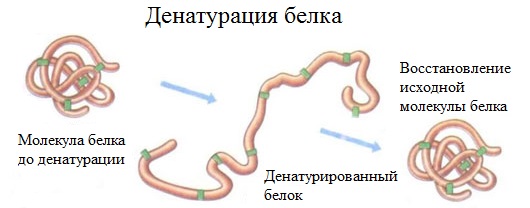
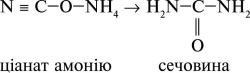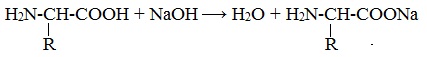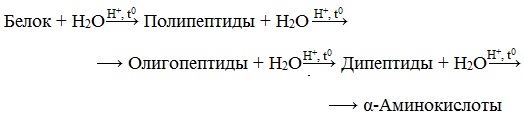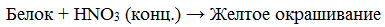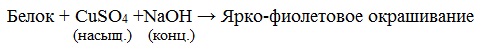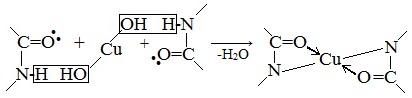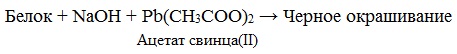Денатурация – разрушение вторичной, третичной структуры белка под действием различных факторов: температура, действие кислот, солей тяжёлых металлов, спиртов и т.д.
При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы.
Первичная структура, а, следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых групп, облегчается воздействие на белки протеолитических ферментов, а, следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработке пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий. Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). К денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приемы широко используют в пищевой и биотехнологии.
Качественные реакции на белки:
а) При горении белка – запах палёных перьев.
б) ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца):
Белок +HNO3 → жёлтая окраска
в) биуретовая реакция, (на пептидные связи)
Раствор белка +NaOH + CuSO4 → фиолетовая окраска
Гидролиз
Белок + Н2О → смесь аминокислот
г) ) цистеиновая реакция (на остатки аминокислот, содержащих серу):
белок + NaOH + Pb (CH3COO)2 → чёрное окрашивание.
Гидратация
Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличивается.
Биохимические функции белков. Функции белков в природе:
· структурные (кератин шерсти, фиброин шелка, коллаген);
· двигательные (актин, миозин);
· запасные (казеин, яичный альбумин);
· защитные (иммуноглобулины) и т.д.
Существуют белки, выполняющие специфические функции, например рецепторные, — обеспечивают передачу импульсов между нервными клетками и др.
Белки – необходимая составная часть пищи человека, отсутствие или недостаток их в пище может вызвать серьёзные заболевания.
Генетическая связь между органическими соединениями.
Генетическая связь ( от греч. «генезис» — происхождение).
Генетические связи — это связи между классами соединений, основанные на получении одного класса веществ с другого.
Генетическая связь отражает возможность взаимных превращений.
Правило генетических связей:
1) количество стрелок в схеме соответствует количеству уравнений химических реакций, которые необходимо сложить;
2) соединения, записанные перед стрелочкой обязательно должны вступить в химическую реакцию;
3) соединения, записанные после стрелочки должны образоваться в результате реакции.
Имея правила генетических связей давайте вместе совершим такое преобразование: С→СО2 → Н2СО3→СаСО3
Поэтому для неметаллов схема будет иметь такой вид:
Неметалл→ Кислотный оксид→ Кислота→Соль.
Изучая углеводороды, мы убедились в их разнообразии, которая обусловлена способностью атомов Углерода образовывать молекулы линейного, разветвленного, циклического строения; сочетаться между собой с помощью простых и кратных связей. А еще — образовывать гомологические ряды и изомеры.
Сравнив общие формулы алканов, алкенов и алкинов, можно заметить, что они отличаются количеством атомов Водорода в молекулах. Итак, реакциями гидрирования и дегидрирования можно переходить от одного класса углеводородов к другому. Существует также связь между насыщенными, ненасыщенными углеводородами и бензолом. Так, из метана реакцией дегидрирования можно получить ацетилен. А с него реакцией тримеризации добыть бензол:
Итак, при всем разнообразии углеводородов между ними существует взаимосвязь, что отражается во взаимных превращениях веществ. Это открывает огромные возможности для химического синтеза.
Вещественный мир природы чрезвычайно разнообразен, и вместе с тем все вещества взаимосвязаны. Генетическая связь между органическими и неорганическими веществами заключается, прежде всего, в том, что органические вещества можно добыть из неорганических. Например, при нагревании
неорганического вещества цианата аммония образуются органическое вещество мочевина (NH2)2CO:
Ярким доказательством существования генетической связи между органическими и неорганическими веществами являются также круговорот биогенных элементов в природе. Следовательно, все вещества генетически связаны между собой. Генетическая связь заключается в том, что каждое вещество может химически взаимодействовать с веществами других классов. Органические вещества могут взаимодействовать с неорганическими. Их можно синтезировать из неорганических и превращать в неорганические.
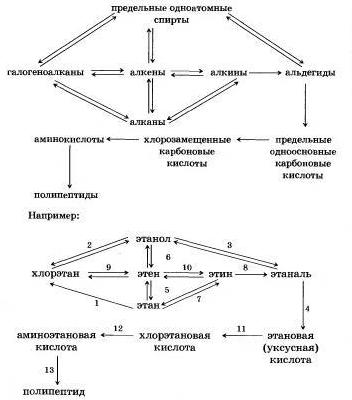
В органической химии также следует различать более общее понятие — генетическая связь и более частное понятие генетический ряд. Если основу генетического ряда в неорганической химии составляют вещества, образованные одним химическим элементом, то основу генетического ряда в органической химии (химии углеродных соединений) составляют вещества с одикиконым числом атомов углерода в молекуле. Рассмотрим генетический ряд органических веществ, в который включим наибольшее число классов соединений:
Каждой цифре над стрелкой соответствует определенное уравнение реакции (уравнение обратной реакции обозначено цифрой со штрихом):
Контроль знаний:
1.Дать определение амидной связи.
2. Дать характеристику структурам белка, составу аминокислот.
3.Какие элементы входят состав белка?
4.Опишите физические и химические свойства белков.
5.Какие вещества образуются при гидролизе белков?
6.Укажите число возможных изомерных аминов, имеющих молекулярную формулу СзН9N: а) два; б) три; в) четыре; г) пять.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр.169-173, Л1. Стр.174-177,178-183,пересказ конспекта лекции №14.
Лекция № 15.
Тема: Химия в повседневной жизни. Правила безопасной работы со средствами бытовой химии. Бытовая химическая грамотность. Химическое загрязнение окружающей среды и его последствия.
Основные понятия и термины по теме: правила безопасной работы со средствами бытовой химии, понятие бытовой химической грамотности.
План изучения темы
(перечень вопросов, обязательных к изучению):
2.Правила безопасной работы со средствами бытовой химии. Бытовая химическая грамотность.
3.Химическое загрязнение окружающей среды и его последствия.
Содержание лекции:
В любой отрасли человеческой деятельности мы неизбежно соприкасаемся с веществами и используем их свойства и взаимодействие между собой. Химия, обладая огромными возможностями, умножает плодородие почвы, создает невиданные ранее материалы, облегчает труд человека, экономит время, создает ему уют и комфорт, одевает, сохраняет его здоровье, изменяет внешность людей. Использование людьми достижений современной химии требует общей культуры, большой ответственности и знаний.
Бытовые химикаты.
К товарам бытовой химии относят клеи, абразивные материалы, средства для стирки и мытья, средства для чистки, лакокрасочные товары, средства по уходу за жильем. предметами быта, садом и огородом и др.
Клеи — это полимеры, или соединения на их основе, применяемые для соединения различных материалов. Действие клея основано на образовании между ними и клюющим материалом адгезии. В состав клея входят полимеры (клеящие вещества), растворители, наполнители, пластификаторы и др. Безопасность клея зависит от свойств полимеров, растворителей, пластификаторов и др. Функциональных свойств клеев относят их клеящую способность, термическую и химическую устойчивость и универсальность. Надежность определяется долговечностью склеенных соединений, хранением клеев и др. Эластичные свойства зависят от их цвета, прозрачности, упаковки, четкости маркировки.
Косметика, духи, растворители, лекарства, пищевые добавки, пестициды (препараты для сельского хозяйства), средства бытовой химии — это все химикаты. Полный учет и оценка качества химикатов никогда не проводились.
Ежегодно к торговле поступают одна-две тысячи новых названий химикатов, большинство из которых не проходят предварительной апробации и не получают оценки к возможного влияния на окружающую среду. Данные, необходимые для полной оценки воздействия на окружающую среду, здоровье людей, охватывают всего 10% пестицидов, 18% лекарств, 80% химических веществ, используемых в торговле и технологических процессах, не всесторонне проверено на токсичность.
Ряд химикатов ежегодно изымается из продажи после испытаний национальными контрольными органами. В развитых странах учреждения, которые осуществляют контроль за химическими веществами, обмениваются результатами исследований и сообщают о новых ограничениях в ассортименте химикатов. Импортеры среди стран, не включены в эту систему и не получают соответствующей информации. Они также не имеют собственной службы контроля (к тому же имеет место контрабанда химикатов). Вследствие недостаточной информированности персонала предприятий и населения о токсичные вещества, отсутствия соответствующей маркировки, нередко наблюдается нарушение гигиенических и экологических требований во время их использования на производстве и в быту, что приводит к острым и хроническим отравлениям, загрязнения окружающей среды. Покупая химикаты, обращайте внимание на наличие экологической маркировки. Пусть этот указатель станет для вас не менее важным, чем эффективность и стоимость химиката.
Во время использования химикатов в своей квартире защищайте органы дыхания, по крайней мере, повязкой, а в случае использования лаков, клеев и «сильных» растворителей — респиратором или противогазом, защищайте руки резиновыми перчатками. Все, что стираете, чистите, моете, используя средства бытовой химии, прополощите достаточным количеством проточной воды. Остатки этих веществ на белье, панелях, т.п. в виде микрочастиц: попадают в органы дыхания и пищеварения и могут вызвать аллергии, постепенно провоцировать развитие хронических заболеваний, нарушения обмена веществ и т.д.
- Термическая денатурация белка уравнение реакции
- 1. Амфотерные свойства белков
- 2. Денатурация белка (необратимое осаждение, свертывание)
- 3. Гидролиз белков
- 4. Цветные (качественные) реакции на белки
- 3.8.2. Белки
- Химические свойства белков
- Гидролиз
- Денатурация
- Качественные реакции на белки
- Биуретовая реакция
- Ксантопротеиновая реакция
- 💡 Видео
Видео:Опыты по химии. Денатурация белков: нагреванием; взаимодействие с кислотой, солями тяжелых металловСкачать

Термическая денатурация белка уравнение реакции
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
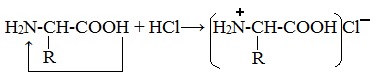
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg 2+ , Pb 2+ , Си 2+ ).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70 0 С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
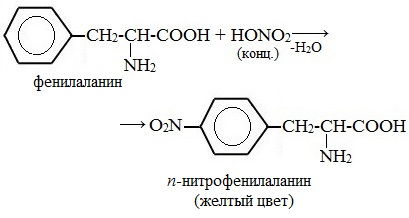
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
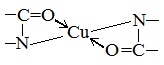
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом:
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Видео:Лабораторная работа №17. Денатурация белков. 9 класс.Скачать

3.8.2. Белки
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | ||
| третичная |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Видео:Денатурация и ренатурация белков. 10 класс.Скачать

Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α -аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
💡 Видео
Денатурация белка в спиртеСкачать

Качественные реакции на белкиСкачать

Денатурация БЕЛКА тяжелыми металлами. Реакция БЕЛКА с НИТРАТОМ СЕРЕБРА, НИТРАТОМ СВИНЦА.Скачать

Денатурация БЕЛКА. Реакция со СПИРТОМ и АЦЕТОНОМ. Реакции с белком. Опыты по химии дома.Скачать

БИУРЕТОВА реакция. Денатурация белка. Реакция БЕЛКА и ГИДРОКСИДА МЕДИ. Опыты по химииСкачать

Денатурация БЕЛКА солями тяжёлых металлов. Реакция белка с CoCI2, FeCI3, CrCI3, NiSO4, CuSO4. ОпытыСкачать

Опыты по химии. Цветные реакции белка: биуретовая; ксантопротеиноваяСкачать

Опыт к теме "Денатурация белка"Скачать

Биосинтез белка за 3 минуты (даже меньше)Скачать

Биохимия. Лекция 3. Свойства и функции белков. Денатурация белков.Скачать

Денатурация и осаждение белковСкачать

Свертывание белков при нагреванииСкачать

Видеоурок: Практическая работа № 4. Цветные реакции на белкиСкачать

10 класс Качественные реакции на белкиСкачать

Реакция белка на спирт Reaction of alcohol on the proteinСкачать

Денатурация белка Биология для школьниковСкачать

Свертывание белков при нагревании денатурацияСкачать