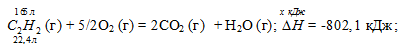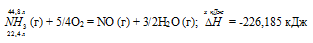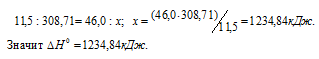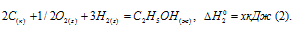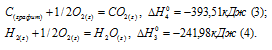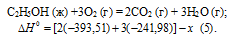Химия | 10 — 11 классы
Тепловой эффект горения метана 890, 31 кДж.
Составьте термохимическое уравнение горения метана.
Рассчитайте, какое количество теплоты выделится, если сжечь метана количеством вещества 0, 8 моль.
СH4 + 2O2 = CO2↑ + 2H2O
0, 8 моль – х кДж
х = 0, 8 моль ∙ 890, 31кДж 1 моль = 712, 25 кДж
Ответ : СH4 + 2O2 = CO2↑ + 2H2O + 712, 25 кДж.
- По термохимическому уравнению горение метанаCH4 + 2O2 = CO2 + H2O + 890кДжРассчитайте количества тепла, которое выделяется при горении 64 гр метана?
- При сгорании 0, 5 моль метана выделяется 440 кДж тепла?
- Термохимическое уравнение горения природного газа — метана записывается в виде : CH4 + 2O2 = CO2 + 2H2O + 880кДЖ а)количество теплоты, выделяющейся при сгорании 1 кг метана б)количество теплоты, выдел?
- Тепловой эффект реакции горения бутадиена равен 2310 кДж / моль?
- По термохимическому уравнению горения метана : СН4 + 2О2 = СО2 + 2Н2О + 890кДж рассчитайте количество тепла которое выделяется при горении 64г метана?
- По термохимическому уравнению горения метана : CH4 + 2O2 = CO2 + 2H2O + 804 кДж?
- Рассчитайте количество теплоты, выделяющейся при сгорании 11, 2 л метана (н?
- При сгорание 0?
- Термохимическое уравнение реакции горения метана : CH4 + 2O2 = CO2 + 2H2O + 878 кДж Сколько теплоты выделится если сжечь метан объемом 4?
- СРОЧНО?
- Составление термохимического уравнения реакции и вычисление теплот образования веществ
- Теплота образования веществ
- Теплота образования
- Тепловой эффект реакции
- Термохимическое уравнение реакции
- Задачи по термохимии
- Просмотр содержимого документа «Задачи по термохимии»
- 📽️ Видео
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

По термохимическому уравнению горение метанаCH4 + 2O2 = CO2 + H2O + 890кДжРассчитайте количества тепла, которое выделяется при горении 64 гр метана?
По термохимическому уравнению горение метана
CH4 + 2O2 = CO2 + H2O + 890кДж
Рассчитайте количества тепла, которое выделяется при горении 64 гр метана?
Видео:Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

При сгорании 0, 5 моль метана выделяется 440 кДж тепла?
При сгорании 0, 5 моль метана выделяется 440 кДж тепла.
Составьте термохимическое уравнение реакции горения метана.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Термохимическое уравнение горения природного газа — метана записывается в виде : CH4 + 2O2 = CO2 + 2H2O + 880кДЖ а)количество теплоты, выделяющейся при сгорании 1 кг метана б)количество теплоты, выдел?
Термохимическое уравнение горения природного газа — метана записывается в виде : CH4 + 2O2 = CO2 + 2H2O + 880кДЖ а)количество теплоты, выделяющейся при сгорании 1 кг метана б)количество теплоты, выделяющейся при сгорании 10 моль метана в)количество вещества оксида углерода(IV), образующееся при выделение 528 кДЖ теплоты г)массу воды, образовавщейся при выделении 6160 кДЖ энергии.
Видео:78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Тепловой эффект реакции горения бутадиена равен 2310 кДж / моль?
Тепловой эффект реакции горения бутадиена равен 2310 кДж / моль.
Составьте термохимическое уравнение реакции горения бутадиена и вычислите массу сгоревшего бутадиена, если при этом выделилось 924 кДж теплоты.
Видео:Химия ЦТ | Задачи по термохимическим уравнениямСкачать

По термохимическому уравнению горения метана : СН4 + 2О2 = СО2 + 2Н2О + 890кДж рассчитайте количество тепла которое выделяется при горении 64г метана?
По термохимическому уравнению горения метана : СН4 + 2О2 = СО2 + 2Н2О + 890кДж рассчитайте количество тепла которое выделяется при горении 64г метана.
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

По термохимическому уравнению горения метана : CH4 + 2O2 = CO2 + 2H2O + 804 кДж?
По термохимическому уравнению горения метана : CH4 + 2O2 = CO2 + 2H2O + 804 кДж.
Рассчитайте сколько теплоты выделится при сжигании 11, 2 дм3 СН4?
Видео:Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

Рассчитайте количество теплоты, выделяющейся при сгорании 11, 2 л метана (н?
Рассчитайте количество теплоты, выделяющейся при сгорании 11, 2 л метана (н.
У). Тепловой эффект реакции равен 880 кДж / моль.
Видео:Тепловой эффект реакции. ЗадачиСкачать

При сгорание 0?
5 моль метана выделяется 440 кдж тепла.
Составьте термохимическое уравнение реакции горения метана.
Видео:Тепловой эффект реакции/ Страницы 115 - 118/ № 1 - 50/Сборник тестов по химии 2021/Скачать

Термохимическое уравнение реакции горения метана : CH4 + 2O2 = CO2 + 2H2O + 878 кДж Сколько теплоты выделится если сжечь метан объемом 4?
Термохимическое уравнение реакции горения метана : CH4 + 2O2 = CO2 + 2H2O + 878 кДж Сколько теплоты выделится если сжечь метан объемом 4.
Какой объем метана нужно сжечь, чтобы получить 4390 кДж теплоты?
Видео:Электронные эффекты заместителейСкачать

СРОЧНО?
Имея термохимическое уравнение горения метана CH4(г) + 2O2(г) = CO2(г) + 2H2O(г) + 800Дж, определите : а) объем метана (н.
У. ), который надо сжечь для получения 10000 кДж теплоты, б) количество теплоты, выделяющееся при сгорании 100 г метана.
На этой странице сайта, в категории Химия размещен ответ на вопрос Тепловой эффект горения метана 890, 31 кДж?. По уровню сложности вопрос рассчитан на учащихся 10 — 11 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
Видео:Тепловой эффект химической реакции | ХимияСкачать

Составление термохимического уравнения реакции и вычисление теплот образования веществ
Видео:Химия | Задачи на термохимиюСкачать

Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 
б) С (к) + О2 (г) = СО2 (г); 
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод — до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) — 2 Н2 (г) + О2 (г) — С (к) + О2 (г) =
= 2Н2О (ж) + СО2 — 2Н2О — СО2;

СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то

Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 
Н2 (г) + 1/2О2 (г) = Н2О (ж); 
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 
Ответ: —986,50 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж); 
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):


Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:









Ответ: +49,03 кДж.
Видео:Опыты по химии. Модели молекул метана и других углеводородовСкачать

Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г)); 
+37,4 кДж = -201,17 — 

Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) — на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
Видео:Индуктивный и мезомерный эффектыСкачать
Задачи по термохимии
Просмотр содержимого документа
«Задачи по термохимии»
Расчеты по термохимическим уравнениям (экзотермические, эндотермические реакции, тепловой эффект)
1. Составьте термохимическое уравнение реакции горения магния, если известно, что при
сгорании магния массой 12 г выделилось количество теплоты 307,2 кДж.
(2 Mg(к) + O2(г) = 2 MgO(к) + 1228,8 кДж.)
2. Вычислите по термохимическому уравнению 4 P(к) + 5O2(г) =2 P2O5(к) + 3010 кДж
количество теплоты, выделяемой при сгорании 31 г фосфора. (752,5 кДж.)
3. По термохимическому уравнению CaCO3(к) = CaO(к) + СO2(г) — 157 кДж
Вычислите массу разложившегося известняка, если известно, что на его разложение
затрачено 1570 кДж (1000 г)
4. При сгорании кальция массой 8 г, выделилось количество теплоты 127 кДж.
Составьте термохимическое уравнение реакции.
вычислите количество теплоты, которая поглотится при получении кислорода (н.у.) объемом 6,72 л. (76,5 кДж)
вычислите массу гидроксида натрия, вступившего в реакцию, если известно, что при
его нейтрализации выделилось количество теплоты 725 кДж. (200 г.)
На разложение оксида ртути (II) массой 8,68 г затрачено количество теплоты 3,64кДж.
Составьте термохимическое уравнение реакции.
Задачи на тепловой эффект химической реакции 11 класс
1.При взаимодействии углерода массой 6г с водородом выделилось 37,42 кДж теплоты. Напишите термохимическое уравнение образования метана.
2. Тепловой эффект горения метана 890,31 кДж. Составьте термохимическое уравнение горения метана. 1) Рассчитайте, какое количество теплоты выделится, если сжечь метана: а) количеством вещества 0,8 моль; б) объёмом 250 мл ; в) массой 200 г.? 2) Сколько необходимо взять метана по объёму и по массе, чтобы при этом выделилось 148,385 кДж теплоты?
3.Рассчитайте по термохимическому уравнению
Какое количество теплоты выделится, если кислорода расходуется:
a) массой 16г; б) объёмом 67,2л; в) количеством вещества 2б5 моль.
Сколько оксида углерода(IV) по объёму и по массе получится, если при горении пропена выделится 277,5 кДж теплоты?
4.Составьте термохимическое уравнение реакций горения этилена, если известно, что тепловой эффект реакции 1410,97 кДж. 1)Сколько теплоты выделится, если сгорает этилена; а) количеством вещества 5 моль; б) массой 140 г в) объёмом 112л.?
2) Сколько кислорода (по объёму и по массе) необходимо сжечь, чтобы выделилось
📽️ Видео
Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

6. Индуктивный и мезомерный эффектыСкачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Идеальный газ в молекулярно-кинетической теории | Физика 10 класс #28 | ИнфоурокСкачать

Помогите выбрать приветствие и МЕЗОМЕРНЫЙ эффект ^-^Скачать