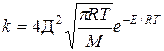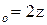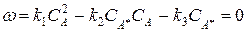В попытках устранить недостатки теории активных столкновений ученые предложили новую теорию химической кинетики. Это сделали практически одновременно в 1935 году, более чем через полвека после открытий Аррениуса, Г.Эйринг (США) с одной стороны, а также М.Поляни и М.Г.Эванс (Великобритания) — с другой. Они предположили, что химическая реакция между началом и завершением претерпевает некое «переходное состояние», как его назвали Эванс и Поляни, при котором образуется неустойчивый «активированный комплекс» (термин Эйринга). Энергия активации как раз и требуется для достижения этого состояния, при котором вероятность успешного завершения реакции весьма велика. Поэтому энергия активации и может быть меньшей, чем энергия разрыва исходных химических связей.
 |  | |
Суть теории переходного состояния (активированного комплекса):
1) частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии;
2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации;
3) переходное состояние находится в равновесии с реагентами;
4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени.
Время существования активированного комплекса равно периоду колебания одной молекулы ( 10 -13 с), поэтому он не может быть обнаружен экспериментально и, соответственно, его нельзя выделить и изучить. Следовательно, доказать истинность теории переходного состояния можно только с помощью расчетов. И для этой цели ученые задействовали самую передовую на тот момент методику, которая тогда переживала бурный расцвет — квантовую химию. Выделилось даже целое направление в квантовой химии по расчетам энергии переходного состояния.
Видео:5.1. Адсорбция. Классификация адсорбцииСкачать

АКТИВИ́РОВАННОГО КО́МПЛЕКСА ТЕО́РИЯ
В книжной версии
Том 1. Москва, 2005, стр. 364
Скопировать библиографическую ссылку:
АКТИВИ́РОВАННОГО КО́МПЛЕКСА ТЕО́РИЯ (теория абсолютных скоростей реакций, теория переходного состояния), метод статистич. расчёта скорости химич. реакции. Исходит из представления, согласно которому при непрерывном изменении относит. расположения атомов, входящих в реагирующую систему молекул, система проходит через конфигурацию, отвечающую максимуму потенциальной энергии взаимодействия, т. е. вершине потенциального барьера, разделяющего реагенты и продукты. А. к. т. была создана в 1930-х гг. Э. Вигнером, М. Поляни, М. Эвансом, Г. Эйрингом.
Видео:Коробов М. В. - Физическая химия II - Вывод основного уравнения ТАК. Трансмиссионный коэффициентСкачать

ТЕОРИЯ АКТИВИРОВАННОГО КОМПЛЕКСА (ТАК) ИЛИ ТЕОРИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ (ТПС).
Теории химической кинетики.
Теория активных столкновений (ТАС).
Основные предпосылки:
1. Молекулы представляют в виде шариков.
2. Для того, чтобы произошло взаимодействие, необходимо столкновение.
3. Процесс протекает только в том случае, если энергия столкновения больше или равна определенному значению энергии, которая называется энергией активации.
В основу этой теории положено два учения: молекулярно-кинетическая теория и теория Больцмана.
Вывод уравнения ТАС.
z – общее число столкновений в единицу времени.
z=
Д – эффективный диаметр молекул;
n – число молекул в единице объема;
M – молекулярная масса.
С помощью закона Больцмана определяем количество активных столкновений z 
z
Тогда доля активных столкновений составит:
Рассмотрим бимолекулярную газовую реакцию типа: 2А 
2HJ
Теперь заметим, что в результате каждого активного столкновения расходуется две молекулы исходного вещества. Поэтому количество прореагировавших молекул в единице объема будет равна удвоенному количеству активных столкновений в то же время и в том же объеме:



Отсюда видно, что скорость реакции зависит от квадрата концентрации.

k=k 
Сравнение этих уравнений позволяет установить физический смысл предэкспоненциального множителя k 
В общем виде уравнение Аррениуса для всех типов реакций часто пишут в виде:
k=z 
Константа, рассчитанная по этому уравнению, не дает совпадения с экспериментальными данными. Для корректировки в это уравнение вводят стерический фактор р.
Тогда уравнение Аррениуса с точки зрения ТАС запишется следующим образом:
k = pz
Считается, что стерический фактор отличается от единицы потому, что для осуществления реакции необходима определенная ориентация реагирующих молекул.
В этом уравнении Е – энергия активации, рассчитанная по ТАС, абсолютная (истинная) энергия активации, а экспериментальная – эффективная энергия активации.
Е
Факты, которые не объясняет ТАС:
1. Не дает метода теоретического расчета энергии активации.
2. Не объясняет протекания в растворах.
3. Не объясняет природы стерического фактора.
МОНОМолекулярные реакции с точки зрения ТАС.
Теория Линдемана.
В элементарном акте мономолекулярной реакции участвует всего одна молекула. В соответствии с теорией активных столкновений реакция начинается со встречи двух активных молекул. Количество столкновений пропорционально квадрату концентраций. Поэтому, казалось бы, что мономолекулярные реакции, как и бимолекулярные, должны иметь порядок, равный двум. Но многие мономолекулярные реакции описываются уравнением первого порядка, причем порядок реакции может изменяться при изменении концентрации (давления) и быть дробным.
Объяснение механизмов газовых мономолекулярных реакций дано Линдеманом. Он предположил, что после столкновения активные молекулы могут не только распадаться на продукты реакции, но и дезактивироваться. Механизм реакции представляется двухстадийным:
1) A+A
2)
A 
На первом этапе происходит перераспределение энергии, в результате чего одна молекула становится активной, а другая дезактивируется.
На второй стадии оставшиеся активные молекулы мономолекулярно превращаются в продукты реакции.
Рассмотрим стационарный процесс:
Выразим концентрацию активной частицы А * : 

Анализ уравнения Линдемана:
1. СА – очень маленькая. В этом случае промежутки между столкновениями молекул настолько велики, что дезактивация происходит редко. Распад активных молекул на продукты происходит без затруднений; лимитирующей стадией является стадия активации. В связи с этим в уравнении Линдемана пренебрегаем в знаменателе 


3. СА – средняя. В этом случае мономолекулярные реакции могут иметь дробный порядок (1 > Е активации, то реакция протекает с образованием активированного комплекса без предварительного разрыва связей.
🌟 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Лекция 13: теория переходного состояния (04.12.2019)Скачать

Урок 132. Основные понятия гидродинамики. Уравнение непрерывностиСкачать

Кинетика. О чем говорят графики. БиохимияСкачать

Химия для дома. Передача 8. Практическое использование уравнения АррениусаСкачать

ПРОСТЫМ ЯЗЫКОМ: Что такое трансформатор?Скачать

ЛЕКЦИЯ №17 || Химическая кинетика || Термодинамические функции активации, теорема ТолменаСкачать

Теория поля (cut), Андрианов Е. С. Лекция 10, 19.04.2023Скачать

Когда тренер - твой друг😏Скачать

Теорія подібностіСкачать

Курочкин И. Н. - Инженерная энзимология и аналитическая биотехнология - БиосенсорыСкачать

Когда Контрнаступление Украины? (10 июня 2023)Скачать

Повторение методом активного воспроизведенияСкачать

Румянцева М.Н.- Общая и неорганическая химия. Лекции - 6. Строение атома. Химические связиСкачать

Лекция 3Скачать

Закон Гесса. 10 класс.Скачать