А и b – эмпирические константы.
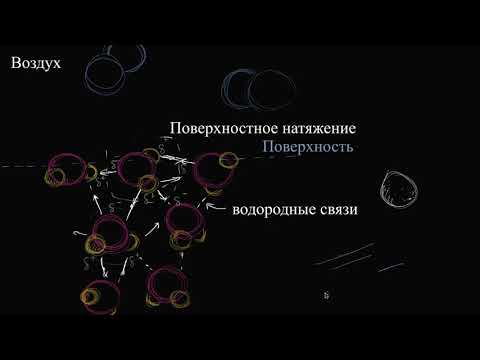
(На границе конденсированной (т.е. твердой или жидкой) фазы с газом поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг с другом сильнее, чем с молекулами газа. Согласно принципу минимума свободной энергии, конденсированная фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию. Это может быть результатом либо уменьшения площади поверхности фазы (именно поэтому капля жидкости в невесомости принимает форму сферы), либо уменьшения поверхностного натяжения при появлении на поверхности раздела фаз новых частиц – молекул газа либо растворенного вещества. Процесс самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз называется адсорбцией. Адсорбентом называется вещество, на поверхности которого происходит изменение концентрации другого вещества – адсорбата).
Основы термодинамики адсорбции были созданы Дж.Гиббсом в 70-е гг. XIX в. По Гиббсу, в равновесной двухфазной системе вблизи поверхности раздела фаз происходит некоторое изменение локальных значений всех экстенсивных свойств (кроме объема). Однако фазы считаются однородными вплоть до некоторой геометрической поверхности, разделяющей их. Поэтому значение какого-либо экстенсивного свойства для системы в целом 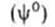



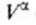

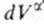

Изложенные представления позволяют привести фундаментальное термодинамическое уравнение к виду:
где G-гиббсова свободная энергия, S-энтропия, 


Величина 
Положение разделяющей поверхности может быть выбрано произвольно. В частности, выбор этого положения может удовлетворять условию Г1=0. Такая поверхность называется эквимолекулярной. Для нее вводится обозначение Г2 = Г2 (1) . Отсюда следует основное адсорбционное уравнение Гиббса:
Если адсорбтив совершенно не растворим в одной из двух фаз, 
Связь уравнений Гиббса, Ленгмюра и Шишковского.
Зависимость поверхностного натяжения от концентрации (изотерма поверхностного натяжения) в широком интервале концентраций описывается уравнением Шишковского:
σ = σ0 − b ln(1+ Ac) , (2.2)
где b и A – константы, характеризующие ПАВ, причем b является константой для всего гомологического ряда, а A — константа, характерная для данного вещества и возрастающая примерно в три раза при удлинении углеводородного радикала молекулы ПАВ на одну СН2 группу. Снижение поверхностного натяжения обусловлено адсорбцией ПАВ на поверхности раздела раствор/воздух. Адсорбцией называется процесс самопроизвольного концентрирования растворённого вещества в поверхностном слое. Универсальным термодинамическим соотношением, описывающим адсорбцию, является уравнение Гиббса:

Совместное решение уравнений (2.2) и (2.3) приводит к уравнению:

которое при условии 

Видео:Адсорбция на поверхностях растворовСкачать

Лекция №3
План лекции:
1.Поверхностное натяжение — физический смысл.
Видео:5.1. Адсорбция. Классификация адсорбцииСкачать

АДСОРБЦИЯ
Поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается в уменьшении межфазной поверхности или поверхностного натяжения ( s )
Вследствие этого стремления происходит адсорбция.
Адсорбция — процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. Т.е. адсорбция может происходить в многокомпонентных системах, в слой переходит тот компонент, который сильнее уменьшает s .
Адсорбент — фаза определяющая форму поверхности, более плотная, может быть твердой или жидкой.
Адсорбат — вещество которое перераспределяется (газ или жидкость).
Десорбция — переход вещества из поверхностного слоя в объемную фазу.
Количественно адсорбцию описывают величиной Гиббсовской адсорбции (избыток вещества в поверхностном слое по сравнению с его количеством в объемной фазе, отнесенный к единице площади поверхности или единице массы адсорбента)

Г i -Гиббсовская адсорбция,
V -объем системы,
с0 -исходная концентрация адсорбата ,
с i — концентрация адсорбата в объеме,
S — площадь поверхности раздела.
Все величины в (3.1) могут быть установлены экспериментально.
Адсорбцию можно рассматривать как процесс превращения поверхностной энергии в химическую.
Выведем соотношение между поверхностным натяжением и химическими параметрами компонентов.
Если объем поверхностного слоя равен 0, то
т.к. внутр. энергия пропорциональна экстенсивным величинам, то:
полный дифференциал от тех же переменных запишется следующим образом:
dU=T dS + S dT + s dS +S d s + å m i dn i + å n i d m (3.3)
Подставляя dU из 3.2 в 3.3, получим:
3.4 и 3.5 — уравнения Гиббса для межфазной поверхности (поверхностного слоя).
Все экстенсивные величины поверхности зависят от площади поверхности , поэтому удобнее относить эти параметры к единице площади поверхности. Разделив уравнение 3.5 на площадь поверхности, получим:


Г i — поверхностный избыток компонента i в поверхностном слое (по сравнению с его равновесной концентрацией в объемной фазе), то есть величина Гиббсовской адсорбции.
Уравнение 3.6 — фундаментальное адсорбционное уравнение Гиббса. Это строгое термодинамическое соотношение, написанное для многокомпонентной системы. Однако, практиче ское его использование неудобно. Оно, например, не раскрывает зависимость поверхностного натяжения от адсорбции конкретного вещества при постоянных химических потенциалах других веществ.. Единицы величины гиббсовской адсорбции определяются единицами химического потенциала. Если потенциал отнесен к молю вещества, то величина адсорбции выражается в молях на единицу площади.
Адсорбция конкретного вещества при постоянных химических параметрах других веществ:
Принимая во внимание , что m i = m i o + RT ln ai, m i и m i o — равновесное и стандартное значения химического потенциала адсорбата i , а i — термодинамическая активность адсорбата, d m i = RT d ln ai ,получим :
для Гиббсовской адсорбции:

3.7. применяют только тогда, когда можно использовать концентрации вместо активностей и пренебречь изменениями концентраций других веществ при изменении концентрации одного вещества. Этим условиям удовлетворяет разбавленный раствор относительно данного компонента. В таком растворе при изменении концентрации растворенного вещества практически не изменяется концентрация растворителя. Поэтому для растворенного вещества уравнение 3.7 переходит в широко используемые адсорбционные уравнения Гиббса для неэлектролитов и электролитов


Видео:Свободная энергия Гиббса. 10 класс.Скачать

УРАВНЕНИЕ ГЕНРИ, ФРЕЙНДЛИХА, ЛЕНГМЮРА
Для описания процесса адсорбции, помимо фундаментального уравнения адсорбции Гиббса, применяют ряд других аналитических уравнений, которые называются по имени их авторов.
При незначительном заполнении адсорбента адсорбатом отношение концентрации вещества в адсорбционном слое и в объеме стремится к постоянному значению, равному кГ:
Это уравнение характеризует изотерму адсорбции при малых концентрациях адсорбата (рис.3.1, участок 1) и является аналитическим выражением закона Генри. Коэффициент кГ не зависит от концентрации и представляет собой константу распределения, характеризующую распределение вещества в адсорбционном слое по отношению к его содержанию в объемной фазе. Уравнение Генри соблюдается приближенно, но это приближение достаточно для практики.
В более общем виде зависимость адсорбции от концентрации адсорбата можно определить с помощью уравнения Фрейндлиха.
Видео:Урок 197. Поверхностная энергия. Коэффициент поверхностного натяженияСкачать

Тах линейной формы уравнения Ленгмюра
2.4.7. Обобщение уравнений Гиббса и Ленгмюра.Уравнение адсорбции
Ленгмюра (2.35), полученное на основе молекулярно-кинетических пред-
ставлений, в сочетании с термодинамическим уравнением Гиббса (2.30) для
разбавленных растворов позволяет теоретически описать зависимость по-
верхностного натяжения растворов от концентрации ПАВ. Приравняем пра-
вые части этих уравнений:
Полученное уравнение (2.38) совпадает по форме с эмпирическим уравнени-
ем Шишковского (2.20). Из сопоставления этих уравнений следует физиче-
ский смысл эмпирических коэффициентов а и b уравнения Шишковского:
Таким образом, коэффициент а определяется величиной предельной ад-
сорбции. В гомологических рядах ПАВ величина Г∞, как будет показано ни-
же, не зависит от длины углеводородного радикала молекулы ПАВ, поэтому
коэффициент а остается постоянным в пределах данного гомологического
ряда. Коэффициент b = K, т.е. он характеризует поверхностную активность,
зависит от работы адсорбции и потому изменяется в гомологическом ряду в
соответствии с правилом Дюкло-Траубе: (bn+1/bn) ≈ 3,2.
2.4.8. Строение адсорбционных слоев ПАВ.При возрастании концентрации
ПАВ в растворе возрастает величина адсорбции и увеличивается степень за-
полнения поверхностного слоя молекулами ПАВ (а д с о р б ц и о н н а я н а
с ы щ е н н о с т ь поверхности). При этом изменяется строение адсорбцион-
ного слоя, характер расположения в нем молекул. Рассмотрим два крайних
1) Сильно разбавленные растворы (с → 0). В соответствии с правилом
Дюкло-Траубе, все группы -СН2- равноценны по своему влиянию на поверх-
ностную активность: она изменяется в одно и то же число β раз для каждого
(n+1)-го гомолога независимо от n, т.е. независимо от положения метилено-
вой группы в алкильной цепи. Это означает также, что работа адсорбции,
приходящаяся на каждую метиленовую группу (ΔWa), одинакова. Следова-
тельно, все группы -СН2- занимают одинаковое положение относительно по-
верхности, что возможно лишь когда цепи расположены параллельно по-
верхности , т.е. плашмя «лежат»на ней (рис. 5а). Лишь в этом случае энер-
гия взаимодействия каждой метиленовой группы с водой одинакова. При
этом молекулы, совершая тепловое движение, производят давление на огра-
ждающие сосуд стенки, подобно газу, находящемуся в замкнутом объеме.
Нетрудно показать (это будет сделано ниже), что это п о в е р х н о с т н о е
д а в л е н и е (π) равно разности поверхностных натяжений раствора и чисто-
го растворителя: π = σ0 – σ = Δσ.
2) При больших концентрациях (с →∞), когда адсорбция достигает
предельного значения Г∞, адсорбционный слой приобретает структуру
сплошного насыщенного мономолекулярного слоя с максимально плотной
упаковкой молекул, ориентированных перпендикулярно поверхности рас-
твора (это так называемый «частокол Ленгмюра», рис. 5 б). Подобные
представления базируются на расчетах м о л е к у л я р н ы х х а р а к т е-
р и с т и к ПАВ в адсорбционном слое. Эти характеристики: 1) площадь, за-
нимаемая одной молекулой в н а с ы щ е н н о м адсорбционном слое sm
(молекулярная площадка) и 2) толщина адсорбционного слоя h. Так как Г∞ —
это число молей адсорбата на 1 м2 поверхности, то
где NA – число Авогадро. Далее, масса адсорбата, заключенного в объеме ад-
сорбционного слоя с площадью, равной единице, и толщиной h, равна Г∞М
(М – молярная масса ПАВ); с другой стороны, она равна ρh, где ρ – плотность
ПАВ. Тогда Г∞М = ρh, откуда
Расчеты sm и h для гомологических рядов ПАВ показывают, что: (1) величи-
на молекулярной площадки sm остается постоянной независимо от длины уг-
леводородного радикала; (2) толщина адсорбционного слоя h возрастает на
одну и ту же величину ( равную ≈ 0,14 нм) при переходе от n-го к (n + 1)-му
члену ряда. То и другое возможно лишь в случае, если насыщенный адсорб-
ционный слой имеет структуру, показанную на рис. 5 б. Следует отметить,
что величины sm и h хорошо согласуются с данными рентгеноструктурного
анализа ПАВ в кристаллическом состоянии: sm соответствует площади попе-
речного сечения, а h – длине молекулы ПАВ.
Приведенные выше расчеты впервые были выполнены Ленгмюром при
изучении свойств и молекулярных параметров монослоев на поверхности во-
ды и водных растворов электролитов.

🌟 Видео
5.3. Адсорбция на границе жидкость-газ. Поверхностно активные вещества ПАВСкачать

Решение задач на вычисление энергии Гиббса. 1 часть. 10 класс.Скачать

Поверхностно-активные веществаСкачать

Эту задачу ГРИГОРИЙ ПЕРЕЛЬМАН решил в 10-м классеСкачать

Решение задач на вычисление энергии Гиббса. 2 часть. 10 класс.Скачать
Практическое занятие 6. Адсорбция на границе раствор – газСкачать

Химический потенциалСкачать

Коробов М. В. - Физическая химия. Часть 1 - Энергия Гиббса образования раствора. Уравнение ШредераСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Энтропия и второй закон термодинамики (видео 6) | Энергия| БиологияСкачать

Гамма-функция и бета-функция: вывод основных соотношенийСкачать

СорбцияСкачать

Поверхностное натяжениеСкачать

Поверхностное натяжение (видео 3) | Силы межмолекулярного взаимодействия | ХимияСкачать
Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Уравнение состояния идеального газа. 10 класс.Скачать











