Оксид лития — это белое, гигроскопичное, тугоплавкое вещество, при нагревании не разлагается.
Относительная молекулярная масса = 29,88; относительная плотность для тв. и ж. состояния = 2, 013; tпл = 1453º C; tкип ≈ 2600º C.
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Способ получения
1. Оксид лития можно получить путем взаимодействия лития и кислорода :
2. Оксид лития получается при разложении гидроксида лития:
2LiOН → Li2O + Н2O
3. Путем термического разложения карбоната лития с образованием оксида лития и оксида углерода:
4. При термическом разложении нитрата лития образуется оксид лития, оксид азота и кислород:
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические свойства
1. Литий вытесняется из оксида в результате взаимодействия с другими металлами :
1.1. Оксид лития взаимодействует с металлами и некоторыми неметаллами с образованием лития и оксида металла:
Li2O + Si = 4Li + SiO2
Li2O + Mg = 2Li + MgO
3Li2O + 2Al = 6Li + Al2O3
2. Оксид лития взаимодействует со сложными веществами:
2.1. Оксид лития реагирует с водой . Образуется гидроксид лития:
Li2O + H2O = 2LiOH
2.2. Оксид л ития взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид лития с соляной кислотой образует хлорид лития и воду:
2.3. При взаимодействии лития с оксидами образуются соли:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Формула оксида лития, свойства, риски и использование
оксид лития неорганическое химическое соединение формулы Li2Или это образуется вместе с небольшими количествами пероксида лития, когда металлический литий сжигается в воздухе и соединяется с кислородом.
До 1990-х годов на рынке металлов и лития доминировало производство в США из месторождений полезных ископаемых, но в начале 21-го века большая часть производства была получена из неамериканских источников; Австралия, Чили и Португалия были самыми важными поставщиками в мире. У Боливии есть половина месторождений лития в мире, но это не большой производитель.
Наиболее важной коммерческой формой является карбонат лития, Li2Колорадо3, производится из минералов или рассолов несколькими различными процессами.
Когда литий сжигается в воздухе, основным продуктом является белый оксид лития, Li2О. Кроме того, некоторое количество перекиси лития производится, Li2О2, также белый.
Это также можно сделать путем термического разложения гидроксида лития, LiOH или пероксида лития, Li2O2.
2LiOH (s) + тепло → Li2O (s) + H2O (г)
Видео:8 класс. Составление уравнений химических реакций.Скачать

Физико-химические свойства
Оксид лития представляет собой белое твердое вещество, известное как лития, которому не хватает аромата и соленого вкуса. Его внешний вид показан на рисунке 2 (Национальный центр биотехнологической информации, 2017).
Рисунок 2: внешний вид оксида лития
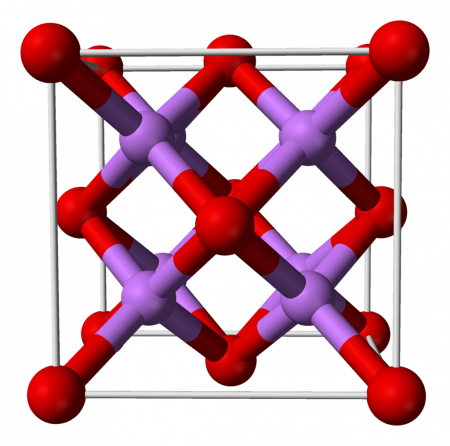
Оксид лития — это кристаллы с геометрией антифлорита, подобной геометрии хлорида натрия (кубический с центром на гранях) Его кристаллическая структура представлена на рисунке 3 (Марк Уинтер [Университет Шеффилда и WebElements Ltd, 2016].
Рисунок 3: кристаллическая структура оксида лития.
Его молекулярная масса составляет 29,88 г / моль, его плотность составляет 2,013 г / мл, а температуры плавления и кипения составляют 1438 ° С и 2066 ° С соответственно. Это соединение очень хорошо растворяется в воде, спирте, эфире, пиридине и нитробензоле (Royal Society of Chemistry, 2015).
Оксид лития легко реагирует с водяным паром с образованием гидроксида и с диоксидом углерода с образованием карбоната; следовательно, он должен храниться и обрабатываться в чистой и сухой атмосфере.
Оксидные соединения не приводят к электричеству. Однако некоторые структурированные оксиды перовскита являются электронными проводниками, которые находят применение в катоде твердооксидных топливных элементов и системах генерации кислорода..
Они представляют собой соединения, которые содержат по меньшей мере один кислородный анион и один металлический катион (American Elements, S.F.).
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реактивность и опасности
Оксид лития является стабильным соединением, несовместимым с сильными кислотами, водой и углекислым газом. Насколько нам известно, химические, физические и токсикологические свойства оксида лития не были исследованы и подробно представлены.
Токсичность соединений лития зависит от их растворимости в воде. Ион лития обладает токсичностью для центральной нервной системы. Соединение обладает сильным коррозионным раздражающим действием при попадании в глаза или на кожу при вдыхании или проглатывании (ESPI METALS, 1993).
В случае попадания в глаза вам следует проверить, носите ли вы контактные линзы, и немедленно снять их. Глаза следует промыть проточной водой не менее 15 минут, держа веки открытыми. Вы можете использовать холодную воду. Мазь не следует использовать для глаз.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело. Поместите жертву под безопасный душ.
Если химическое вещество накапливается на незащищенной коже жертвы, например на руках, аккуратно и осторожно промойте кожу, загрязненную проточной водой и неабразивным мылом. Вы можете использовать холодную воду. Если раздражение не проходит, обратитесь к врачу. Выстирать загрязненную одежду перед повторным использованием.
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении. Если вдыхание серьезное, пострадавшего следует как можно скорее эвакуировать в безопасное место..
Ослабьте тесную одежду, такую как воротник рубашки, ремни или галстук. Если пострадавшему трудно дышать, следует назначить кислород. Если пострадавший не дышит, проводится реанимация из уст в уста.
Всегда принимая во внимание, что человеку, оказывающему помощь в проведении реанимации изо рта в рот, может быть опасно, когда вдыхаемый материал токсичен, инфекционен или вызывает коррозию.
Во всех случаях вам следует немедленно обратиться к врачу (SIGMA-ALDRICH, 2010).
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

приложений
Оксид лития используется в качестве флюса в керамической глазури и создает синий с медью и розы с кобальтом. Оксид лития реагирует с водой и паром, образуя гидроксид лития и должен быть изолирован от них.
Оксид лития (Li2O) с его высоким потенциалом трития является привлекательным кандидатом на твердый культуральный материал термоядерной электростанции DT из-за его высокой плотности атомов лития (по сравнению с другими литиевыми или металлическими литиевыми керамиками) и его проводимости относительно высокая термическая (ОКСИД ЛИТИЯ (Li2O), SF).
Li2Или он будет подвергаться воздействию высоких температур под действием нейтронного излучения во время работы термоядерных покрытий. В этих условиях большое количество дефектов облучения будет происходить в Li2Или, например, вызванное гелием набухание, относительно высокое тепловое расширение, рост зерна, образование и осаждение LiOH (T) при низких температурах и перенос массы LiOH (T) при высоких температурах.
Кроме того, Ли2Или это будет предметом напряжений, возникающих из-за различий в тепловом расширении между Li2О и конструкционные материалы. Эти характеристики Ли2Или они приводят к сложным инженерным проблемам как при изготовлении, так и при проектировании одеял..
Возможное новое применение — замена кобальта и оксида лития в качестве катода в литий-ионных батареях, используемых для питания электронных устройств от мобильных телефонов до ноутбуков, а также автомобилей с батарейным питанием (Reade International Corp, 2016).
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Оксид лития
| Оксид лития | |
|---|---|
 | |
| Систематическое наименование | Оксид лития |
| Традиционные названия | Окись лития |
| Хим. формула | Li2O |
| Рац. формула | Li2O |
| Состояние | твёрдое |
| Молярная масса | 29,8774 г/моль |
| Плотность | 2,013 г/см³ |
| Температура | |
| • плавления | 1570 [1] |
| • кипения | 2600 [1] °C |
| Растворимость | |
| • в воде | 6,67 (0 °C) |
| Рег. номер CAS | 12057-24-8 |
| PubChem | 166630 |
| Рег. номер EINECS | 235-019-5 |
| SMILES | |
| RTECS | OJ6360000 |
| ChemSpider | 145811 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид лития (окись лития) — бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Содержание
- 1 Описание
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 См. также
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Описание
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития). [2]
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение
- Взаимодействие металлического лития с кислородом:
4 Li + O2 ⟶ 2 Li2O
- Разложение пероксида лития при температуре 195 °C:
2 Li2O2 → 195∘C 2 Li2O + O2↑
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства
- Взаимодействует с водой, образуя щёлочь:
Li2O + H2O → 2 LiOH
- с кислотами:
Li2O + 2 HCl → 2 LiCl + H2O
- литий из оксида вытесняется некоторыми металлами и неметаллами:
Li2O + Mg → 800∘C 2 Li + MgO 2 Li2O + Si → 1000∘C 4 Li + SiO2
- с кислотообразующими оксидами образует соли:
Li2O + CO2 → 500∘C Li2CO3
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

Применение
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
🔥 Видео
ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Кислотный оксид + вода = ??? Основной оксид + вода = ???Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Реакции горенияСкачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать





