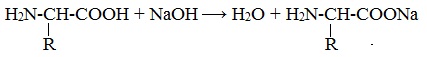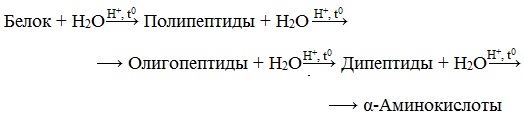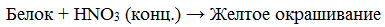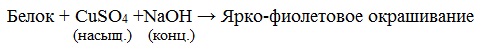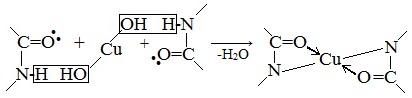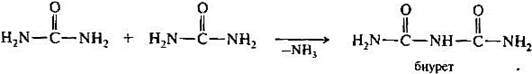Ход урока.
I. Организационный момент
II. Мотивация и целеполагание
Тема нашего урока: «Денатурация белков. Изменение углеводов»
Закрепление ранее изученных знаний.
Задание № 1. Вопросы по теме: «Кулинарная тепловая обработка».
1. Перечислите основные способы тепловой обработки?
2. Назовите температуру варки основным способом?
3. Назовите комбинированные способы тепловой обработки?
4. Назовите вспомогательные способы тепловой обработки?
5. Назовите температуру пассерования?
Задание № 2. Заполните таблицу: Укажите способы тепловой обработки.
Таблицу чертить не надо, ответы напишите под цифрами 1,2,3,4,5).
| № | Укажите способ тепловой обработки | Процесс |
| обжарка крупно нарезанных овощей без жира (для приготовления бульонов). | ||
| поддержание заданной температуры блюд на раздаче или при доставке к месту потребления. | ||
| припускания предварительно обжаренных продуктов с добавлением пряностей, приправ, бульона или соуса | ||
| припускания продукта в жарочном шкафу с бульоном и затем обжаривание (глазирование). | ||
| обработка продуктов на противнях или сковородах, в жарочном шкафу при температуре 150…270 С. |
III. Изучение нового материала (лекция). Изучение новой темы «Организация Денатурация белков. Изменение углеводов». (Прочитать лекцию, составить конспект, провести первый опыт, приложить к фото отчет).
Прочитать лекцию, составить конспект, ответив на контрольные вопросы.
Вопросы для контроля знаний
1. Что такое денатурация белков?
2. Что такое набухание?
3. Как называется реакция, которая указывает на наличие в белках остатков ароматических аминокислот?
4. При нагревании какой температуры, крахмальные зерна поглощают большое количество воды?
5. Что необходимо использовать для свёртывание белка при нагревании?
V. Подведение итогов. Выставление и комментирование оценок. Что сделали на уроке? Что нового вы получили на уроке?
VI. Домашнее задание. Повторить лекционный материал по опорному конспекту. учебник: Организация работы овощного цеха.
VII. Рефлексия. Мое отношение к уроку. Понравился ли урок? Была ли информация полезна? Какой метод изучения вам понравился?
Тема: Денатурация белков. Изменение углеводов.
Процессы происходящие в белках
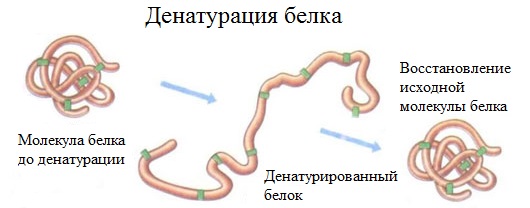
Денатурация белков. Это сложный процесс, при котором под влиянием внешних факторов (температуры, механического воздействия, действия кислот, щелочей, ультразвука и др.) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы. Первичная структура, а следовательно, и химический состав белка не меняются.
Денатурация сопровождается изменениями важнейших свойств белка:
— потерей индивидуальных свойств (например, изменение окраски мяса при его нагревании вследствие денатурации миоглобина);
— потерей биологической активности (например, в картофеле, грибах, яблоках и ряде других растительных продуктов содержатся ферменты, вызывающие их потемнение, при денатурации белки-ферменты теряют активность);
— повышением атакуемости пищеварительными ферментами (как правило, подвергнутые тепловой обработке продукты, содержащие белки, перевариваются полнее и легче);
— потерей способности к гидратации (растворению, набуханию);
— потерей устойчивости белковых глобул, которая сопровождается их агрегированием (свертыванием, или коагуляцией, белка).
Процессы происходящие в углеводах
Набухание и клейстеризация крахмала. Набухание — одно из важнейших свойств крахмала, которое влияет на консистенцию, форму, объем и выход готовых изделий.
При нагревании крахмала с водой (крахмальной суспензии) до температуры 50-55°С крахмальные зерна медленно поглощают воду (до 50% своей массы) и ограниченно набухают. При этом повышения вязкости суспензии не наблюдается. Набухание это обратимо: после охлаждения и сушки крахмал практически не изменяется. При нагревании от 55 до 80°С крахмальные зерна поглощают большое количество воды, увеличиваются в объеме в несколько раз, теряют кристаллическое строение, а следовательно, анизотропность.
Опыт 1. Свёртывание белка при нагревании.
Свёртывание белков, т.е. денатурация —процесс утраты белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической функции. При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических реагентов и ряда других факторов) происходит разрушение вторичной, третичной и четвертичной структур белковой макромолекулы. Первичная структура, а, следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит укрупнение.
Для работы служит белок куриного яйца, растворённый в воде (белок одного яйца на 150 мл воды).
Описание опыта. Небольшое количество раствора белка нагреть на горелке до кипения. Наблюдается помутнение жидкости. Полученный осадок не растворяется ни при охлаждении, ни при разбавлении водой, т.е. реакция является необратимой.
- Свертывание белков нагреванием уравнение реакции
- 1. Амфотерные свойства белков
- 2. Денатурация белка (необратимое осаждение, свертывание)
- 3. Гидролиз белков
- 4. Цветные (качественные) реакции на белки
- Важнейшие химические и физические свойства белков
- Определение, состав и строение белка
- Классификация белков
- Физико-химические свойства белка
- Амфотерность
- Растворимость
- Денатурация
- Химические свойства белков, качественные реакции, уравнения реакций
- Биологическое значение белка
- ТОП-10 малоизвестных фактов о белке
- Заключение
- 📺 Видео
Видео:Свертывание белков нагреваниемСкачать

Свертывание белков нагреванием уравнение реакции
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
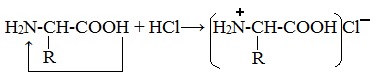
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg 2+ , Pb 2+ , Си 2+ ).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70 0 С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
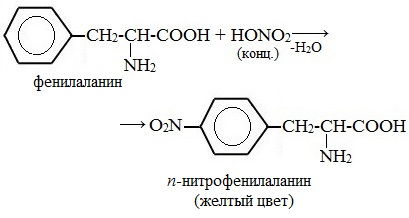
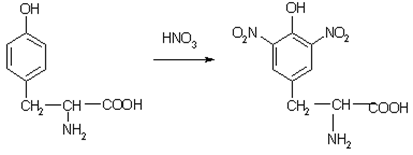
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом:
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Видео:Свертывание белков при нагреванииСкачать

Важнейшие химические и физические свойства белков
Физико-химические свойства белков обусловлены составом и количеством входящих в их молекулы остатков аминокислот. Химические свойства белковых молекул разнообразны, включают в себя амфотерность, растворимость, а также способность к денатурации – подробнее в статье.
Видео:Свертывание белков при нагреванииСкачать

Определение, состав и строение белка
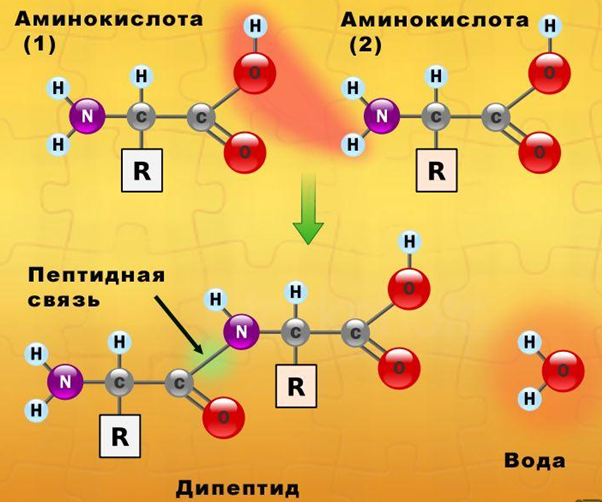
Белки являются биополимерами, мономерами которых являются остатки альфа-аминокислот, соединенные между собой посредством пептидных связей. Аминокислотная последовательность каждого белка строго определена, в живых организмах она зашифрована посредством генетического кода, на основе считывания которого и происходит биосинтез белковых молекул. В построении белков участвует 20 аминокислот.
Рис. 1. Схема образования молекулы белка (дипептида).
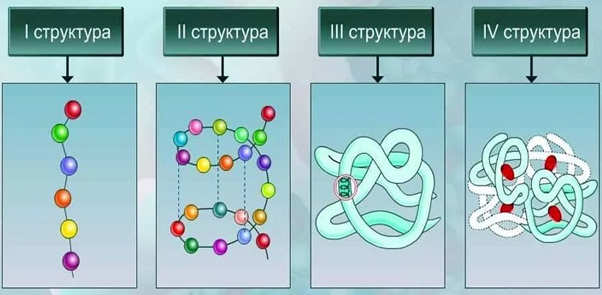
Различают следующие виды структуры белковых молекул:
- Первичная. Представляет собой аминокислотную последовательность в линейной цепи.
- Вторичная. Это более компактная укладка полипептидных цепей при помощи формирования водородных связей между пептидными группами. Есть два варианта вторичной структуры – альфа-спираль и бета-складчатость.
- Третичная. Представляет собой укладку полипептидной цепочки в глобулу. При этом формируются водородные, дисульфидные связи, также стабилизация молекулы реализуется благодаря гидрофобным и ионным взаимодействиям аминокислотных остатков.
- Четвертичная. Белок состоит из нескольких полипептидных цепей, которые взаимодействуют между собой посредством нековалентных связей.
Таким образом, соединенные в определенной последовательности аминокислоты образуют полипептидную цепь, отдельные части которой сворачиваются в спираль или формируют складки. Такие элементы вторичной структур образуют глобулы, формируя третичную структуру белка. Отдельные глобулы взаимодействуют между собой, образуя сложные белковые комплексы с четвертичной структурой.
Рис. 2. Структурная организация белков.
Видео:Свертывание белков при нагреванииСкачать

Классификация белков
Существует несколько критериев, по которым можно классифицировать белковые соединения. По составу различают простые и сложные белки. Сложные белковые вещества содержат в своем составе неаминокислотные группы, химическая природа которых может быть различной. В зависимости от этого выделяют:
- гликопротеины;
- липопротеины;
- нуклеопротеины;
- металлопротеиды;
- фосфопротеины;
- хромопротеиды.
Также существует классификация по общему типу строения:
Протеинами называют простые (однокомпонентные) белки, состоящие лишь из остатков аминокислот. В зависимости от растворимости они делятся на следующие группы:
| Название протеина | Растворимость | Примеры |
| Проламины | Слабо растворимы в воде, хорошо – в 70-80% этаноле. Содержат большое количество аргинина. | Белки характерны для семян злаков (гордеин содержится в ячмене, зеин – в кукурузе). |
| Гистоны | Растворяются в слабой соляной кислоте. | Присутствуют в составе хроматина, из которого состоят хромосомы. |
| Склеропротеины (протеноиды) | Не растворяются в воде, солевых жидкостях, разбавленных кислотах и щелочах. | Содержатся в опорных тканях (костях, волосах, хрящах, сухожилиях). Включают много пролина, аланина, глицина. |
| Альбумины | Растворяются в воде и растворах солей. | Лактоальбумин – молочный белок, сероальбумин –сыворотки крови. |
| Глобулины | Хорошо растворяются растворах солей слабой концентрации. | Входят в состав бобовых и масленичных растений (фазеолин – семена фасоли, легумин – семена гороха и др.). |
| Протамины | Растворяются в кислотах. | В немалом количестве находятся в половых клетках человека и животных. Например, в сперме рыб (сальмин – семейство лососевых). |
| Глютелины | Растворимы в щелочах. | Содержатся в растениях: плодах и зеленых частях. Глиадин зерновки пшеницы вместе с глютенином образует клейковину, за счет которой тесто становится эластичным.[ЗМ1] |
Подобная классификация не совсем точна, ведь согласно последним исследованиям многие простые белки связаны с минимальным количеством небелковых соединений. Так, в состав некоторых протеинов входят пигменты, углеводы, иногда липиды, что делает их больше похожими на сложные белковые молекулы.
Видео:Свертывание белков при нагревании денатурацияСкачать

Физико-химические свойства белка
Физико-химические свойства белков обусловлены составом и количеством входящих в их молекулы остатков аминокислот. Молекулярные массы полипептидов сильно колеблются: от нескольких тысяч до миллиона и более. Химические свойства белковых молекул разнообразны, включают в себя амфотерность, растворимость, а также способность к денатурации.
Амфотерность
Поскольку в состав белков входят и кислые, и основные аминокислоты, то всегда в составе молекулы будут свободные кислые и свободные основные группы (СОО- и NН3+ соответственно). Заряд определяется соотношением основных и кислых аминокислотных групп. По этой причине белки заряжены “+”, если уменьшается рН, и наоборот, “-”, если рН увеличивается. В случае, когда рН соответствует изоэлектрической точке, белковая молекула будет иметь нулевой заряд. Амфотерность важна для осуществления биологических функций, одной из которых является поддержание уровня рН в крови.
Растворимость
Классификация белков по свойству растворимости уже была приведена выше. Растворимость белковых веществ в воде объясняется двумя факторами:
- заряд и взаимное отталкивание белковых молекул;
- формирование гидратной оболочки вокруг белка – диполи воды взаимодействуют с заряженными группами на внешней части глобулы.
Денатурация
Физико-химическое свойство денатурации представляет собой процесс разрушения вторичной, третичной структуры белковой молекулы под влиянием ряда факторов: температуры, действии спиртов, солей тяжелых металлов, кислот и других химических агентов.
Важно! Первичная структура при денатурации не разрушается.
Рис. 3. Процесс денатурации белка.
Видео:Опыты по химии. Денатурация белков: нагреванием; взаимодействие с кислотой, солями тяжелых металловСкачать

Химические свойства белков, качественные реакции, уравнения реакций
Химические свойства белков можно рассмотреть на примере реакций их качественного обнаружения. Качественные реакции позволяют определить наличие пептидной группы в соединении:
1. Ксантопротеиновая. При действии на белок азотной кислоты высокой концентрации образуется осадок, который при нагревании приобретает желтый цвет.
2. Биуретовая. При действии на слабощелочной раствор белка сульфата меди образуются комплексные соединения между ионами меди и полипептидами, что сопровождается окрашиванием раствора в фиолетово-синий цвет. Реакция используется в клинической практике для определения концентрации белка в сыворотке крови и других биологических жидкостях.
Еще одним важнейшим химическим свойством является обнаружение серы в белковых соединениях. С этой целью щелочной раствор белка нагревают с солями свинца. При этом получают черный осадок, содержащий сульфид свинца.
Видео:Свертывание белков при нагреванииСкачать

Биологическое значение белка
Рис. 4. Структура фермента аланинаминотрансферазы
Благодаря своим физическим и химическим свойствам белки выполняют большое количество биологических функций, в перечень которых входят:
- каталитическая (белки-ферменты);
- транспортная (гемоглобин);
- структурная (кератин, эластин);
- сократительная (актин, миозин);
- защитная (иммуноглобулины);
- сигнальная (рецепторные молекулы);
- гормональная (инсулин);
- энергетическая.
Белки важны для организма человека, поскольку участвуют в образовании клеток, обеспечивают сокращение мышц у животных, вместе с сывороткой крови переносят многие химические соединения. Помимо этого, белковые молекулы являются источником незаменимых аминокислот и осуществляют защитную функцию, участвуя в выработке антител и формировании иммунитета.
Видео:Свертывание белков при нагреванииСкачать

ТОП-10 малоизвестных фактов о белке
Интересный факт! Первый белок выделили из муки
- Белки начали изучать с 1728 года, именно тогда итальянец Якопо Бартоломео Беккари выделил белок из муки.
- Сейчас широкое распространение получили рекомбинантные белки. Их синтезируют путем модификации генома бактерий. В частности, таким способом получают инсулин, факторы роста и другие белковые соединения, которые используют в медицине.
- У антарктических рыб были обнаружены белковые молекулы, предотвращающие замерзание крови.
- Белок резилин отличается идеальной эластичностью и является основой мест крепления крыльев насекомых.
- В организме есть уникальные белки шапероны, которые способны восстанавливать корректную нативную третичную или четвертичную структуру других белковых соединений.
- В ядре клетки присутствуют гистоны – белки, которые принимают участие в компактизации хроматина.
- Молекулярную природу антител – особых защитных белков (иммуноглобулинов) – начали активно изучать с 1937 года. Тиселиус и Кабат применяли электрофорез и доказали, что у иммунизированных животных увеличена гамма-фракция, а после абсорбции сыворотки провоцирующим антигеном, распределение белков по фракциям возвращалось к картине интактного животного.
- Яичный белок – яркий пример реализации белковыми молекулами резервной функции.
- В молекуле коллагена каждый третий аминокислотный остаток образован глицином.
- В составе гликопротеинов 15-20% составляют углеводы, а в составе протеогликанов их доля – 80-85%.
Видео:Свертывание белков при нагреванииСкачать

Заключение
Белки – сложнейшие соединения, без которых сложно представить жизнедеятельность любого организма. Выделено более 5000 белковых молекул, но каждый индивидуум обладает собственным набором белков и этим отличается от других особей своего вида.
📺 Видео
Опыты по химии. Цветные реакции белка: биуретовая; ксантопротеиноваяСкачать

свёртывание белков при нагреванииСкачать

свёртывание белков при нагреванииСкачать

Свертывание белков при нагреванииСкачать

Осаждение белков спиртомСкачать

Видеоопыты. Органика 78. Свертывание белков при нагреванииСкачать

Денатурация белка в спиртеСкачать

свёртывание белков при нагреванииСкачать

Денатурация и ренатурация белков. 10 класс.Скачать

Свертывание белков при нагреванииСкачать

Химия Органика 091 Свертывание белков при нагреванииСкачать