- Титратор для окислительно-восстановительного титрования. GT-200.
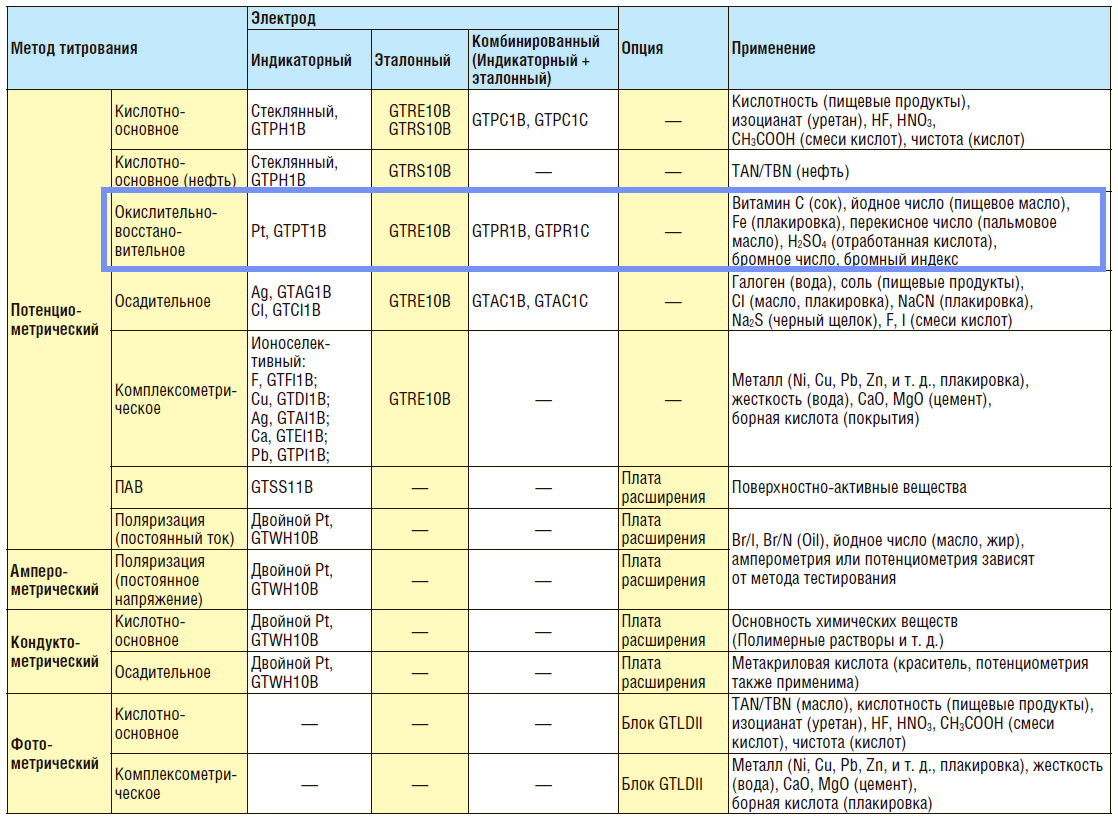
- Подбор электродов для О-В титрование
- Сущность окислительно-восстановительного титрования
- Виды окислительно-восстановительного титрования
- Индикаторное и потенциометрическое титрование.
- Применение окислительно-восстановительного титрования
- Окислительно-восстановительное титрование (Red-Ox-метрия)
- Окислительно-восстановительное титрование
- ОКИСЛИ́ТЕЛЬНО-ВОССТАНОВИ́ТЕЛЬНОЕ ТИТРОВА́НИЕ
- 📽️ Видео
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Титратор для окислительно-восстановительного титрования. GT-200.
Современные потенциометрические титраторы прекрасно подходят для автоматизации традиционных методик окислительно-восстановительного титрования. С помощью потенциометрического титрования возможно проведение анализа окрашенных и мутных растворов, сильных окислительных и неводных сред, процесс легко автоматизируется.
К универсальным титраторам, выполняющим различные виды титрования, относится потенциометрический титратор GT-200 производства «Mitsubishi — Nittoseiko» , стандартная комплектация которого включает:
установку для потенциометрического анализа;
магнитную мешалку (GT-200STR);
автоматическую бюретку (GT-200BRT);
дозировочную кассету для бюретки и держатель для смены кассет.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Подбор электродов для О-В титрование
Для решения определенной задачи необходимо правильно подобрать систему электродов. В случае потенциометрического титратора GT-200 производителем разработан гид для выбора электродов.
ОВ-электроды изготавливаются из благородных металлов (Pt, Au). Наиболее распространенными являются Pt-электроды.
Для окислительно-восстановительного титрования предлагается использование раздельной пары электродов, состоящей из: измерительного платинового (GTPT1B) и стеклянного хлорсеребряного электрода сравнения (GTRE10B), и комбинированных платиновых электродов (GTPR1B, GTPR1C).
Предусмотрена возможность подключения дополнительного оборудования: весов, автосамплера (GT-200SC), принтера, диспенсера растворителя (GT-200SD), фотометрического детектора (GTLDII).
Видео:Окислительно-восстановительное титрование (видео 17) | Титриметрический анализ | ХимияСкачать
Сущность окислительно-восстановительного титрования
Метод окислительно-восстановительного титрования (ОВ) основан на химической реакции между определяемым компонентом и стандартным раствором окислителя или восстановителя (титранта). Количественное содержание анализируемого вещества устанавливается с помощью измерения точных объемов растворов с известными концентрациями, взаимодействующих друг с другом. Возможность и степень прохождения реакции характеризуется окислительно-восстановительным потенциалом.
Для проведения ОВ титрования необходимо выполнение определенных требований:
титрант должен реагировать только с анализируемым компонентом, нацело и быстро;
простота и воспроизводимость обнаружения конечной точки титрования (КТТ).
Зависимость определяемой величины (потенциала) от объема титранта, представленная в виде графика, называется кривой титрования, построение которой нужно для нахождения точки эквивалентности (ТЭ).
Видео:окислительно восстановительное титрованиеСкачать

Виды окислительно-восстановительного титрования
Различают прямое, обратное и заместительное титрование.
Анализ прямым способом проводят при значении ОВ потенциала ≥ 0,4 В, обратным – при низкой скорости реакции. При использовании заместительного способа – титруют эквивалентное количество продукта, образующегося при реакции реагента с анализируемым компонентом.
Классификация методов окислительно-восстановительного титрования проводится по названиям используемых титрантов.
Перманганатометрия. Основа метода – процесс окисления перманганатом калия (KMnO4), образующего ярко окрашенные растворы, являющиеся индикатором титрования. Находит применение для анализа неорганических и органических веществ.
Дихроматометрия. Основа метода – процесс окисления дихроматом калия, реагирующего с соединениями органической природы менее интенсивно, чем KMnO4, поэтому в основном не используется для их анализа. Для нахождения КТТ необходимы дополнительные индикаторы (дифениламин или др).
Применяется для определения неорганических и ряда органических веществ, химического потребления кислорода (ХПК) в воде.
Йодометрия. Основа метода – процесс окисления йодом (I2) или восстановления йодид-ионами. Недостатки — низкая растворимость I2 в воде.
Броматометрия. Основа метода – процесс окисления броматом калия (KBrO3).
Преимущества — возможность определения ненасыщенных, ароматических и гетероциклических соединений, устойчивость растворов KBrO3. Недостатки – побочные продукты, некоторые реакции проходят нестрого в стехиометрических соотношениях.
Цериметрия. Основа метода – процесс окисления сульфатом церия (IV). Преимущества — устойчивость реагентов, отсутствие побочных продуктов, возможность применения в присутствии соляной кислоты.
В представленной классификации описаны наиболее часто используемые окислительно-восстановительные реакции, применяемые в титровании.
Видео:Окислительно-восстановительное титрование: перманганатометрия.Скачать

Индикаторное и потенциометрическое титрование.
Индикаторное титрование основано на реакции индикатора с окислителем или восстановителем, который изменяет окраску раствора с приближением к ТЭ.
В потенциометрии установление ТЭ проводят по изменению потенциала электрода в процессе взаимодействия потенциалоопределяющего компонента и титранта.
Преимущества метода заключаются:
в получении более точных результатов, титрования веществ, для которых не подобраны индикаторы или если их применение невозможно;
в анализе нескольких компонентов в одном растворе;
в хорошей воспроизводимости, отсутствии индикаторной ошибки.
Индикаторы, используемые в окислительно-восстановительном титровании, делятся на 4 основные группы: специфические, редокс-индикаторы, комплексные соединения некоторых металлов, органические красители, окисляемые необратимо.
Титрование, проводимое с помощью фотометрического датчика, позволяет определять ТЭ по изменению оптических свойств титруемого раствора (оптической плотности, величин пропускания и поглощения, спектральных характеристик). К преимуществам данного метода относится возможность проведения реакций, в которых визуально невозможно определить КТТ из-за неярко выраженного изменения окраски, а также возможность автоматизации методик индикаторного титрования для нормативных документов, в которых не описана потенциометрия.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Применение окислительно-восстановительного титрования
ОВ титрование находит применение в различных областях для решения задач количественного анализа.
В нефтехимии – для установления в нефти, продуктах ее переработки, смазочных материалах, различных видах топлива и др.: бромного числа и индекса (ГОСТ 8997, UOP 304, ASTM 1159 и 2710); йодного числа, непредельных углеводородов (ГОСТ 2070-82).
В экологии — для анализа содержания цианидов в почве (ISO 11262) и определения в питьевой воде, природных и сточных водах: перманганатной окисляемости (ГОСТ Р 55684-2013, ГОСТ 23268.12); ХПК (ISO 6060 и 15705); жесткости (ГОСТ Р 52407, ГОСТ 31954, ASTM D1126);
В медицине – для анализа лекарств (например, содержание фенола в гормональных препаратах, определение витамина С и др.) (Фармакопея XI. Выпуск 2.).
В пищевой промышленности — для определения витамина С в соках (ГОСТ 24556-89), йодного числа в маслах растительного и животного происхождения, жирах (ГОСТ 5475-69, ГОСТ Р ИСО 3961-2010), пероксидов в растительных маслах (ГОСТ 26593-85, ГОСТ Р 51487-99).
Видео:Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

Окислительно-восстановительное титрование (Red-Ox-метрия)
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Видео:Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Окислительно-восстановительное титрование
– использует реакции, протекающие с изменением степени окисления реагирующих веществ.
Каждую окислительно-восстановительную реакцию можно представить как сумму двух полуреакций. Одна реакция отражает превращение окислителя, а вторая – восстановителя:
Молярная масса эквивалента окислителя или восстановителя в реакции зависит от числа принятых или отданных одной молекулой окислителя (восстановителя) электронов. Молярная масса эквивалента окислителя (восстановителя) равна произведению фактора эквивалентности данного вещества на его молярную массу:
M (fэкв (В)В) = fэкв (В) М (В),
где M (fэкв (В)В) – молярная масса эквивалента вещества В
М (В) – молярная масса вещества В
fэкв (В) – фактор эквивалентности вещества.
fэкв (В) = 1/n,
n – число электронов, принятых или отданных одной молекулой окислителя (восстановителя) в данной реакции.
Требования к реакциям в Red-Ox-метрии
К реакциям, применяемым в окислительно-восстановительном титровании, предъявляются следующие требования:
а) Реакции должны протекать до конца, являться необратимыми, не сопровождаться побочными процессами.
б) В ходе реакции должны образовываться продукты определенного известного состава.
в) Реакции должны протекать быстро.
г) Должна быть возможность фиксировать точку эквивалентности.
К недостатком окислительно-восстановительных реакций в большинстве случаев относится их невысокая скорость, что затрудняет процесс титрования. Для ускорения реакций применяют нагревание. Если нагревание использовать нельзя (вещество разлагается или улетучивается), то увеличивают концентрацию вещества или используют катализаторы.
Окислительно-восстановительный потенциал и факторы, влияющие на него
Известно, что химическая реакция протекает только в том случае, если изменение энергии Гиббса ∆Gr 0.
Окислительно-восстановительный потенциал или редокс-потенциал – это количественная характеристика окислительно-восстановительной реакции.
Окислительно-восстановительный потенциал E или φ зависит от природы окислительно-восстановительной пары, концентрации (активности) ионов окислителя и восстановителя, температуры. Количественно зависимость от этих параметров определяется уравнением Нернста:
ЕOx/Red = Е 0 Ox/Red + (0,059/n) lg([Ox] a / [Red] b ),
где ЕOx/Red – окислительно-восстановительный потенциал пары Ox – Red, В;
Е 0 Ox/Red – стандартный окислительно-восстановительный потенциал пары Ox – Red, В;
([Ox] и [Red] – молярная концентрация окисленной и восстановленной форм соответственно, моль/л,
a и b – стехиометрические коэффициенты.
Если реакция протекает с участием молекул или ионов среды, то их концентрации также вводят в уравнение Нернста. Так для полуреакции MnO4 – + 8H + +5e – → Mn 2+ + 4H2O уравнение Нернста может быть записано следующим образом:
Е MnO4-/ Mn2+ = Е 0 MnO4-/ Mn2+ + (0,059/5) lg([MnO4 – ] · [H + ] 8 / [Mn 2+ ]).
Реальный потенциал редокс-пары титрантов окислителей должен иметь значение потенциала на 0,4 – 0,5 В выше, чем потенциал редокс-пары титруемого восстановителя [(Eокисл. – Е восст) > 0,4], только в таком случае выполняются требования к реакциям в Red-Ox-метрии. Для регулирования потенциала редокс-пар титранта и определяемого вещества используют изменение рН среды, комплексообразующие добавки, увеличение температуры и т.д.
Равновесный окислительно-восстановительный потенциал зависит от ряда факторов:
1) От рН среды. Стандартный окислительно-восстановительный потенциал для приведенной выше реакции Е 0 MnO4-/ Mn2+ = 1,51 B. С увеличением рН раствора окислительно-восстановительный потенциал этой пары будет уменьшаться.
2) От концентрации (активности) окисленной и восстановленной форм окислителя или восстановителя. С изменением концентраций (активностей) окисленной и восстановленной форм величина редокс-потенциала может изменяться. Например, для пары Fe 3+ /Fe 2+ при условии [Fe 3+ ] = [Fe 2+ ] стандартный окислительно-восстановительный потенциал равен 0,77 В. Уравнение Нернста для полуреакции Fe 3+ + 1e → Fe 2+ имеет вид:
Е Fe3+/Fe2+ = Е 0 Fe3+/Fe2+ + 0,059 lg ([Fe 3+ ] / [Fe 2+ ]).
Изменяя концентрации окисленной или восстановленной форм вещества можно изменить величину редокс-потенциала.
Пример 1. Если в раствор, содержащий ионы Fe 3+ и Fe 2+ добавить SnCl2, проявляющий восстановительные свойства, то в растворе в результате реакции
2Fe 3+ + Sn 2+ →2Fe 2+ + Sn 4+ уменьшится концентрация ионов Fe 3+ и увеличиться концентрация ионов Fe 2+ . При этом редокс-потенциал пары Fe 3+ /Fe 2+ уменьшится Е Fe3+/Fe2+ = Е 0 Fe3+/Fe2+.
Пример 2. При добавлении в раствор, содержащий ионы Fe 3+ и Fe 2+ раствора MnO4 – , имеющего свойства окислителя, в результате реакции 5Fe 2+ + 2MnO4 – + 8H + → 5Fe 3+ + 2Mn 2+ + 4H2O
произойдет уменьшение концентрации ионов Fe 2+ и увеличение концентрации ионов Fe 3+ . Следовательно, величина равновесного окислительно-восстановительного потенциала увеличиться Е Fe3+/Fe2+ > Е 0 Fe3+/Fe2+.
От процесса комплексообразования. Величина редокс-потенциала значительно изменяется, если окисленная или восстановленная форма вещества в анализируемом растворе участвует в процессе комплексообразования.
Потенциал редокс-пары, например, M 3+ /M 2+ в отсутствии комплексообразования будет при 25 °С равен:
Е M3+/M2+ = Е 0 M3+/M2+ – 0,059 lg([M 3+ ] / [M 2+ ]),
При комплексообразовании с лигандом L z – концентрация ионов M 3+ уменьшится:
M 3+ + L z – = ML 3- z
Константа устойчивости ML 3- z равна:
βML = [ML 3- z ] / ([M 3+ ] · [L z – ]).
Из данного выражения концентрация ионов M 3+
[M 3+ ] = [ML 3- z ] / ([L z – ] · βML),
Подставив ее в исходное уравнение Нернста, после ряда преобразований получим:
Е M3+/M2+ = Е 0 M3+/M2+ – 0,059 lg βML
Пример 3. В присутствии фторид-ионов, образующих с ионами Fe 3+ комплексный ион FeF 2+ (lg β = 6,04) концентрация ионов Fe 3+ резко падает и потенциал пары Fe 3+ / Fe 2+ уменьшается:
E Fe3+ / Fe2+ = 0,77 – 0,059 · 6,04 = 0,41 B.
За счет изменения потенциала можно изменить направление протекания реакции. Так при добавлении к раствору хлорида железа (III) раствора иодида калия между ними протекает реакция: 2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Стандартные окислительно-восстановительные потенциалы пар составляют:
E 0 Fe3+ / Fe2+ = 0,77 B
E 0 I2 / 2I– = 0,54 B
Тогда ЭДС = Eокисл. – Е восст = 0,77 – 0,54 = 0,23 В.
ЭДС > 0, реакция может протекать.
Если реакцию вести в присутствии фторид-ионов, то реакция протекать не будет, так как ЭДС – ≠
4) От образования малорастворимых веществ. В присутствии ионов, способных образовывать малорастворимые соединения, потенциал окислительно-восстановительной пары можно вычислить следующим образом:
Е 0 Me2+/MeX = Е Me2+/Me – 0,059/n lgПР(MeX) .
Пример 4. ЭДС реакции 2Cu 2+ – 4I – → 2CuI + I2 без учета образования малорастворимого иодида меди (I) CuI равна
ЭДС = E 0 окисл. – Е 0 восст = E 0 Cu2+ / Cu+ – E I2 / 2I– = 0,159 – 0,54 = -0,399B, ЭДС 0 Cu2+ / CuI = 0,159 + 0,059 · 11,96 = 0,865 B
И ЭДС реакции 2Cu 2+ – 4I – → 2CuI + I2
ЭДС = E 0 Cu2+ / CuI – E 0 I2 / 2I- = 0,865 – 0,54 = 0,325 B.
Таким образом, для данной реакции ЭДС > 0, поэтому реакция осуществима.
Классификация методов Red-Ox-метрии и способы титрования
Окислительно-восстановительное титрование или редоксиметрия (от латинского oxydatio – окисление и reductio – восстановление) основано на реакциях окисления-восстановления. Если титрант – окислитель, то титрование называют окислительным (оксидиметрия). Если титрант – восстановитель, то титрование восстановительное (редуциометрия)
По типу применяемого титранта методы окислительно-восстановительного титрования делятся на следующие виды:
• Пермангатометрическое – титрант раствор KMnO4;
• Иодометрическое титрование – титранты растворы I2 и Na2S2O3;
• Броматометрическое – титрант раствор KBrO3;
• Бромометрическое – титрант раствор Br2 (KBrO3 + KBr);
• Хроматометрическое – титрант раствор K2Cr2O7 и т.д.
Редокс-титрование может быть выполнено различными способами: прямое титрование, обратное титрование и заместительное титрование.
Прямое титрование проводят при ЭДС ≥ 0,4 В, что обеспечивает необходимую полноту и скорость протекания реакции.
Прямым титрованием можно определить:
Обратное титрование – используют при медленно протекающих реакциях. При этом к титруемой смеси добавляют избыток реагента (титранта 1) и выдерживают определенное время для полноты протекания реакции. Затем избыток реагента (титранта 1) оттитровывают другим титрантом 2.
Пример 5. При определении сульфидов добавляют раствор I2 (титрант 1), избыток которого затем оттитровывают раствором Na2S2O3 (титрант 2):
Na2S + I2 (изб.) + 2HCl = S + 2NaCl + 2HI
I2(ост) + 2Na2S2O3 = 2NaI + Na2S4O6
n(1/2 Na2S) = n (1/2 I2) – n (Na2S2O3)
Пример 6. Определение содержания свободного или связанного формальдегида в разнообразных технических продуктах:
HCHO + H2O2 → HCOOH + H2O
HCOOH + NaOH(изб) → HCOONa + H2O
NaOH(ост) + HCl → NaCl + H2O
N (1/2 HCHO) = n (NaOH) – n (HCl)
Заместительное титрование – определяют заместитель – продукт реакции, выделяющийся в эквивалентном количестве при взаимодействии определяемого вещества с каким-либо реагентом.
Таким образом, например, можно определять вещества, не вступающие в окислительно-восстановительные реакции.
Окислительно-восстановительные индикаторы
Для определения точки эквивалентности в Red-Ox-метрии используют различные индикаторы:
1) Окислительно-восстановительные индикаторы (редокс-индикаторы), изменяющие цвет при изменении окислительно-восстановительного потенциала системы.
2) Специфические индикаторы, изменяющие свой цвет при появлении избытка титранта или исчезновении определяемого вещества. Специфические индикаторы применяют в некоторых случаях. Так крахмал – индикатор на присутствие свободного йода, вернее трииодид-ионов I – 3. В присутствии I – 3 крахмал при комнатной температуре синеет. Появление синей окраски крахмала связано с адсорбцией I – 3 на амилазе, входящей в состав крахмала.
Иногда в качестве индикатора используют тиоцианат аммония NH4SCN при титровании солей железа(III), катионы Fe 3+ с ионами SCN – образуют соединение красного цвета. В точке эквивалентности все ионы Fe 3+ восстанавливаются до Fe 2+ и титруемый раствор из красного становится бесцветным.
При титровании раствором перманганата калия сам титрант играет роль индикатора. При малейшем избытке KMnO4 раствор окрашивается в розовый цвет.
Редокс-индикаторы делятся на: обратимые и необратимые.
Обратимые индикаторы – обратимо изменяют свой цвет при изменении потенциала системы. Необратимые индикаторы – подвергаются необратимому окислению или восстановлению, в результате чего цвет индикатора изменяется необратимо.
Редокс-индикаторы существуют в двух формах окисленной (Indoкисл) и восстановленной (Indвосст.), причем цвет одной формы отличается от цвета другой.
Indoкисл + ne – ↔ Indвосст
Переход индикатора из одной формы в другую и изменение его окраски происходит при определенном потенциале системы (потенциале перехода). Потенциал индикатора определяется по уравнению Нернста:
EInd = E 0 Ind +0,059/n lg ([Indoкисл] / [Indвосст])
При равенстве концентраций окисленной и восстановленной форм индикатора EInd = E 0 Ind. При этом половина молекул индикатора существует в окисленной форме, половина – в восстановленной форме. Интервал перехода индикатора (ИП) лежит в пределах отношений концентраций обеих форм индикатора от 1/10 до 10/1.
При проведении окислительно-восстановительного титрования необходимо подбирать индикатор таким образом, чтобы потенциал индикатора находился в пределах скачка потенциала на кривой титрования. Многие индикаторы окислительно-восстановительного титрования обладают кислотными или основными свойствами и могут менять свое поведение в зависимости от рН среды.
Одним из наиболее известных и употребимых редокс-индикаторов является дифениламин (C6H5) 2NH.
Восстановленная форма индикатора бесцветная. Под действием окислителей дифениламин сначала необратимо переходит в бесцветный дифенилбензидин, который затем обратимо окисляется до сине-фиолетового дифенилбензидинфиолетового. EInd = 0,76 B.
Титрование индикаторным методом возможно, если для данной реакции ЭДС ≥ 0,4 В. При ЭДС = 0,4 – 0,2 В используют инструментальные индикаторы.
Кривые окислительно-восстановительного титрования
Кривую окислительно-восстановительного титрования представляют в виде зависимости потенциала E от количества добавленного титранта V (рис. 1 – А):
E = f (V)
Величина скачка в точке эквивалентности зависит от разности потенциалов двух окислительно-восстановительных пар, участвующих в процессе. Увеличение ЭДС приводит к возрастанию скачка титрования. Для увеличения ЭДС можно изменять концентрацию одного из компонентов редокспары. У окислителей можно повысить реальный потенциал редокс-пары, связав в комплекс восстановленную форму. Потенциал восстановителя можно понизить, связав в комплекс его окисленную форму.
Рис. 1. Кривые окислительно-восстановительного титрования:
А – интегральная кривая; В – дифференциальная кривая.
Для нахождения точки эквивалентности часто строят дифференциальную кривую в координатах ∆E/∆V – V (рис. 1 – Б). На точку эквивалентности указывает максимум полученной кривой, а отсчет по оси абсцисс, соответствующий этому максимуму, дает объем титранта, израсходованного на титрование до точки эквивалентности. Определение точки эквивалентности по дифференциальной кривой значительно точнее, чем по простой зависимости E – V.
Перманганатометрия
В сильнокислой среде перманганат-ионы обладают высоким окислительно-восстановительным потенциалом, восстанавливаясь при этом до Mn(II). Поэтому перманганат калия применяют для определения многих восстановителей. Окисление восстановителей можно проводить в различных средах. Перманганат калия в кислой среде восстанавливается до ионов Mn 2+ , в нейтральной – до марганца(IV) или диоксида марганца MnO2, в щелочной среде – до марганца(VI) или манганата калия K2MnO4.
В методе перманганатометрии титрование чаще проводят в кислой среде:
MnO4 – + 8H + + 5e – → Mn 2+ + 4H2O
E 0 = 1,51 B; M(1/5 KMnO4) = 31,608 г/моль
Реже используют титрование в нейтральной среде:
MnO4 – + 2H2O + 3e – → MnO2 + 4OH –
E 0 = 0,60 B; M (1/3 KMnO4) = 52,68 г/моль
При титровании перманганатом не применяют индикаторы, так как титрант сам окрашен и является чувствительным индикатором: 0,1 мл 0,01 М раствора KMnO4 окрашивает 100 мл воды в бледно-розовый цвет.
Приготовление 0,1 н. (0,05 н.) раствора перманганата калия
Титрованный раствор перманганата калия по точной навеске кристаллического KMnO4 приготовить нельзя, так как в нем всегда содержится некоторое количество MnO2 и других продуктов разложения. Поэтому раствор перманганата калия относится к вторичным стандартным растворам. Первоначально готовят раствор KMnO4, концентрация которого приблизительно равна необходимой концентрации. Навеску берут на технохимических весах несколько больше расчетной величины. Так как KMnO4 является сильным окислителем и изменяет свою концентрацию в присутствии различных восстановителей, то приготовленный раствор перманганата калия выдерживают 7–10 дней в темном месте для того, чтобы прошли все окислительно-восстановительные процессы с примесями, содержащимися в воде. Затем раствор фильтруют. Только после этого концентрация раствора становится постоянной и его можно стандартизировать по щавелевой кислоте или по оксалату аммония. Растворы KMnO4 следует хранить в бутылях из темного стекла. Приготовленный таким способом раствор перманганата калия с молярной концентрацией эквивалента 0,05 моль/л и выше не изменяет свой титр довольно продолжительное время.
Стандартизация раствора перманганата калия по щавелевой кислоте или оксалату аммония (натрия)
Способ определения основан на окислении щавелевой кислоты перманганат-ионами в кислой среде:
5H2C2O4 + 2KMnO4 + 3H2SO4 → 2MnSO4 + 10CO2 + K2SO4 + 8H2O
При этом полуреакции окисления и восстановления имеют вид:
H2C2O4 – 2e – = 2CO2 + 2H +
MnO2 – + 8H + + 5e – = Mn 2+ + 4H2O
Тогда fэкв (H2C2O4) = 1/2; fэкв (KMnO4) = 1/5
При комнатной температуре эта реакция протекает медленно. И даже при повышенной температуре скорость ее невелика, если она не катализирована ионами марганца(II). Нагревать кислоту выше 70-80 °С нельзя, так как при этом часть кислоты окисляется кислородом воздуха:
Реакция взаимодействия перманганата калия со щавелевой кислотой относится к автокаталитическим реакциям. Реакция окисления щавелевой кислоты протекает в несколько стадий. Первые капли перманганата калия даже в горячем растворе обесцвечиваются очень медленно. Для ее начала необходимо присутствие в растворе хотя бы следов Mn 2+ :
1. MnO4 – + MnC + O4 → MnO4 2- + MnC2O4 +
Образовавшийся манганат-ион MnO4 2- в кислом растворе быстро диспропорционирует:
2. Mn (VI) + Mn (II) = 2 Mn (IV)
3. Mn (IV) + Mn(II) = 2Mn (III)
Марганец (III) образует оксалатные комплексы состава [Mn(C2O4) n] (3-2 n )+ , где n = 1,2,3; эти комплексы медленно разлагаются с образованием Mn 2+ и CO2
Таким образом, пока в растворе не накопится в достаточных концентрациях марганец (II), реакция между MnO4 – и С2O4 2- протекает медленно. Когда концентрация марганца(II) достигает определенной величины, реакция начинает протекать с большой скоростью.
Интенсивная окраска раствора перманганата калия осложняет измерение объемов титранта в бюретке. На практике удобно за уровень отсчета принимать поверхность жидкости, а не нижнюю часть мениска.
Оксалат аммония обладает некоторыми преимуществами по сравнению с другими установочными веществами:
– хорошо кристаллизуется и легко растворяется в воде,
– имеет определенный химический состав и не изменяется при хранении,
– не взаимодействует с кислородом воздуха и СО2 .
Для установки концентрации (титра или молярной концентрации эквивалентов) стандартного раствора перманганата калия рассчитывают навеску щавелевой кислоты H2С2O4 · 2H2O или оксалата аммония (NH4)2C2O4, необходимую для приготовления раствора с молярной концентрацией эквивалента 0,1 моль/л (или 0,05 н.). Рассчитанное количество кислоты (или соли) взвешивают на аналитических весах. Взвешенную массу кислоты (или соли) растворяют в воде в мерной колбе, раствор тщательно перемешивают. Затем титруют раствор KMnO4. Расчет концентрации перманганата калия во всех случаях проводят на основании закона эквивалентов:
N (1/2 H2C2O4) = n (1/5 KMnO4)
Тогда C (1/2 H2C2O4 · 2H2O) · V (H2C2O4 · 2H2O) = C (1/5 KMnO4) · V (KMnO4)
Поскольку ион MnO – 4 является сильным окислителем (особенно в кислой среде), то метод перманганатометрии применяется для определения различных восстановителей таких как: H2O2, Fe 2+ , NO – 2, некоторых органических веществ.
Выполнение эксперимента
В коническую колбу для титрования наливают мерным цилиндром 20 мл раствора H2SO4 (1:5) и нагревают до 80 – 90 °С.
Бюретку ополаскивают раствором KMnO4, доводят уровень жидкости до нулевой отметки по верхней границе раствора. Проверяют, нет ли воздушного пузыря в носике бюретки.
В горячий раствор кислоты пипеткой вносят 10,00 мл раствора щавелевой кислоты (оксалата натрия) и титруют раствор кислоты раствором перманганата калия. В начале титрования прибавляют раствор KMnO4 из бюретки по 0,5 мл, дожидаясь обесцвечивания раствора в колбе, перемешивая раствор кругообразными движениями. Для лучшего определения окраски под колбу помещают лист белой бумаги. Когда обесцвечивание раствора вследствие автокатализа будет проходить быстро, раствор титранта прибавляют по каплям. В точке эквивалентности от прибавления одной капли титранта раствор приобретает бледно-розовую окраску устойчивую в течение 30 секунд. Оттитровывают еще две пробы по той же методике. Результаты параллельных определений не должны отличаться более чем на 0,1 – 0,2 мл. Рассчитывают концентрацию и титр определяемого вещества в растворе, используя среднее значение объема титранта, пошедшего на титрование.
Определение железа (II)
Титрование железа (II) основано на реакции:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5 Fe2 (SO4) 3 + 2MnSO4 + K2SO4 + 8H2O
Титровать железо(II) перманганатом калия можно в сернокислой или солянокислой средах. В первом случае не наблюдается никаких осложнений. Присутствие в титруемом растворе хлорид-ионов приводит к перерасходу перманганата и получению нечеткого конца титрования. Это вызвано тем, что реакция между железом(II) и перманганатом индуцирует реакцию между ионами MnO4 – и Cl –
MnO4 – + 10Cl – + 16H + → 2Mn 2+ + 5Cl2 + 8H2O
Причем в отсутствие ионов Fe 2+ эта реакция не идет. Реакции подобного типа, не идущие одна без другой, Н.А. Шилов назвал сопряженными или индуцированными. Индуцированной реакции не возникает, если в растворе присутствуют в достаточных количествах фосфорная кислота и марганец (II). Поэтому перед титрованием в раствор добавляют смесь Рейнгарда-Циммермана, состоящую из серной, фосфорной кислот и сульфата марганца(II). Присутствие H2SO4 в этой смеси создает требуемую концентрацию протонов в титруемом растворе. Присутствие H2PO4 необходимо для связывания железа (III) в бесцветный комплекс и образования фосфатных комплексов марганца (III). Если железо не маскировать, то окраска его комплексных хлоридов будет затруднять наблюдение бледно-розовой окраски в конце титрования перманганатом калия. Железо(III) перед титрованием необходимо восстановить до железа(II).
Выполнение эксперимента. Раствор или навеску анализируемого вещества помещают в мерную колбу вместимостью 100 мл (Vk), добавляют примерно 50 мл 2 н. раствора серной кислоты и водой доводят объем содержимого колбы до метки, тщательно перемешивают. Аликвотную часть полученного раствора (Va 10,00 мл) осторожно переносят в коническую колбу для титрования вместимостью 250 мл, добавляют 5 мл смеси Рейнгарда-Циммермана, 100 мл воды и при интенсивном перемешивании медленно оттитровывают раствором перманганата калия до появления бледно-розовой окраски устойчивой в течение 30 с. Отмечают объем израсходованного титранта (V1). Оттитровывают еще две пробы по той же методике. Результаты параллельных определений не должны отличаться более чем на 0,1-0,2 мл. Вычисляют содержание железа (II) в анализируемом растворе или навеске исследуемого вещества:
Схемы основных реакций, используемых в Red-Ox-метрии
Видео:ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.Скачать

ОКИСЛИ́ТЕЛЬНО-ВОССТАНОВИ́ТЕЛЬНОЕ ТИТРОВА́НИЕ
В книжной версии
Том 24. Москва, 2014, стр. 19
Скопировать библиографическую ссылку:
ОКИСЛИ́ТЕЛЬНО-ВОССТАНОВИ́ТЕЛЬ НОЕ ТИТРОВ А́НИЕ, один из наиболее часто применяемых методов титриметрического анализа , основанный на использовании окислительно-восстановительных реакций: $ce $ , где $ce $ и $ce $ – окисленные и восстановленные формы; a , b , c , d – стехиометрич. коэффициенты. Если определяемый компонент – окислитель $ce $ , титрантом служит стандартизованный раствор восстановителя $ce $ (и наоборот). Как и в др. методах титриметрии, реакция должна протекать количественно, стехиометрически и быстро. Полнота протекания реакции зависит от разности стандартных потенциалов полуреакций $(Delta E^0)$ : чем она больше, тем больше константа равновесия и тем полнее протекает реакция. Наиболее часто применяемые титранты – $ce $ , $ce $ , $ce $ , $ce $ , хлорид или сульфат $ce $ , $ce $ – дали названия разновидностям О.-в. т.: броматометрия, дихроматометрия, иодометрия, перманганатометрия, хромометрия, цериметрия. Установить конечную точку титрования (КТТ) можно визуально (без индикатора) – по появлению окраски избытка окрашенного титранта (перманганата калия), с помощью окислительно-восстановительных (ферроин, дифениламин и его производные) или специфических – образующих интенсивно окрашенное соединение с одним из участников реакции титрования (напр., крахмал) индикаторов, а также используя инструментальные методы (потенциометрию, амперометрию).
📽️ Видео
Окислительно-восстановительное титрование: нитритометрия, цериметрия.Скачать

Кузьмич Е.С. Окислительно восстановительное титрование.Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Решение ОВР методом полуреакцийСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Шеховцова Т.Н. - Аналитическая химия - Окислительно-восстановительное титрование. Скорость реакцийСкачать

Методы титрования Сущность. Кузьмич Е.ССкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Учимся составлять электронный баланс/овр/8классСкачать

ОВР для чайников — Как определить Окислитель и Восстановитель #shorts #youtubeshortsСкачать

Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать