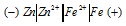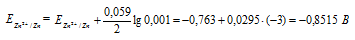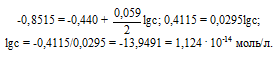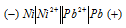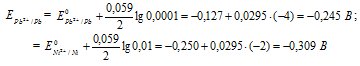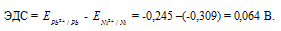Заряд и разряд аккумулятора являются основными процессами, которые идут при его эксплуатации. Во время заряда аккумуляторная батарея восполняет потерянную ёмкость и по окончании процесса вновь может эксплуатироваться. В этом материале речь пойдёт о заряде аккумуляторов основных типов: свинцово-кислотных, щелочных и литиевых. Будут рассмотрены процессы происходящие при зарядке и режимы.
- Заряд аккумуляторов различных типов
- Свинцово-кислотные АКБ
- Происходящие процессы
- Режимы заряда
- Щелочные аккумуляторные батареи
- Происходящие процессы
- Режимы заряда
- Литиевые
- Происходящие процессы
- Режимы заряда
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Химические процессы протекающие на электродах при зарядке и разрядке аккумулятора. Концентрация ионов на электродах
- Решение задач по химии на составление схемы аккумулятора
- 📸 Видео
Видео:Химические процессы, происходящие в аккумуляторах. 10 класс.Скачать

Заряд аккумуляторов различных типов
Свинцово-кислотные АКБ
Самой распространённой сферой применения свинцово-кислотных аккумуляторов, являются стартерные батареи в транспортных средствах. Они применяются для запуска двигателя, а также поддержки генератора при сильной нагрузке на бортовую сеть автомобиля. В штатном режиме работы свинцово-кислотные АКБ не испытывают глубокого разряда. Заряд батареи после пуска осуществляется током, вырабатываемым генератором. Кроме того, рекомендуется периодически выполнять зарядку стартерного аккумулятора от зарядного устройства. Какие реакции при этом происходят?
Происходящие процессы
В электрохимической реакции внутри свинцово-кислотного аккумулятора участвуют материалы положительного и отрицательного электрода, а также электролит. Активная масса положительного электрода представляет собой диоксид свинца (PbO2). В случае с отрицательным электродом – это порошок свинца (Pb). При заряде свинцово-кислотной аккумуляторной батареи на электродах протекают следующие реакции.
Общий процесс в электрохимической системе описывается уравнением.
В процессе заряда из электролита расходуется вода и постепенно увеличивается его плотность. Плотность электролита полностью заряженного аккумулятора находится около 1,27 гр/см 3 . Ниже можно посмотреть таблицу степени заряженности АКБ.
| Плотность электролита, г/см. куб. (+15 гр. Цельсия) | Напряжение, В (в отсутствии нагрузки) | Напряжение, В (с нагрузкой 100 А) | Степень заряда АКБ, % | Температура замерзания электролита, гр. Цельсия |
|---|---|---|---|---|
| 1,11 | 11,7 | 8,4 | 0 | -7 |
| 1,12 | 11,76 | 8,54 | 6 | -8 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,14 | 11,88 | 8,84 | 19 | -11 |
| 1,15 | 11,94 | 9 | 25 | -13 |
| 1,16 | 12 | 9,14 | 31 | -14 |
| 1,17 | 12,06 | 9,3 | 37,5 | -16 |
| 1,18 | 12,12 | 9,46 | 44 | -18 |
| 1,19 | 12,18 | 9,6 | 50 | -24 |
| 1,2 | 12,24 | 9,74 | 56 | -27 |
| 1,21 | 12,3 | 9,9 | 62,5 | -32 |
| 1,22 | 12,36 | 10,06 | 69 | -37 |
| 1,23 | 12,42 | 10,2 | 75 | -42 |
| 1,24 | 12,48 | 10,34 | 81 | -46 |
| 1,25 | 12,54 | 10,5 | 87,5 | -50 |
| 1,26 | 12,6 | 10,66 | 94 | -55 |
| 1,27 | 12,66 | 10,8 | 100 | -60 |
| Плотность электролита, г/см. куб. (+15 гр. Цельсия) | Напряжение, В (в отсутствии нагрузки) | Напряжение, В (с нагрузкой 100 А) | Степень заряда АКБ, % | Температура замерзания электролита, гр. Цельсия |
Основной проблемой в процессе заряда свинцово-кислотного аккумулятора является неполное растворение сульфата свинца (PbSO4). Это вещество забивает поры активной массы, в результате чего снижается площадь взаимодействия электролита с материалом электрода. Из-за этого происходит постепенная потеря ёмкости.
По мере эксплуатации аккумуляторной батареи сульфата свинца на пластинах после заряда остаётся всё больше. Процесс носит название сульфатации. Он является причиной выхода из строя большинства свинцово-кислотных аккумуляторов на транспортных средствах.
Режимы заряда
Если не считать ускоренной зарядки, то есть две основные схемы заряда свинцово-кислотных аккумуляторных батарей. При постоянном напряжении и постоянном токе. Сегодня в продаже можно найти много зарядных устройств (ЗУ), имеющих возможность использования этих режимов, а также их комбинаций.
Наиболее распространённой является схема заряда при постоянном напряжении. Смысл здесь в том, что на терминалы аккумулятора подаётся постоянное напряжение. Заряд обеспечивается благодаря выравниванию напряжений на выводах ЗУ. Полнота заряда в этом случае зависит от напряжения, подаваемого на только выводы АКБ. То есть если заряжать аккумуляторную батарею одинаковое время напряжением 14,4, 15 и 16 вольт, то наиболее полный заряд достигается при 16 В.
Другой распространённой схемой является заряд постоянным током. Этот процесс включает в себя несколько этапов, на каждом из которых поддерживается постоянная сила тока.
Такая схема зарядки требует постоянного контроля и корректировки подаваемого тока. Этапы разделяются по уровню напряжения на выводах аккумулятора.
Обычно процесс выглядит следующим образом.
- На первом этапе сила тока устанавливается в размере 10% от номинальной ёмкости АКБ. После этого проводится зарядка до постоянного напряжения 14,4 вольта.
- Второй этап начинается с напряжения 14,4 вольта. Это значение является тем уровнем, на котором начинается разложение воды из электролита на кислород и водород. У аккумуляторов, выпускаемых по технологии Ca-Ca, это значение напряжения выше. Чтобы минимизировать выделение газов, сила тока снижается в два раза. То есть если на первом этапе она была 5 ампер, то здесь нужно уменьшить до 2,5 А.
- Третий этап стартует с напряжения 15 вольт. Сила тока уменьшается два раза по сравнению со вторым этапом. Далее через определённые промежутки времени (1─2 часа) проверяется напряжение на терминалах. Как только оно перестаёт меняться, так можно считать процесс оконченным. На последнем этапе будет идти активное выделение газов. По этой причине аккумуляторная батарея должна находиться в хорошо проветриваемом помещении, а рядом не должно быть искр и открытого пламени.
Выше был упомянут метод ускоренной зарядки аккумуляторной батареи. Подобный режим есть во многих зарядных устройствах. Он отличается лишь тем, что на аккумулятор подаётся увеличенный до 30% (по сравнению со штатным значением 0,1*С) ток. Это используется в тех случаях, когда аккумулятору нужно быстро отдать заряд, который необходим для запуска двигателя. Увеличенная сила тока при зарядке отрицательно сказывается на состоянии электродов и активной массы. Поэтому без необходимости этот режим лучше не использовать.
Щелочные аккумуляторные батареи
Щелочные аккумуляторы используются в качестве тяговых. Их можно встретить в различной складской технике, железнодорожном транспорте, электроинструменте и других сферах применения, где они работают в режиме циклирования.
Происходящие процессы
Наиболее распространёнными электрохимическими системами щелочных аккумуляторов являются никель─кадмиевые и никель─металлогидридные. Рассмотрим процесс заряда на их примере. Оба типа батарей имеют положительный электрод с активной массой из гидроокиси никеля (NiOOH). В ней присутствует графит и окись бария. Окись бария продлевает срок службы АКБ, а графит увеличивает электропроводность активной массы.
Активная масса на отрицательном электроде в никель─кадмиевых аккумуляторах представляет собой смесь порошков кадмия (Cd) и железа (Fe). У никель─металлогидридных аккумуляторов активная масса на минусовом электроде является смесью порошков железа и его окислов. В неё добавляют сернокислый никель (NiSO4) и сернистое железо (FeS).
Ниже представлены реакции, происходящие в щелочном аккумуляторе при заряде.
2Ni(OH)2 + 2KOH + Fe(OH)2 -> 2Ni(OOH) + 2KOH + Fe
2Ni(OH)2 + 2KOH + Cd(OH)2 -> 2Ni(OOH) + 2KOH + Cd
В процессе разряда активная масса на положительном электроде окисляется и 2Ni(OH)2 превращается в гидроокись никеля. Одновременно с этим в активной массе отрицательного электрода происходит восстановление, в результате которого образуется железо и кадмий.
Режимы заряда
Если рассматривать заряд стандартного аккумуляторного элемента Ni-Cd, то рекомендуемый ток составляет 10─20% от номинальной ёмкости. Во время зарядки может доходить до 16 часов. Допустимый диапазон температур для зарядки щелочных аккумуляторов составляет от 0 до 50 по Цельсию. Наиболее эффективно процесс заряда происходит в диапазоне температур от 10 до 40 градусов Цельсия.
На практике конструкция щелочных аккумуляторов позволяет заряжать их током не менее 30% от номинальной ёмкости. Процесс заряда в этом случае занимает несколько часов. При заряде щелочных аккумуляторов есть один важный момент. Особенно это актуально для никель─кадмиевых батарей. Они имеют такую проблему, как «эффект памяти». Поэтому перед зарядом эти АКБ требуется разрядить. Подобным функционалом располагают многие зарядные устройства, предназначенные для работы со щелочными аккумуляторами.
Поэтому процесс зарядки щелочного аккумулятора чаще всего начинается с его разряда. При этом не должно допускаться снижение напряжения на выводах элемента ниже 1 вольта. После разряда запускается процесс заряда.
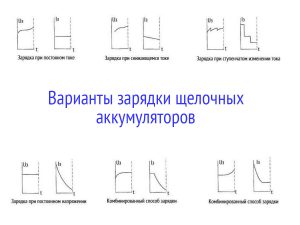
Различных схем заряда для щелочных батарей значительно больше, чем для свинцово-кислотных. Некоторые из них приведены на изображении ниже.
В процессе заряда напряжение на выводах щелочного аккумулятора постепенно увеличивается до 1,6─1,75 вольта. На заключительном этапе напряжение может подниматься до 1,8 вольта. В случае с герметичными щелочными АКБ бывает так, что окончание заряда определяется переданными ампер-часами. Чтобы зарядить батарею целиком иногда расходуется количество энергии, соответствующее 150 процентам от номинальной ёмкости. Напряжение полностью заряженного щелочного аккумулятора в разомкнутой цепи составляет 1,45 вольта.
Вернуться к содержанию
Литиевые
Процесс заряда будет рассмотрен на примере литий─ионных аккумуляторных батарей. В последнее время они получили широкое распространение в качестве источников питания для бытовой техники, потребительской электроники, электроинструмента, электромобилей, электровелосипедов, скутеров и т. п. По сравнению с вышеописанными свинцово-кислотными и щелочными АКБ литий─ионные модели имеют более высокую энергоёмкость.
Происходящие процессы
В литиевый электрохимической системе сейчас используются различные химические соединения и периодически разрабатываются новые. Мы рассмотрим реакции, происходящие при заряде в большинстве распространённых коммерческих Li─Ion батареях.
Отрицательный электрод выполняется из материала, содержащего углерод. Благодаря его природе и составу электролита происходит процесс интеркаляции ионов лития в углерод. Углеродная матрица обладает слоистой структурой, которая может быть упорядоченной или частично упорядоченной. Это уже зависит от конкретного углеродосодержащего материала.
Материалы, используемые для производства положительного электрода, могут отличаться для различных разновидностей литиевых батарей. Чаще всего для этих целей используются литированные оксиды кобальта или никеля. Используются также литий─марганцевые шпинели.
При заряде литий─ионного аккумулятора на электродах протекают следующие реакции.
C + xLi + + xe — -> CLix
В процессе интеркаляция ионы лития из электролита внедряются между слоями углерода. При этом объём углеродной матрицы меняется незначительно. Этими качествами был обусловлен выбор углерода в качестве материала анода. Помимо материала, содержащего углерод, в отрицательном электроде могут быть такие добавки, как олово, серебро и их сплавы. В некоторых моделях встречаются композитные материалы.
Режимы заряда
Процесс заряда литий─ионных аккумуляторов комбинированный и проходит в два этапа. На первой стадии ведётся зарядка током, величина которого составляет от 20 до 100% от номинальной емкости батареи. Этот этап продолжается до того, пока напряжение АКБ не достигнет 4,1 вольта. После этого начинается второй этап, во время которого заряд ведётся при постоянном напряжении. По времени вся зарядка продолжается около 3 часов (при максимально допустимом токе), из которых на первый этап отводится один час. Более подробно о процессе заряда литиевых аккумуляторов можно прочитать в этой статье.
Окончание заряда фиксируется в тот момент, когда напряжение достигло максимального (4,1─4,2 В), а ток уменьшился до 3% от своей величины в начале процесса. В некоторых случаях возможен третий этап, который представляет собой хранение. Этот этап представляет собой периодическую подзарядку для компенсации ёмкости, потерянной в результате саморазряда.
Если увеличивать ток заряда выше 0,2─1*С, это не приводит к уменьшению времени процесса. В этом случае просто сокращается первый и увеличивается второй этап.
Бывают зарядные устройства, которые обеспечивают только первый этап зарядки. При таком варианте степень заряженности батареи составляет около 70─80%.
Вернуться к содержанию
Видео:Щелочной аккумулятор. Часть-4. Заливка и первый цикл заряд-разрядСкачать

Please wait.
Видео:КАК УСТРОЕН АККУМУЛЯТОР АКБСкачать
We are checking your browser. gomolog.ru
Видео:Зарядка щелочных аккумуляторов НК-125 сварочным инвертором.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Заряд щелочного аккумулятора малым током (теория)Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e21ac261f301fe6 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Как заряжать и разряжать AGM свинцовые аккумуляторыСкачать

Химические процессы протекающие на электродах при зарядке и разрядке аккумулятора. Концентрация ионов на электродах
Видео:Стираем память, обслуживаем и заряжаем щелочной аккумулятор НК 125.Скачать

Решение задач по химии на составление схемы аккумулятора
Задание 256.
Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (+2) (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn 2+ ] = 0,00 1 моль/л? Ответ: 7,3 моль/л.
Решение:
Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn 0 — 2 
Железо, потенциал которого (-0,440 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Fe 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
ЭДС гальванического элемента равна нулю, если электродные потенциалы электродов равны, следовательно, электродный потенциал железа численно равен электродному потенциалу цинка, т.е. равен -0,8515 В. Рассчитаем концентрацию ионов железа Fe 2+ , если электродный потенциал железного электрода равен -0,8515 В, получим:
Ответ: сFe 2+ = 1,124 . 10 -14 моль/л.
Задание 257.
Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Рb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Pb 2+ ] = 0,0001 моль/л, [Ni] = 0,01 моль/л. Ответ: 0,064 В.
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции вытекает, что никель является анодом, на котором протекает окислительный процесс:
Ni 0 — 2 
Свинец – катод, электрод на котором протекает восстановительный процесс:
Pb 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Ответ: 0,064 В.
Задание 258.
Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Решение:
В свинцовом аккумуляторе в качестве электролита используется раствор H2SO4 (p = 1,24-130 г/см 3 ). Электроды этого аккумулятора представляют свинцовые решётки. Решётки сначала заполняются оксидом свинца (IV) PbO2, который при взаимодействии с H2SO4 превращается в PbSO4. Сначала аккумулятор нужно зарядить. Суммарная реакция зарядки в аккумуляторе имеет вид:
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 2H2SO4 (молекулярная форма);
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 4H + + 2SO4 2- (ионно-молекулярная форма)
Электрохимические процессы при зарядке:
Анод: PbSO4 + 2H2O — 2 
Катод: PbSO4 + 2 
При разрядке свинцового аккумулятора протекает следующая химическая реакция:
Электрохимические процессы при разрядке аккумулятора:
Анод: Pb 2+ + SO4 2- — 2 
Катод: PbO2 + 4H + + SO4 2- + 2 
При разрядке аккумулятора:
К(+): PbO2 + 4H + + 2 
А(-): Pb 0 → Pb 2+ + 2
При зарядке аккумулятора:
К(+): Pb 2+ + 2 
А(-): Pb2+ + 2H2O → PbO2+4H + + 2
Задание 259.
Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А(+): Ni(OH)2 + OH — → NiOOH + H2O + 1 
К(-): Cd(OH)2 + 2 
При разрядке аккумулятора:
К(+): NiOOH + H2O + 1 
А(-): Cd + 2OH — → Cd(OH)2 + 2 
Задание 260.
Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А: Ni 2+ → Ni 3+ + 1 
К: Fe 2+ + 2 
При разрядке аккумулятора:
А: Fe 0 → Fe 2+ + 2 
К: Ni 3+ + 1 
📸 Видео
Кислотная аккумуляторная батарея. Устройство, принцип работы и методы диагностикиСкачать
Щелочной аккумулятор.Скачать

Щелочной аккумулятор. опыт эксплуатации.Скачать

Применение щелочных АКБ в альтернативной энергетикеСкачать

Гальванические элементы. 1 часть. 10 класс.Скачать

Альтернатива, щелочные аккумуляторы, приготовление щёлочи .Скачать

Щелочные аккумуляторы. Реанимация. Часть-2Скачать

Аккумулятор сел в ноль? Не заряжается? Не вздумайте выбрасывать!Скачать

Зарядное устройство и щелочной аккумуляторСкачать

Химия | Аккумуляторы: на пути к энергетической автономностиСкачать

5.2. Никель кадмиевые, никель железные и никель металлгидридные аккумуляторыСкачать

Щелочные АКБ имеют низкую эффективность и свои минусы о которых не говорятСкачать

Щелочной аккумулятор 🔋Скачать