8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микр о- , а макрогальванопара , и коррозия называется контактной (см. детальную классификацию видов коррозии). Сочетания металлов, сильно отличающихся значениями электродных потенциалов *, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере Имеется в виду атмосфера с примесью газообразного HCl. . В этом случае железо будет анодом ( E ° = –0,44В), а медь – катодом ( E ° =+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризац ии ио нами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Коррозия металла в результате неравномерного доступа кислорода . Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.2).
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Видео:Опыт 1. Электрохимическая коррозия в кислой средеСкачать

Электрохимическая коррозия металлов
Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды.
В реальных условиях коррозии обычно подвергаются технические металлы, содержащие примеси других металлов и неметаллических веществ.
Механизм электрохимической коррозии в таких металлах аналогичен механизму процессов, протекающих в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идет процесс окисления (разрушение металлов), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды).
Наиболее часто встречаются окислители (деполяризаторы):
· ионы водорода (коррозия с водородной деполяризацией)
2Н + + 2 ē = Н 2 (в кислой среде),
2Н2О + 2 ē = Н2 + 2ОН — (в нейтральной и щелочной средах);
O2 + 4 ē + 4Н + = 2Н2О (в кислой среде);
О2 +4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах).
Методика рассмотрения работы гальванопары при электрохимической коррозии.
· Составляют схему гальванопары:
· Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (табл.П.7), определяют восстановитель (меньший потенциал), окислитель (больший потенциал).
· Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при гальванокоррозии.
· Указывают направление движения электронов.
Пример 1.Гальванопара алюминий —железо в воде (среда нейтральная). В воде растворен кислород.
· Схема гальванопары Al / H2O, O2 / Fe
· Потенциалы 


Восстановитель – Al, окислитель — О2.


· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н + ), если нарушена сплошность покрытия.
· Потенциалы: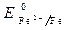


Восстановитель – железо, окислитель – кислород.


2Fe + О2 + 4Н + = 2Fe 2+ + 2Н2О
При нарушении целостности покрытия будет разрушаться Fe.
· Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
· Схема гальванопары: Al / КОН/ Fe
· Потенциалы: 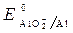


· 
Fe(+): 3 2 H2O + 2 ē = 2 OH — + H2 – процесс восстановления
2 Al + 2 OH — + 2H2O = 2 AlO2 — + 3 H2
· Направление перемещения электронов в системе:


Задание к подразделу 4.4
Рассмотрите коррозию гальванопары, используя потенциалы (табл. П.7), укажите анод и катод соответствующей гальванопары в различной коррозионной среде, рассчитайте ЭДС, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе.
| Номер задания | Коррозионная среда | ||
| а) H2O + O2 | б) NaOH + H2O | в) H2O + Н + | |
| 321. | Fe / Zn | Zn / Al | Pb / Zn |
| 322. | Fe / Ni | Fe / Zn | Al / Cu |
| 323. | Pb / Fe | Cd / Cr | Al / Ni |
| 324. | Cu / Zn | Al / Cu | Sn / Cu |
| 325. | Zn / Fe | Fe / Cr | Co / Al |
| 326. | Zn / Al | Pb / Zn | Cr / Ni |
| 327. | Cr / Cu | Pb / Cr | Bi / Ni |
| 328. | Cu / Al | Cr / Zn | Fe / Mg |
| 329. | Zn / Sn | Mg / Cd | Cr / Bi |
| 330. | Co / Mg | Zn / Fe | Pb / Al |
| 331. | Pb / Zn | Bi / Ni | Cd / Al |
| 332. | Bi / Ni | Cu / Zn | Fe / Ni |
| 333. | Fe / Mg | Fe / Cu | Co / Cd |
| 334. | Sn / Fe | Pb / Zn | Cr / Fe |
| 335. | Cr / Fe | Fe / Mg | Co / Cu |
| 336. | Fe / Cr | Cr / Cu | Cr / Cu |
| 337. | Fe / Cu | Cd/ Zn | Cd/ Zn |
| 338. | Zn / Cu | Cr / Ni | Cr / Cd |
| 339. | Mg / Cu | Cr / Cd | Zn / Al |
| 340. | Sn / Cu | Bi / Ni | Bi / Ni |
Электролиз растворов
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и электролита.
Электрод, на котором происходит восстановление, называется катодом, он заряжен отрицательно. Электрод, на котором происходит окисление, называется анодом, он заряжен положительно.
При электролизе водных растворов могут протекать процессы, связанные с электролизом воды, т.е. растворителя.
Катодные процессы
На катоде возможно восстановление:
· катионов металла Ме n+ + nē = Me;
· катиона водорода (свободного или в составе молекул воды):
2H + + 2ē = H 2 ( в кислой среде) ;
2H2O + 2 ē =H 2+ 2 OH — ( в нейтральной и щелочной средах).
Для выбора приоритетного процесса следует сравнить стандартные электродные потенциалы металла и водорода (табл. П.6, П.7). Потенциал восстановления катионов водорода необходимо использовать с учетом перенапряжения, 
1. Активные металлы (Li — Al) из-за низкой окислительной способности их ионов на катоде не осаждаются, вместо них идет восстановление ионов водорода.
2. Металлы средней активности (Mn, Zn, Fe, Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. Малоактивные металлы (стоящие в ряду напряжений после водорода) из-за высокой окислительной способности их ионов осаждаются на катоде без выделения водорода.
Анодные процессы
На аноде возможны процессы окисления:
· материала анода Ме — nē = Me n +
Анионы кислородосодержащих кислот, имеющие в своем составе атом
элемента в высшей степени окисления (SO4 2 — , NO3 — и др.), при электролизе водных растворов на аноде не разряжаются.
С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:


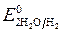
Так как


происходит восстановление воды: 2H2O — 4ē = O2 + 4 H +
среда щелочная среда кислая
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами:
SnCl 2 = Sn 2+ + 2Cl —





Так как


ионов олова: Sn 2+ + 2 ē = S n 2Cl — — 2 ē = Cl 2
Пример 3. Электролиз сульфата меди с медным анодом:

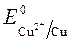



Так как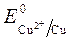

происходит восстановление Так как 
ионов меди:Cu 2+ +2ē = Cu анод растворяется: Cu — 2ē = Cu 2+
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем (1834).
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:

где m — масса образовавшегося вещества , г;
М — молярная масса вещества, г/ моль;
n — количество электронов, участвующих в электродном процессе;
t — время электролиза, с;
F — константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формулу использют в виде 
где V— объем газа, выделяющегося на электроде; V 0 — объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4А.
Решение.


Задание к подразделу 4.5
Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ. Процессы на электродах обоснуйте значениями потенциалов (табл. П.6,7,8). Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами либо растворимым анодом. Рассчитайте массу или объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А.
Видео:Электрохимическая коррозия в кислой средеСкачать

Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
По таблице 11.1 находим значение стандартных электродных потенциалов железа и цинка:


Так как 
 |
2Zn + 2H2O + O2 = 2Zn(OH)2 – суммарное молекулярное уравнение процесса коррозии.
б) Коррозия в кислой среде (H2SO4)
Составляем схему коррозионного ГЭ:
А (-) Zn │ H + │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:


На К(+) 2H + + 2ē = H2 1
 |
Zn + 2H + = Zn 2+ + H2 — суммарное ионно-молекулярное уравнение процесса коррозии;
Zn + H2SO4 = ZnSO4 + H2 – суммарное молекулярное уравнение процесса коррозии.
в) Коррозия в кислой среде в присутствии кислорода (HCl+O2).
Составляем схему коррозионного ГЭ:
А (-) Zn │ HCl + O2 │ Fe (+) K
А (-) Zn │ H + + O2 │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:


На A (-) Zn – 2ē = Zn 2+ 2

2Zn + 4H + + O2 = 2Zn 2+ + 2H2O – суммарное ионно-молекулярное уравнение процесса коррозии
2Zn + 4HCl + O2 = 2ZnCl2 + 2H2O – суммарное молекулярное уравнение процесса коррозии.
Во всех случаях коррозионному разрушению будет подвергаться более активный металл – цинк.
УРОВЕНЬ В
1. Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка, и хромовым электродом, погруженным в 1·10 -3 М раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.

| РЕШЕНИЕ: Для составления схемы ГЭ необхо-димо знать величины электродных потенциалов металлов – цинка и хрома. По таблице 11.1 определяем стан-дартные электродные потенциалы металлов: |
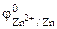
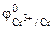
Хлорид цинка диссоциирует по уравнению:

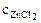

α = 1 (ZnCl2 – сильный электролит), 

Хлорид хрома (III) диссоциирует по уравнению:
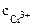
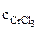
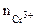
α = 1 (CrCl3 – сильный электролит), 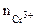
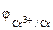
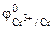
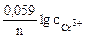

Так как 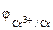
Составляем уравнения электродных процессов и суммарной токообразующей реакции:


На A(-)Cr – 3ē = Cr 3+ 2
На К(+)Zn 2+ + 2ē = Zn 3
2Cr + 3Zn 2+ = 2Cr 3+ + 3Zn — суммарное ионно-молекулярное уравнение токообразующей реакции
2Cr + 3ZnCl2 = 2CrCl3 + 3Zn — суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем напряжение ГЭ:
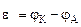


2. Составить схему ГЭ, в котором протекает химическая реакция Fe + Ni 2+ = Fe 2+ + Ni. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов ∆fG 0 (298К, Me n + ) рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
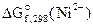

Дано: 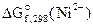 = -64,4 кДж/моль = -64,4 кДж/моль  = -84,94 кДж/моль Т = 298 К = -84,94 кДж/моль Т = 298 К  ε 0 — ? Кс — ? ε 0 — ? Кс — ? | РЕШЕНИЕ: На основании реакции, приведенной в условии задачи, составляем уравнения электродных процессов: |


На К(+)Ni 2+ + 2ē = Ni 1 — восстановление
Анодом ГЭ является электрод, на котором происходит процесс окисления. Катодом – электрод, на котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом – никель.
Составляем схему ГЭ:
А(-) Fe │ Fe 2+ ║ Ni 2+ │ Ni(+)K
Рассчитываем стандартное напряжение ГЭ:
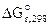
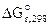

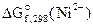
= -84,94-(-64,4) = -20,54 кДж,
ε 0 =
z = 2, F = 96500 Кл/моль.
Рассчитываем константу равновесия токообразующей реакции (Кc).
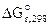
lgKс =
Ответ: ε 0 = 0,106В, Kс = 3981.
3. Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 см 2 с никелевой в растворе соляной кислоты HCl. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 см 3 газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 3,7∙10 -3 г. Плотность железа равна 7,9 г/см3 .
По таблице 11.1 находим значения стандартных электродных потенциалов железа и никеля:

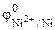
Так как 
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A Fe – 2ē = Fe 2+

Fe + 2H + = Fe 2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии.
Fe + 2HCl = FeCl2 + H2 – суммарное молекулярное уравнение процесса коррозии.

| Рассчитываем объемный показатель коррозии KV по формуле: KV =  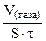 , см 3 /м 2 ∙час. При расчете KV принимаем: S – [м 2 ], τ — [час], V(газа) – [см 3 ]. , см 3 /м 2 ∙час. При расчете KV принимаем: S – [м 2 ], τ — [час], V(газа) – [см 3 ]. |
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород.
Следовательно, V(газа) = 
Тогда, KV = 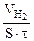
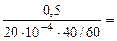
10 -4 – коэффициент пересчета, см 2 в м 2 .
Рассчитываем весовой показатель коррозии Km по формуле:
Km = 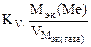
В процессе коррозии разрушению подвергается железо и выделяется водород.
Мэк(Ме) = Мэк(Fe) = 
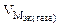

Km = 
Ответ: KV = 375 см 3 /м 2 ∙час, Km = 0,94 г/м 2 ∙час.

| Рассчитываем весовой показатель коррозии Km по формуле: Km =  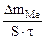 , г/м 2 ∙час. Коррозии подвергается железо. Тогда потеря массы металла , г/м 2 ∙час. Коррозии подвергается железо. Тогда потеря массы металла  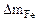 . . |
При расчете Km принимаем: 
Тогда: Km = 


Рассчитываем глубинный показатель коррозии по формуле:
П = 

Ответ: Km = 0,925 г/м 2 ∙час, П = 1,03 мм/год.
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Таблица 11.1. Процессы протекающие на катоде при электролизе водных растворов
 В В | Катио-ны в вод- ном рас- творе | Зоны | Процессы на катоде |
| -3,02 -2,99 -2,93 -2,92 -2,90 -2,89 -2,87 -2,71 -2,34 -1,67 | Li + , Rb + , Cs + K + , Ba 2+ , Sr 2+ , Ca 2+ , Na + , Mg 2+ , Al 3+ | I | Катионы этих металлов на катоде не восстанавли-ваются, а концентри-руются в околокатодном пространстве (католите). На катоде восстанавливаются только молекулы воды: 2Н2О + 2ē = 2ОН — + Н2 |
| -1,05 -0,76 -0,74 -0,44 -0,40 -0,28 -0,26 -0,14 -0,13 | Mn 2+ , Zn 2+ , Cr 3+ , Fe 2+ , Cd 2+ , Co 2+ , Ni 2+ , Sn 2+ , Pb 2+ | II | 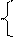 На катоде параллельно протекают два процесса: Ме n + + nē = Me 2Н2О + 2ē = 2ОН — + Н2 На катоде параллельно протекают два процесса: Ме n + + nē = Me 2Н2О + 2ē = 2ОН — + Н2 |
| 0,00 | Н + | При электролизе кислоты 2Н + + 2ē = Н2 | |
| +0,20 +0,23 +0,34 +0,80 +0,83 +0,85 +1,20 | Sb 3+ , Bi 3+ , Cu 2+ , Ag + , Pd 2+ , Hg 2+ , Pt 2+ | III | Восстанавливаются только ионы этих металлов Ме n + + nē = Me |
Таблица 11.2. Последовательность окисления анионов на инертном аноде в водном растворе.
| Очередность окисления анионов | Процессы окисления на аноде. |
| 1. | Окисляются анионы бескислородных кислот (Cl — , Br — , J — , S 2- , и др.) Например: 2Cl — -2ē = Cl2 |
| 2. | Окисляются ОН — ионы 4ОН — -4ē = О2 + 2Н2О |
Если в водном растворе присутствуют анионы кислородсодержащих кислот (  , ,  , , 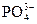 , и др.), то они на аноде не окисляются, а концентрируются в околоанодном пространстве (анолите). На аноде окиcляются только молекулы воды. 2H2O — 4е = О2+4H + , и др.), то они на аноде не окисляются, а концентрируются в околоанодном пространстве (анолите). На аноде окиcляются только молекулы воды. 2H2O — 4е = О2+4H + |
Примечание. Если анод изготовлен из металлов II или III зоны (растворимый анод), то при электролизе протекает только процесс его растворения Мe 0 – nē = Me n +
УРОВЕНЬ А
1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов (анод инертный): а) хлорида меди (II), б) гидроксида натрия.
Какие продукты выделяются на катоде и аноде?
| РЕШЕНИЕ а) CuCl2 = Cu 2+ + 2Cl — , Схему электролиза составляем в соответствии с таблицами 11.1 и 11.2: K(-) A(+) инертный Cu 2+ + 2ē = Cu 2Cl — — 2ē = Cl2 H2O H2O |
На катоде выделяется Cu, на аноде выделяется Cl2.
б) NaОН = Na + + ОН —
Na + 4ОН 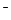
На катоде выделяется Н2, на аноде выделяется О2.
2.Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II) , если: а) анод инертный, б) анод никелевый. Какие продукты выделяются на катоде и аноде?

| РЕШЕНИЕ а) анод – инертный NiSO4 = Ni 2+ +  Схему электролиза составляем в соответствии с таблицами 11.1. и 11.2: Схему электролиза составляем в соответствии с таблицами 11.1. и 11.2: |
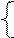
На катоде выделяется Ni и H2 , на аноде выделяется О2.
б) анод – никелевый:
NiSO4 = Ni 2+ +
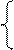

2H2O+2ē = H2+2OH — Ni — 2ē = Ni 2+
На катоде выделяется Ni и H2, на аноде растворяется Ni.
3.При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить какое вещество и в каком количестве выделилось на катоде? Анод инертный.
|
 | РЕШЕНИЕ а) Ca(NO3)2 = Ca 2+ + 2  Схема электролиза: K(-) A(+) инертный Ca 2+ Схема электролиза: K(-) A(+) инертный Ca 2+  2H2O+2ē=H2+2OH — 2H2O — 4ē = О2+4H + На катоде выделяется Н2, на аноде выделяется О2 По закону эквивалентов: nэк (В1)(анод) = nэк (В2)(катод) 2H2O+2ē=H2+2OH — 2H2O — 4ē = О2+4H + На катоде выделяется Н2, на аноде выделяется О2 По закону эквивалентов: nэк (В1)(анод) = nэк (В2)(катод) |
В соответствии со схемой электролиза:
nэк (О2)(анод) = nэк (Н2)(катод) или 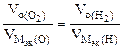


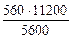
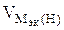
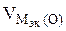
На катоде выделилось 1120 см 3 водорода.
Ответ: 1120 см 3 водорода.
б) AgNO3 = Ag + +
Ag + + ē = Ag
На катоде выделяется Ag, на аноде выделяется О2.
По закону эквивалентов: nэк(Ag)(катод) = nэк(О2)(анод) или 
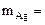


где
На катоде выделилось 10,8 г серебра.
Ответ: 10,8 г серебра.
УРОВЕНЬ В
Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный). Определить какие вещества и в каком количестве выделяются на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2А. Температура 298К, давление 99 кПа.
Дано: Электролит: K2SO4 τ = 4 ч Т = 298 К I = 2 A Р = 99 кПа Анод инертный  1. Схема электролиза-? 2. 1. Схема электролиза-? 2.  (катод) — ? 3. (катод) — ? 3.  (анод) — ? (анод) — ? | РЕШЕНИЕ K2SO4 = 2K + + 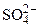 Схема электролиза: K(-) A(+) (инертный) K + Схема электролиза: K(-) A(+) (инертный) K +  2H2O + 2ē = 2H2O — 4ē = = H2 + 2OH — = О2 + 4H + На катоде выделяется H2, на аноде выделяется О2 По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.): 2H2O + 2ē = 2H2O — 4ē = = H2 + 2OH — = О2 + 4H + На катоде выделяется H2, на аноде выделяется О2 По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.): |


где 
F = 96500 Кл/моль, если τ – cек,
F = 26,8 А∙ч/моль, если τ – час.
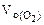

где 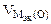

Объем водорода при заданных условиях отличных от нормальных определяем из уравнения:

откуда: 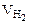

Объем кислорода при заданных условиях:

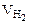
Ответ: 3,73 л водорода, 1,865 л кислорода.
2.Металлическую деталь, площадь поверхности которой равна 100 см 2 , необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). Составить схему электролиза и написать уравнения электродных процессов, если анод медный. Сколько времени должно длиться осаждение при силе тока 8А и выходе по току 98%, если толщина покрытия 0,15 мм. Плотность меди – 8,9 г/см 3 .
  Дано: Электролит: CuCl2 S = 100 см 2 h = 0,15 мм I = 8 A BT = 98 % ρCu = 8,9 г/см 3 Дано: Электролит: CuCl2 S = 100 см 2 h = 0,15 мм I = 8 A BT = 98 % ρCu = 8,9 г/см 3  Анод медный Схема электролиза-? Анод медный Схема электролиза-?  Время электролиза, τ -? Время электролиза, τ -? |  РЕШЕНИЕ CuCl2 = Cu 2+ + 2Cl — Схема электролиза: K(-) A(+) (Cu) Cu 2+ + 2ē = Cu Cl — H2O H2O Cu – 2ē = Cu 2+ На катоде выделяется Cu, на аноде растворяется Cu. ВТ= РЕШЕНИЕ CuCl2 = Cu 2+ + 2Cl — Схема электролиза: K(-) A(+) (Cu) Cu 2+ + 2ē = Cu Cl — H2O H2O Cu – 2ē = Cu 2+ На катоде выделяется Cu, на аноде растворяется Cu. ВТ=  ; mCu(факт) = mCu(теор)·ВТ ; mCu(факт) = mCu(теор)·ВТ |
По закону Фарадея с учетом выхода по току (ВТ) масса меди, фактически выделившейся на катоде равна:
mCu(факт) = 
Масса меди, необходимая для получения медного покрытия:
mCu(факт) = S∙h∙ρ (г), где S – см 2 , h – см, ρ – г/см 3 .
S∙h∙ρCu = 
откуда
τ = 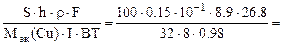
где Mэк(Cu) = 
10 -1 – коэффициент пересчета мм в см.
3.Определить молярную концентрацию эквивалента раствора нитрата серебра, если для выделения всего серебра из 75 см 3 этого раствора потребовалось пропустить ток силой 4А в течение 25 минут. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный. Выход по току серебра 100%.
   Дано: Электролит: AgNO3 I = 4 A Дано: Электролит: AgNO3 I = 4 A  = 75 см 3 τ = 25 мин Анод инертный = 75 см 3 τ = 25 мин Анод инертный  Схема электролиза-? Схема электролиза-?  — ? — ? | РЕШЕНИЕ AgNO3 = Ag + +  Схема электролиза: K(-) A(+) инертный Ag + + ē= Ag Схема электролиза: K(-) A(+) инертный Ag + + ē= Ag  H2O 2H2O — 4ē = О2 + 4H + На катоде выделяется Ag, на аноде выделяется О2. H2O 2H2O — 4ē = О2 + 4H + На катоде выделяется Ag, на аноде выделяется О2. |
Молярная концентрация эквивалента раствора AgNO3:

nэк(Ag) = 
где mAg – масса серебра, выделившегося при электролизе с учетом 100 % выхода по току.
mAg = 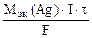

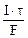
Молярная концентрация эквивалента раствора AgNO3:


где τ – c, F – 96500 Кл/моль, Vр-ра – л.
60 – коэффициент пересчета мин. в сек.
10 -3 – коэффициент пересчета см 3 в л.
Ответ: 
🎬 Видео
Электрохимическая коррозияСкачать

Коррозия металла. Химия – ПростоСкачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Электрохимическая коррозия (алюминий — медь)Скачать

Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Гидролиз солей. 9 класс.Скачать

Электролиз. 10 класс.Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Коррозия металловСкачать

Химическая коррозияСкачать

Ингибиторы коррозииСкачать

Гальванические элементы. 1 часть. 10 класс.Скачать

§13, 9 кл. Коррозия металловСкачать

Коррозия металлов и способы защиты от нееСкачать

Коррозия металла (часть 2). Химия – ПростоСкачать

Опыт: электрохимическая коррозияСкачать









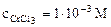 ε — ?
ε — ?


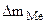 = 3,7·10 -3 г. S = 20 см 2 ρFe = 7,9 г/см 3 Km — ? П -?
= 3,7·10 -3 г. S = 20 см 2 ρFe = 7,9 г/см 3 Km — ? П -?
 = 560 см 3 Анод инертный 1. Схема электролиза-? 2.
= 560 см 3 Анод инертный 1. Схема электролиза-? 2.  -? 3.
-? 3.  -? 4.
-? 4.  -?
-?

