В настоящее время в достаточной степени изучен механизм биосинтеза жирных кислот в организме животных и человека, а также катализирующие этот процесс ферментные системы. Синтез жирных кислот протекает в цитоплазме клетки. В митохондриях в основном происходит удлинение существующих цепей жирных кислот. Установлено, что в цитоплазме печеночных клеток синтезируется пальмитиновая кислота (16 углеродных атомов), а в митохондриях этих клеток из уже синтезированной в цитоплазме клетки пальмитиновой кислоты или из жирных кислот экзогенного происхождения, т.е. поступающих из кишечника, образуются жирные кислоты, содержащие 18, 20 и 22 углеродных атома.
Иными словами, митохондриальная система биосинтеза жирных кислот, включающая несколько модифицированную последовательность реакций β-окисления, осуществляет только удлинение существующих в организме среднецепочечных жирных кислот, в то время как полный биосинтез пальмитиновой кислоты из ацетил-КоА активно протекает в цитозоле, т.е. вне митохондрий, по совершенно другому пути.
Внемитохондриальная система биосинтеза de novo жирных кислот (ли-погенез). Эта система находится в растворимой (цитозольной) фракции клеток многих органов, в частности печени, почек, мозга, легких, молочной железы, а также в жировой ткани. Биосинтез жирных кислот протекает с участием НАДФН, АТФ, Мn 2+ и НСО3 – (в качестве источника СО2); субстратом является ацетил-КоА, конечным продуктом – пальмитиновая кислота. Потребности в кофакторах процессов биосинтеза и β-окисления жирных кислот значительно различаются.
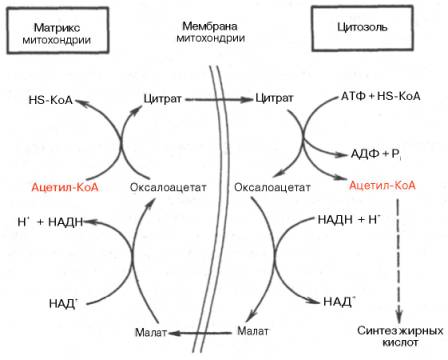
Как отмечалось, строительным блоком для синтеза жирных кислот в цитозоле клетки служит ацетил-КоА, который в основном поступает из митохондрий. Было выявлено, что цитрат стимулирует синтез жирных кислот в цитозоле клетки. Известно также, что образующийся в митохондриях в процессе окислительного декарбоксилирования пирувата и окисления жирных кислот ацетил-КоА не может диффундировать в цитозоль клетки, так как митохондриальная мембрана непроницаема для данного субстрата. Поэтому вначале внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль при помощи специальной трикарбоксилаттранспортирующей системы.
В цитозоле цитрат реагирует с HS-KoA и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат. Эта реакция катализируется АТФ-цитратлиазой. Уже в цитозоле оксалоацетат при участии цитозольной малатдегидрогеназы восстанавливается до малата. Последний при помощи дикарбокси-латтранспортирующей системы возвращается в митохондриальный матрикс, где окисляется до оксалоацетата, завершая тем самым так называемый челночный цикл:
Существует еще один путь переноса внутримитохондриального аце-тил-КоА в цитозоль клетки – с участием карнитина. Как отмечалось, кар-нитин играет роль переносчика ацильных групп из цитозоля в митохондрии при окислении жирных кислот. По-видимому, он может выполнять эту роль и в обратном процессе, т.е. в переносе ацильных радикалов, в том числе ацетильного радикала, из митохондрий в цитозоль клетки. Однако, когда речь идет о синтезе жирных кислот, данный путь переноса ацетил-КоА не является главным.
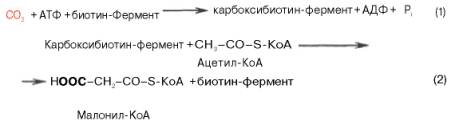
Образование малонил-КоА. Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуются бикарбонат, АТФ, ионы марганца. Катализирует эту реакцию фермент ацетил-КоА-карбоксилаза. Фермент содержит в качестве простетической группы биотин. Авидин – ингибитор биотина угнетает эту реакцию, как и синтез жирных кислот в целом.
Установлено, что ацетил-КоА-карбоксилаза состоит из переменного числа одинаковых субъединиц, каждая из которых содержит биотин, биотинкарбоксилазу, карбоксибиотинпереносящий белок, транскарбоксилазу, а также регуляторный ал-лостерический центр, т.е. представляет собой полиферментный комплекс.
Реакция протекает в два этапа: I – карбоксилирование биотина с участием АТФ и II – перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА:
Малонил-КоА представляет собой первый специфический продукт биосинтеза жирных кислот. В присутствии соответствующей ферментной системы малонил-КоА быстро превращается в жирные кислоты.
Энзиматические системы, осуществляющие синтез жирных кислот, называются жирно-кислотными синтетазами. Они широко встречаются в природе и могут быть изолированы из различных одноклеточных организмов, растений и животных тканей.
Жирно-кислотные синтетазы делятся на 2 группы. К первой группе относятся полиэнзимные, не поддающиеся фракционированию комплексы с мол. м. порядка 500000, в которых все индивидуальные энзимы собраны в компактную структуру. В частности, в эту группу входят жирно-кислотные синтетазы животных тканей и дрожжей.
Вторая группа включает жирно-кислотные синтетазы, из которых отдельные энзимы могут быть выделены методами белкового фракционирования. Такие синтетазы встречаются у ряда микроорганизмов (в частности, у E.coli) и растений. Иными словами, в этих случаях все индивидуальные ферменты синтетазной системы находятся в виде автономных полипептидов.
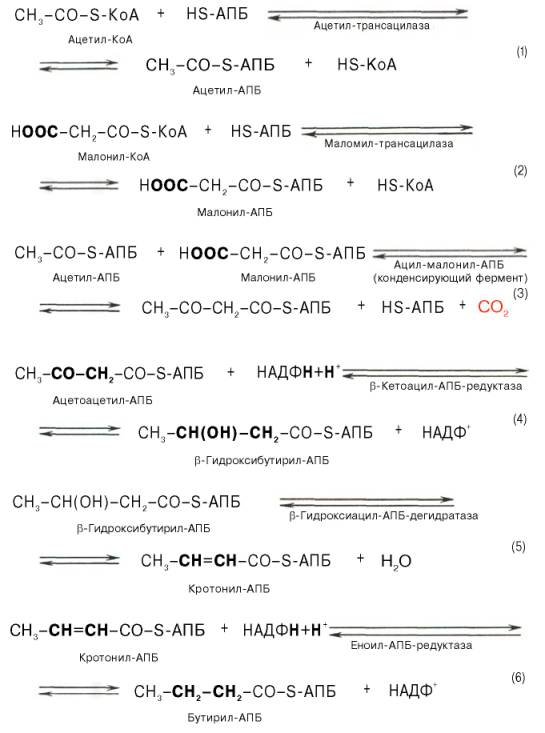
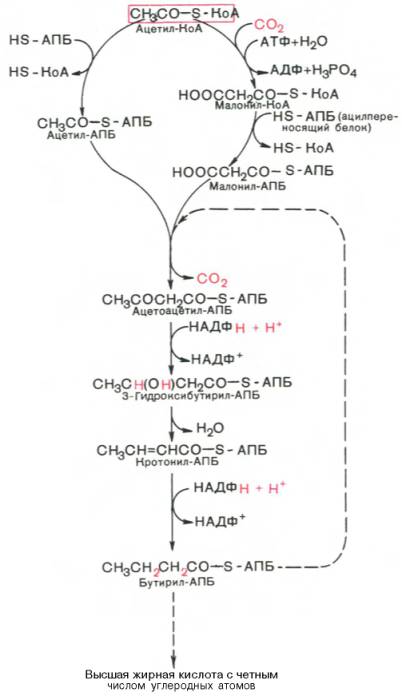
Мультиферментный комплекс, называемый синтетазой (синтазой) жирных кислот, состоит из 6 ферментов, связанных с так называемым ацилпереносящим белком (АПБ). Этот белок относительно термостабилен, имеет две свободные HS-группы (цистеина и фосфопантетеинового остатка, присоединенного к ОН-группе серина) и вовлекается в процесс синтеза высших жирных кислот практически на всех его этапах. Мол. масса АПБ составляет около 10000. Данный белок в синтетазной системе выполняет роль КоА. Заметим, что в животных тканях не удалось обнаружить свободного АПБ, подобного микробному. Из печени выделен полиэнзимный комплекс, содержащий все энзимы, необходимые для синтеза жирных кислот. Энзимы комплекса настолько прочно связаны друг с другом, что все попытки изолировать их в индивидуальном виде не увенчались успехом. Приводим последовательность реакций, происходящих при синтезе жирных кислот:
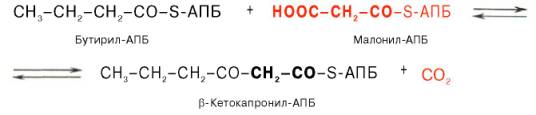
Далее цикл реакций повторяется. Допустим, что идет синтез пальмитиновой кислоты (С16). В этом случае образованием бутирил-АПБ завершается лишь первый из 7 циклов, в каждом из которых началом является присоединение молекулы малонил-АПБ к карбоксильному концу растущей цепи жирной кислоты. При этом отщепляется дистальная карбоксильная группа малонил-АПБ в виде СО2. Например, образовавшийся в первом цикле бутирил-АПБ взаимодействует с малонил-АПБ:
Завершается синтез жирной кислоты отщеплением HS-АПБ от ацил-АПБ под влиянием фермента деацилазы. Например:
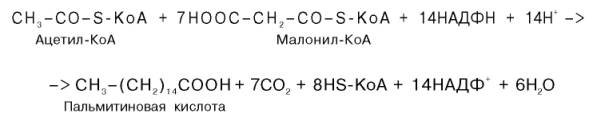
Суммарное уравнение синтеза пальмитиновой кислоты можно записать так:
Или, учитывая, что на образование одной молекулы малонил-КоА из ацетил-КоА расходуются одна молекула АТФ и одна молекула СО2, которая затем отщепляется, суммарное уравнение можно представить в следующем виде:
Основные этапы биосинтеза жирных кислот можно представить в виде схемы:
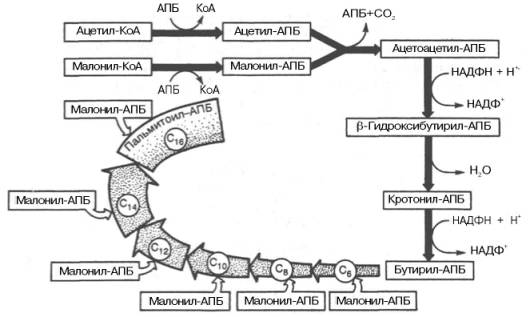
В общем виде синтез жирных кислот у кишечной палочки представлен на рис. 11.4. Последовательность и характер реакций в синтезе жирных кислот, начиная с образования β-кетоацил-АПБ (на рис. 11.4 – ацетоацетил-АПБ) и кончая завершением одного цикла удлинения цепи на два углеродных атома, являются как бы обратными реакциями окисления жирных кислот. На самом деле пути синтеза и окисления жирных кислот не пересекаются даже частично. Это становится очевидным, если принять во внимание некоторые особенности синтеза и окисления жирных кислот.
Рис. 11.4. Синтез пальмитиновой кислоты у кишечной палочки при участии одной молекулы ацетил-КоА и 7 молекул малонил-КоА. Подробно представлен первый цикл синтеза — образование бутирил-АПБ. Остальные 6 циклов аналогичны первому.
По сравнению с β-окислением биосинтез жирных кислот имеет ряд характерных особенностей: синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление – в митохондриях; участие в процессе биосинтеза жирных кислот малонил-КоА, который образуется путем связывания СО2 (в присутствии биотин-фермента и АТФ) с ацетил-КоА; на всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (HS-АПБ); при биосинтезе образуется D(–)-изомер 3-гидроксикис-лоты, а не L(+)-изомер, как это имеет место при β-окислении жирных кислот; необходимость для синтеза жирных кислот кофермента НАДФН. Последний в организме частично (на 50%) образуется в реакциях пен-тозофосфатного цикла, частично – в других реакциях, в частности в реакциях:
Малат + НАДФ + -> Пируват + С02 + НАДФН + Н + Изоцитрат + НАДФ + -> α-Кетоглутарат + С02 + НАДФН + Н + .
Образование ненасыщенных жирных кислот. Элонгация жирных кислот. В отличие от растительных тканей ткани животных обладают весьма ограниченной способностью превращать насыщенные жирные кислоты в ненасыщенные.
Установлено, что две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот.
Эти превращения протекают в микросомах клеток печени и жировой ткани при участии молекулярного кислорода, восстановленной системы пиридиновых нуклеотидов и цитохрома b5. Превращению подвергаются только активированные формы пальмитиновой и стеариновой кислот. Ферменты, участвующие в этих превращениях, получили название деса-тураз.
Наряду с десатурацией жирных кислот (образование двойных связей) в микросомах происходит и их удлинение (элонгация), причем оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН. Энзиматическая система, катализирующая удлинение жирных кислот, получила название элонгазы. На схеме представлены пути превращения пальмитиновой кислоты в реакциях десатурации и элонгации.
Видео:Биохимия | Бета-окисление жирных кислот: насыщенных, ненасыщенных, с нечетным количеством атомов ССкачать

Биосинтез жирных кислот и жиров
Исходным материалом для синтеза жирных кислот служит активный ацетат (CH3CO
S—КоА). Начальные этапы биосинтеза жирных кислот из ацетилкофермента А могут быть представлены следующими уравнениями: $$ce[ ацетил-КоА-синтетаза][]underset<large text> + АМФ + H4P2O7>;$$ $$ce[large ацетил-КоА-карбоксилаза][]>$$ $$ce underset<large text>АДФ + H3PO4>.$$
Происходит карбоксилирование ацетилкофермента А и образование трехуглеродного соединения — малонилкофермента А. В этой реакции участвует витамин Н (биотин), входящий в состав фермента ацетил-КоА-карбоксилазы. Синтез жирных кислот осуществляется путем связывания молекул ацетилкофермента А и малонилкофермента А с помощью «ацилпереносящего белка» (АПБ). В простетическую группу активного белка АПБ входит фосфопантотеновая кислота. С SH-группой пантотеновой кислоты образуются тиоэфиры АПБ и ацилов: $$ce<underset<large text> АПБ + underset<large text>S — АПБ ->>$$ $$ce CO2 + CH3COCH2COthicksim S — АПБ + HS — АПБ>$$
Таким образом, удлинение углеродной цепочки в результате конденсации происходит по схеме: $$ce C4 + C1>$$
Четырехуглеродное соединение восстанавливается при участии редуктазы, активной группой которой является НАДФН2. В дальнейшем оно реагирует с новой молекулой малонилкофермента А с образованием шестиуглеродного соединения: $$ce C6 + C1>;$$ $$ce C8 + C1>и, т.д.$$
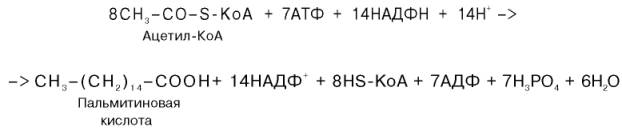
В результате число углеродных атомов в образующихся кислотах оказывается четным. Ниже приведено суммарное уравнение синтеза пальмитиновой кислоты (С15Н31СООН): $$ce>$$ $$ce C15H31COOH + 8HS — КоА + 14НАДФН + 7 АДФ + 7H3PO4 + 7H2O + 7CO2>.$$
У высших растений синтез жирных кислот происходит главным образом в митохондриях и хлоропластах. Основным путем новообразования триглицеридов являются, как и при синтезе углеводов, реакции переноса, в данном случае реакции трансацилирования. Ферменты ацетилтрансферазы переносят последовательно молекулы жирных кислот на молекулу фосфорилированного глицерина. Образуется фосфатидная кислота:
Под действием фосфатазы фосфатидная кислота гидролизуется с образованием диглицерида и Н3РО4. Диглицерид снова вступает во взаимодействие с ацетилкоферментом А, и образуется триглицерид. Энергия для этого синтеза поставляется молекулами ацетилкофермента А, имеющего макроэргическую связь. Биосинтез жира может быть представлен в виде следующей схемы:
Видео:Биохимия | Синтез жиров и фосфолипидовСкачать

Суммарное уравнение биосинтеза пальмитиновой кислоты
Установлено, что две наиболее распространенные мононасыщенные жирные кислоты — пальмитоолеиновая и олеиновая — синтезируются из пальмитиновой и стеариновой кислот. Двойная связь в молекулу указанных кислот вводится в микросомах клеток печени и жировой ткани при участии специфической оксигеназы и молекулярного кислорода. В этой реакции одна молекула кислорода используется в качестве акцептора двух пар электронов, одна пара из которых принадлежит субстрату (Ацил-КоА), а другая — НАДФН2:
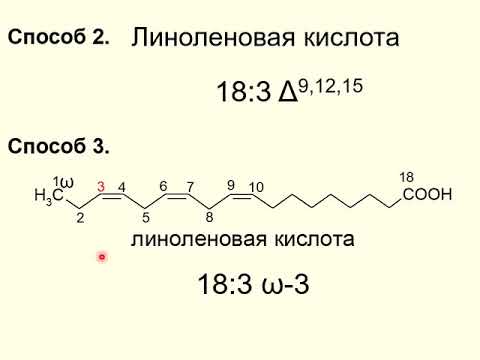
Вместе с тем ткани человека и ряда животных неспособны синтезировать линолевую и линоленовую кислоты, а должны получать их с пищей (синтез этих кислот осуществляется растениями). В связи с этим линолевую и линоленовую кислоты, содержащие соответственно две и три двойные связи, называют незаменимыми жирными кислотами.
Все другие полиненасыщенные кислоты, обнаруженные у млекопитающих, образуются из четырех предшественников (пальмитоолеиноэой, олеиновой, линолевой и линоленовой киолот) путем дальнейшего удлинения цепи и (или) введения новых двойных связей. Происходит этот процесс при участии митохондриальных и микросомных ферментов. Например, синтез арахидоновой кислоты происходит по следующей схеме:
Биологическая роль полиненасыщенных жирных кислот в значительной мере прояснилась в связи с открытием нового класса физиологически активных соединений — простагландинов .
Есть основания считать, что скорость биосинтеза жирных кислот во многом определяется скоростью образования триглицеридов и фосфолипидов, ибо свободные жирные кислоты присутствуют в тканях и плазме крови в небольших количествах и в норме не накапливаются.
Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование глицерол-3-фосфата как промежуточного соединения. В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируeтся АТФ с образованием глицерол-3-фосфата:
В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с гликолизом или гликогенолизом 1 . 1 В тех случаях, когда содержание глюкозы в жировой ткани понижено (например, при голодании), образуется лишь незначительное количество глицерол-3-фосфата и освободившиеся в ходе липолиза свободные жирные кислоты не могут быть использованы на ресинтез триглицеридов, поэтому жирные кислоты покидают жировую ткань. Напротив, активация гликолиза в жировой ткани способствует накоплению в ней триглицеридов, а также входящих в их состав жирных кислот. Известно, что в процессе гликолитического распада глюкозы образуется диоксиацетонфосфат . Последний в присутствии цитоплазматической НАД-зависимой глицеролфосфатдегидрогеназы способен превращаться в глицерол-3-фосфат:
В печени же наблюдаются оба пути образования глицерол-3-фосфата.
Образовавшийся, тем или иным путем глицерол-3-фосфат ацилируется двумя молекулами КоА-производного жирной кислоты (т. е. «активными» формами жирной кислоты) 2 . 2 У некоторых микроорганизмов, например у Е. coli, донором ацильной группы являются не КоА-пронзводные, а АПБ-производные жирной кислоты. В результате образуется фосфатидная кислота:
Заметим, что хотя фосфатидная кислота и присутствует в клетках в чрезвычайно малых количествах, однако она является весьма важным промежуточным продуктом, общим для биосинтеза триглицеридов и глицерофосфолипидов (см. схему).
Если идет синтез триглицеридов, то происходит дефосфорилирование фосфатидной кислоты с помощью специфической фосфатазы (фосфатидатфосфатазы) и образование 1,2-диглицерида:
Биосинтез триглицеридов завершается этерификацией образовавшегося 1,2-диглицерида третьей молекулой ацил-КоА:
Синтез наиболее важных глицерофосфолипидов локализован главным образом в эндоплазматической сети клетки. Сначала фосфатидная кислота в результате обратимой реакции с цитидинтрифосфатом (ЦТФ) превращается в цитидиндифосфатдиглицерид (ЦДФ-диглицерид):
Затем в последующих реакциях, каждая из которых катализируется соответствующим ферментом, цитидинмонофосфат вытесняется из молекулы ЦДФ-диглицерида одним из двух соединений — серином или инозитом, образуя фосфатидилсерин или фосфатидилинозит, или 3-фосфатидил-глицерол-1-фосфат. В качестве примера приводим образование фосфатидилсерина:
В свою очередь фосфатидилсерин может декарбоксилироваться с образованием фосфатидилэтаноламина:
Фосфатидмлэтаноламин является предшественником фосфатидилхолина. В результате последовательного переноса трех метильных групп от трех молекул S-аденозилметионина (донора метальных групп) к аминогруппе остатка этаноламина образуется фосфатидилхолин:
Существует еще один путь синтеза фосфатидилэтаноламина и фосфатидилхолина в клетках животных. В этом пути также используется ЦТФ в качестве переносчика, но не фосфатидной кислоты, а фосфорилхолина или фосфорилэтаноламина (схема).

Еще в 60-х годах нынешнего столетия Блох и сотр. в опытах с использованием ацетата, меченного 14 С по метильной и карбоксильной группе, показал, что оба атома углерода уксусной кислоты включаются в холестерин печени приблизительно в одинаковых количествах. Кроме того, было доказано, что все атомы углерода холестерина происходят из ацетата.
В дальнейшем благодаря работам Линена, Редней, Поляка, Корнфорта, А. Н. Климова и других исследователей были выяснены основные детали ферментативного синтеза холестерина, насчитывающего более 35 энзиматических реакций. В синтезе холестерина можно выделить три основные стадии: первая — превращение активного ацетата в мевалоновую кислоту, вторая — образование сквалена из мевалоновой кислоты, третья — циклизация сквалена в холестерин.
Вначале рассмотрим стадию превращения активного ацетата в мевалоновую кислоту. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА является образование ацетоацетил-КоА посредством обратимой тиолазной реакции:
Затем последующая конденсация ацетоацетил-КоА с третьей молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтазы) дает образование β-гидрокси-β-метилглутарил-КоА:
Заметим, что эти первые этапы синтеза мевалоновой кислоты нами уже рассматривались, когда речь шла об образовании кетоновых тел . Далее β-гидрокси-β-метилглутарил-КоА под влиянием НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктазы) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту:
ГМГ-КоА-редуктазная реакция — первая практически необратимая реакция в цепи биосинтеза холестерина и протекает она со значителоной потерей свободной энергии (около 33,6 кДж). Установлено, что данная реакция лимитирует скорость биосинтеза холестерина.
Наряду с классическим путем биосинтеза мевалоновой кислоты имеется второй путь, в котором в качестве промежуточного субстрата образуется не β-гидрокси-β-метилглутарил-КоА, а β-гидрокси-β-метилглутарнл-S-АПБ. Реакции этого пути идентичны, по-видимому, начальным стадиям биосинтеза жирных кислот вплоть до образования ацетоацетил-S-АПБ. В образовании мевалоновой кислоты по этому пути принимает участие ацетил-КоА-карбоксилаза — фермент, осуществляющий превращение ацетил-КоА в малонил-КоА. Оптимальное соотношение малонил-КоА и ацетил-КоА для синтеза мевалоновой кислоты: две молекулы ацетил-КоА на одну молекулу малонил-КоА.
Участие малонил-КоА, основного субстрата биосинтеза жирных кислот, в образовании мевалоновой кислоты и различных полиизопреноидов показано для ряда биологических систем: печени голубя и крысы, молочной железы кролика, бесклеточных дрожжевых экстрактов. Этот путь биосинтеза мевалоновой кислоты отмечается преимущественно в цитоплазме клеток печени. Существенную роль в образовании мевалоната в данном случае играет гидроксиметилглутарил-КоА-редуктаза, обнаруженная в растворимой фракции печени крысы и неидентичная микросомному ферменту по ряду кинетических и регуляторных свойств. Известно, что микросомная гидроксиметилглутарил-КоА-редуктаза является основным звеном регуляции пути биосинтеза мевалоновой кислоты из ацетил-КоА с участием ацетоацетил-КоА-тиолазы и ГМГ-КоА-синтазы. Регуляция второго пути биосинтеза мевалоновой кислоты при ряде воздействий (голодание, кормление холестерином, введение поверхностно-активного вещества — тритона WR-1339) отличается от регуляции первого пути, в котором принимает участие микросомная редуктаза. Эти данные свидетельствуют о существовании двух автономных систем биосинтеза мевалоновой кислоты. Физиологическая роль второго пути изучена неокончательно. Полагают, что он имеет определенное значение не только для синтеза веществ нестероидной природы, таких, как боковая цепь убихинона и уникального основания N 6 (Δ 2 -изопентил)-аденозина некоторых тРНК, но и для биосинтеза стероидов (А. Н. Климов, Э. Д. Полякова).
Во второй стадии ситеза холестерина мевалоновая кислота превращается в сквален. Реакции второй стадии начинаются с фосфорилирования мевалоновой кислоты с помощью АТФ. В результате образуется 5′-пирофосфорный эфир, а затем 5′-пирофосфорный эфир мевалоновой кислоты:
5′-пирофосфомевалоновая кислота в результате последующего фосфорилирования третичной гидроксильной группы образует нестабильный промежуточный продукт — 3′-фосфо-5′-пирофосфомевалоновую кислоту, которая, декарбоксилируясь и теряя фосфорную кислоту, превращается в изопентенилпирофосфат. Последний изомеризуется в диметилаллилпирофосфат:
Затем эти два изомерных изопентенилпирофосфата (диметилаллилпирофосфат и изопентенилпирофосфат) конденсируются с высвобождением пирофосфата и образованием геранилпирофосфата. К геранилпирофосфату вновь присоединяется изопентенилпирофосфат, давая в результате этой реакции фарнезилпирофосфат:
В заключительной реакции данной стадии в результате восстановительной конденсации фарнезилпирофосфата с его диметилаллильным изомером образуется сквален:
В третьей стадии биосинтеза холестерина сквален под влиянием скваленоксидоциклазы циклизируется с образованием ланостерина:
Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метальных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8,9 в положение 5,6. Детали этих последних реакций во многом еще неизвестны:
📺 Видео
Синтез жирных кислот и его регуляция. Влияние избыточного потребления углеводов на их синтезСкачать

Лекция 9.4. Синтез ВЖКСкачать

Обмен Липидов часть 2Скачать

Биосинтез пуринов | БиохимияСкачать

Синтез и бета-окисление жирных кислотСкачать

Биохимия: Инициация синтеза жирных кислотСкачать

Биохимия. Лекция 58. Липиды. Обмен триацилглицеролов и фосфолипидов. Кетоновые тела. Жирные кислотыСкачать

Биохимия. Лекция 57. Липиды. Обмен триацилглицеролов и фосфолипидов. Окисление жирных кислотСкачать

ОБМЕН ЛИПИДОВ 2. Синтез высших жирных кислот.Скачать

Синтез жирных кислот. Биохимия простым языком.Скачать

Биохимия 10.Обмен липидовСкачать

КетогенезСкачать

Коваль А.Н. Лекция БХ липидов МПД (2 часть)Скачать

Биология 9 класс (Урок№12 - Биосинтез белков. Генетичес. код и матричный принцип биосинтеза белков.)Скачать

Энергия окисления жирных кислот. БиохимияСкачать

ЛЕКЦИЯ 3. ЛИПИДЫСкачать
Мобилизация жиров и регуляция. Бета окисление жирных кислот и регуляцияСкачать
Синтез эйкозаниодов. Касакад арахидоновой кислот. ЦиклооксигеназаСкачать