Вопрос по химии:
Сумма всех коэффициэнтов в уравнении реакции меди с концентрированной серной кислотой равна а)7 б)6 в)5 г)4
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- Как написать хороший ответ?
- Сумма всех коэффициэнтов в уравнении реакции меди с концентрированной серной кислотой равна а)7 б)6 в)5 г)4?
- Полное уравнение окислительно — восстановительной реакции между медью и концентрированной серной кислотой с использованием метода электронного баланса?
- 1) Реакция магния с бромом : а)соединения, экзотермическая, сумма коэффициэнтов равна 4 б) соединения, эндотермическая, сумма коэффициэнтов равна 5 в)разложения, экзотермическая, сумма коэффициэнтов р?
- А)составить уравнения реакций магния с концентрированной и неконцентрированной азотной кислотой б)составить уравнения реакций калия с концентрированной и неконцентрированной азотной кислотой в)состави?
- Реакция оксида меди(2) и концентрированной серной кислоты?
- Напишите реакции концентрированной серной кислоты с магнием, свинцом и медью?
- Сумма всех коэффициентов в уравнении взаимодействия меди с концентрированной азотной кислотой равна?
- 1) Реакция магния с бромом : а)соединения, экзотермическая, сумма коэффициэнтов равна 4 б) соединения, эндотермическая, сумма коэффициэнтов равна 5 в)разложения, экзотермическая, сумма коэффициэнтов р?
- Составить уравнения реакций концентрированной серной кислоты с магнием и алюминием?
- 1)Реакция концентрированной серной кислоты с металлом соответствует уравнение ?
- Напишите уравнение реакции концентрированной азотной кислоты с медью?
- ДАЮ 100 БАЛЛОВ ТЕСТ ПО ХИМИИ Вариант 1
- Сумма коэффициентов в уравнении взаимодействия концентрированной серной кислоты с медью равна
- МЕДЬ И ЕЕ ТАЙНА (ИССЛЕДОВАНИЕ ВЗАИМОДЕЙСТВИЯ СЕРНОЙ КИСЛОТЫ С МЕДЬЮ)
- 💡 Видео
Ответы и объяснения 1
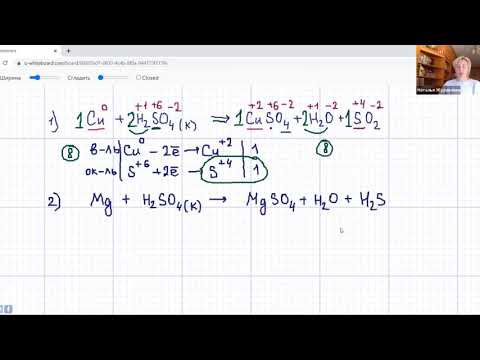
Cu + 2H2SO4 (конц.)→ CuSO4 + SO2 + 2H2O
ответ: 1+2+1+1+2 = 7
а)
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Сумма всех коэффициэнтов в уравнении реакции меди с концентрированной серной кислотой равна а)7 б)6 в)5 г)4?
Химия | 5 — 9 классы
Сумма всех коэффициэнтов в уравнении реакции меди с концентрированной серной кислотой равна а)7 б)6 в)5 г)4.
)→ CuSO4 + SO2 + 2H2O
ответ : 1 + 2 + 1 + 1 + 2 = 7
Видео:Взаимодействие серной кислоты с металламиСкачать

Полное уравнение окислительно — восстановительной реакции между медью и концентрированной серной кислотой с использованием метода электронного баланса?
Полное уравнение окислительно — восстановительной реакции между медью и концентрированной серной кислотой с использованием метода электронного баланса.
Видео:Взаимодействие меди с концентрированной серной кислотойСкачать

1) Реакция магния с бромом : а)соединения, экзотермическая, сумма коэффициэнтов равна 4 б) соединения, эндотермическая, сумма коэффициэнтов равна 5 в)разложения, экзотермическая, сумма коэффициэнтов р?
1) Реакция магния с бромом : а)соединения, экзотермическая, сумма коэффициэнтов равна 4 б) соединения, эндотермическая, сумма коэффициэнтов равна 5 в)разложения, экзотермическая, сумма коэффициэнтов равна 7 г) соединения, экзотермическая, сумма коэффициэнтов равна 3 И само уравнение пожайлуста напишите 2) Бром может реагировать со всеми в — ми ряда : а) водород, железо, кислород б)оксид меди 2, серная кислота, медь, в)вода, водород, фторид натрия г)водород, иодит натрия, алюминий.
Видео:Особенности серной и азотной кислот | Химия ЕГЭ, ЦТСкачать

А)составить уравнения реакций магния с концентрированной и неконцентрированной азотной кислотой б)составить уравнения реакций калия с концентрированной и неконцентрированной азотной кислотой в)состави?
А)составить уравнения реакций магния с концентрированной и неконцентрированной азотной кислотой б)составить уравнения реакций калия с концентрированной и неконцентрированной азотной кислотой в)составить уравнения реакций меди с концентрированной и неконцентрированной азотной кислотой.
Видео:Реакция МЕДИ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Получение СУЛЬФАТА МЕДИ.Опыты по химии.ЭкспериментыСкачать

Реакция оксида меди(2) и концентрированной серной кислоты?
Реакция оксида меди(2) и концентрированной серной кислоты.
Видео:Взаимодействие оксида меди с серной кислотойСкачать

Напишите реакции концентрированной серной кислоты с магнием, свинцом и медью?
Напишите реакции концентрированной серной кислоты с магнием, свинцом и медью.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Сумма всех коэффициентов в уравнении взаимодействия меди с концентрированной азотной кислотой равна?
Сумма всех коэффициентов в уравнении взаимодействия меди с концентрированной азотной кислотой равна.
Видео:Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

1) Реакция магния с бромом : а)соединения, экзотермическая, сумма коэффициэнтов равна 4 б) соединения, эндотермическая, сумма коэффициэнтов равна 5 в)разложения, экзотермическая, сумма коэффициэнтов р?
1) Реакция магния с бромом : а)соединения, экзотермическая, сумма коэффициэнтов равна 4 б) соединения, эндотермическая, сумма коэффициэнтов равна 5 в)разложения, экзотермическая, сумма коэффициэнтов равна 7 г) соединения, экзотермическая, сумма коэффициэнтов равна 3 И само уравнение пожайлуста напишите 2) Бром может реагировать со всеми в — ми ряда : а) водород, железо, кислород б)оксид меди 2, серная кислота, медь, в)вода, водород, фторид натрия г)водород, иодит натрия, алюминий.
Видео:Взаимодействие меди с концентрированной азотной кислотой - 9 - 11 классСкачать

Составить уравнения реакций концентрированной серной кислоты с магнием и алюминием?
Составить уравнения реакций концентрированной серной кислоты с магнием и алюминием.
Видео:Алюминий, цинк и медь с соляной кислотой. Аманиязова Умида, Х01-310Скачать

1)Реакция концентрированной серной кислоты с металлом соответствует уравнение ?
1)Реакция концентрированной серной кислоты с металлом соответствует уравнение :
Видео:взаимодействие серной кислоты с металламиСкачать

Напишите уравнение реакции концентрированной азотной кислоты с медью?
Напишите уравнение реакции концентрированной азотной кислоты с медью.
Вы находитесь на странице вопроса Сумма всех коэффициэнтов в уравнении реакции меди с концентрированной серной кислотой равна а)7 б)6 в)5 г)4? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 5 — 9 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
Видео:Взаимодействие цинка с серной кислотойСкачать

ДАЮ 100 БАЛЛОВ ТЕСТ ПО ХИМИИ
Вариант 1
1. Самым распространенным металлом в земной коре является:
а) натрий; б) алюминий; в) золото; г) кальций.
2.Из приведенного перечня металлов: Na, Cd ,Ca ,Co, Mn, L,i, Au ,Zn, Mg, Cu, Os
к легким относятся:
к тяжелым относятся:
3. Получение металлов из руд при высоких температурах называется:
а) электрометаллургия б) пирометаллургия в) гидрометаллургия г) карботермия
4. В электротехнике для производства ламп накаливания используют металлическую нить:
а) Al б) Ca в) Mo г) W
5. При сгорания натрия в кислороде образуется вещество состава … , а при сгорании железа в кислороде образуется …
6. Сколько молей оксида алюминия образуется из одного моля алюминия по реакции:
а) 0.5 б) 2 в) 3 г) 4
7. Сплав никеля и хрома , обладающий большой жаропрочностью называется:
а) латунь б) дюралюминий в) бронза г) нихром
8. Верны ли следующие суждения о металлах: А) В периоде с увеличением заряда ядра металлические свойства ослабевают; Б) Все металлы при комнатной температуре являются твердыми.
а) верно только А б) верно только Б в) верны оба суждения г) оба суждения не верны.
9) Медну пластинку внесли в нагретую до температуры красного каления печь. Какой из графиков отражает изменение массы пластинки приокисления меди до оксида меди
а) б) в) г)
10. Какой из перечисленных металлов способен вытеснять водород из воды при комнатной температуре:
а) медь б) железо в) натрий в) серебро
11. При растворения натрия в воде образуется раствор:
а) пероксид натрия б) оксида натрия в) гидроксида натрия г) гидрида натрия
12. Тип связи, существующий в кристаллах металлов:
1) Ионная 2) Ковалентная полярная 3) Ковалентная неполярная 4) Металлическая
13. Соляной кислотой не будет взаимодействовать:
а) Cu б) Fe в) Al г) Zn
14. С водой не взаимодействует:
а) Сa б) Ni в) Fe г) Na
15. Между какими из попарно взятых веществ, формулы которых даны ниже (электролит берется в виде водного раствора), произойдет химическая реакция:
а) Au и AgNO3 б) Zn и MgCl2 в) Pb и ZnSO4 г) Fe и CuCl2
16. Сумма всех коэффициентов в уравнении реакции меди с концентрированной серной кислотой равна:
а) 7; б) 6; в) 5; г) 4
17. Качественным реактивом на катион кальция Ca2+ является:
а) нитрат-ион б) карбонат-ион в) сульфат-ион г) хлорид-ион
Задания с открытым ответом
18. Осуществите превращения:Na→Na2O2 →Na2O→NaOH→Na3PO4→NaNO3.. Укажите типы реакции.5 реакцию напишите в сокращенно-ионном виде.
19. Вычислите массу хлорида алюминия, образующегося при взаимодействии 5.4 г алюминия с соляной кислотой, если выход продукта реакции от теоретически возможного составляет 80%?
Видео:Взаимодействие меди с кислотамиСкачать

Сумма коэффициентов в уравнении взаимодействия концентрированной серной кислоты с медью равна
Видео:Взаимодействие меди с концентрированной серной кислотой.Скачать

МЕДЬ И ЕЕ ТАЙНА (ИССЛЕДОВАНИЕ ВЗАИМОДЕЙСТВИЯ СЕРНОЙ КИСЛОТЫ С МЕДЬЮ)
Но после прекращения нагревания в пробирке отчетливо наблюдается образование осадка черного цвета, хотя ни один из продуктов, представленных в уравнении, не имеет черную окраску. После оседания частичек твердой фазы раствор остался бесцветным, не приобрел голубую окраску, характерную для гидратированных ионов меди Cu 2+.
В результате сопоставления видимых результатов химической реакции не согласующихся с уравнением, представленными в учебнике, возникло противоречие
Цель: доказать опытным путем качественный состав продуктов реакции концентрированной серной кислоты с медью и разрешить возникшее противоречие.
Качественные реакции, подтверждающие его состав
Вывод: Выделяется оксид серы (IV)
Вывод: При добавлении воды появляется голубая окраска, характерная для гидратированных ионов меди(II), с солями бария выпадает осадок белого цвета
Осадок CuO или Cu2O
Вывод: Осадок должен был раствориться в кислоте, с образованием соли и воды, но он не растворился в 1 опыте.
Вывод: Осадок растворился с выделением бурого газа, раствор стал голубым
Таким образом, мы доказали, что протекают по меньшей мере две реакции: основная (1) и побочные (2,3), в ходе которых образуется сульфид меди (II) или (I) , сведения о параллельных реакциях практически отсутствуют в учебниках и большинстве пособий.
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 (1)
4 Cu + 4 H2SO4 = 3 CuSO4 + 4 H2O + CuS (2)
5 Cu + 4 H2SO4 = 3 CuSO4 + 4 H2O + Cu2S(3)
1. Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ.- М.: Химия, 2000.-С.286
2. О.С.Габриелян. Химия: учебник для 9 класса общеобразовательных учреждений- Москва: Дрофа, 2010.- С. 138
3. Реми Г. Курс неорганической химии. Т.2. –М,: Мир, 1966. – С.400
ВВЕДЕНИЕ
не нуждается в эксперименте
в такой степени, как химия.
Каждую секунду в окружающем нас мире происходит неисчислимое множество химических реакции, одни из которых с предсказуемым результатом, другие нет.
При изучении темы «Серная кислота и ее свойства» мы наблюдали демонстрационный опыт взаимодействия концентрированной серной кислоты с пассивными металлами – медью. В процессе нагревания реакционной смеси происходило выделение газообразного продукта и растворение металла меди. Данный процесс [1], [2], [3] отражает химическое уравнение:
Но после прекращения нагревания в пробирке отчетливо наблюдается образование осадка черного цвета, хотя ни один из продуктов, представленных в уравнении, не имеет черную окраску. После оседания частичек твердой фазы раствор остался бесцветным; не приобрел голубую окраску, характерную для гидратированных ионов меди Cu 2+.
В результате сопоставления видимых результатов химической реакции не согласующихся с уравнением, представленным в учебнике, возникли противоречия:
1. Почему полученная соль сульфат меди (II) не имеет голубой окраски?
2. Какой осадок выделяется при данной реакции?
Мы обратились к интернет ресурсам [1] и учебным пособиям [2], [3], [4], [5], [6], в которых рассматриваются свойства концентрированной серной кислоты; в большинстве случаев продуктами взаимодействия являются соль, газ и вода, согласно уравнению, представленному выше, но в пособии [4] рассматривается три различных варианта взаимодействия меди с серной кислотой, с учетом температуры кислоты:
А в [5] обращается внимание на возможность многостадийности взаимодействия меди с горячей концентрированной серной кислотой и образование оксида меди (II) на первом этапе:
В пособии по неорганической химии [2] , рассматривается данный процесс, с возможностью образования в продуктах реакции анилита Cu7S4
ОСНОВНАЯ ЧАСТЬ
Цель: доказать опытным путем качественный состав продуктов реакции концентрированной серной кислоты с медью и разрешить возникшее противоречие между видимыми результатами опыта и описанным уравнением данной реакции.
Задачи:
Проанализировать и подобрать методику по определению качественного состава основных продуктов химической реакции
Составить алгоритм проведения качественных реакций, подтверждающий состав продуктов реакции
Провести химический анализ
Сделать выводы, подтверждающие или опровергающие предположения.
Методы:
исследовательский метод, позволяющий прогнозировать результат, составлять алгоритм научного исследования и сформировать опыт выполнения исследования.
метод химического эксперимента, в ходе которого совершенствуется техника проведения эксперимента, поиск различных способов выполнения эксперимента, сравнение и сопоставление результатов.
Помещаем в пробирку медную проволоку, с которой удалена изоляция, затем приливаем концентрированную серную кислоту. Замечаем, что без нагревания никаких изменений не наблюдается. При нагревании отчетливо видно, как начинается выделяться газ и образуется осадок черного цвета. Выделяющийся газ имеет резкий запах. Попытка поджечь его у отверстия газоотводной трубки не приводит к успеху. Происходящий процесс описывается уравнением:
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2
Гипотеза: выделяется оксид серы (IV) (сернистый газ) — негорючий бесцветный газ с резким запахом. Для доказательства используем реакцию с сильным окислителем – перманганатом калия.
Газоотводную трубку опускаем в стаканчик с раствором перманганата калия (подкисленный), наблюдаем, что окраска раствора исчезла, раствор стал бесцветным. Продолжим пропускание выделяющегося газа через раствор KMnO4 (нейтральный и щелочной раствор), наблюдаем, что в стаканчике с нейтральной средой раствор окрасился в бурый цвет, т.к. выпал осадок MnO2 а в стаканчике с щелочной средой раствор окрасился в зеленый цвет, т.к. образовались манганат – ионы MnO4 2- . К отверстию газоотводной трубки поднесем влажную синюю лакмусовую бумажку, она окрасилась в розовый цвет.
Вывод: химические свойства исследуемого вещества свидетельствуют о том, что выделяется сернистый газ.
Гипотеза: В процессе реакции выделяется сульфат меди (II), но его водный раствор должен быть голубого цвета; возможно воду поглощает концентрированная серная кислота.
Для проверки выдвинутого предположения помещаем в пробирку тонко измельченный медный купорос CuSO4*5H2O голубого цвета, приливаем концентрированную серную кислоту и осторожно перемешиваем стеклянной палочкой. Через некоторое время раствор становится бесцветным, голубая окраска осадка исчезает.
Вывод: Воду прочно связывает концентрированная серная кислота.
Гипотеза: Осадок черного цвета может быть оксидом меди (II).
Это вещество нам известно, мы его получали разложением малахита в 8 и 9 классе, растворяя в разбавленной серной кислоте, получали кристаллы медного купороса.
Для проверки выдвинутого предположения в пробирку наливаем 1-2 мл концентрированной серной кислоты и добавляем очень небольшими порциями тонкий порошок оксида меди (II) черного цвета так, чтобы частички твердой фазы находились во взвешенном состоянии. При нагревании заметно, как CuO растворяется, черный цвет исчезает. Постепенно из раствора выделяются кристаллики светло-серого цвета. Берем пробирку, в которой шло взаимодействие серной кислоты с оксидом меди (II), чтобы отделить осадок от раствора. Для этого сливаем избыток серной кислоты, как можно полнее. К осадку прибавляем несколько капель воды и наблюдаем появление голубой окраски.
Вывод: полученный в ходе реакции осадок должен был раствориться при нагревании в избытке концентрированной кислоты. Значит, данный осадок не является оксидом меди (II), а другое вещество.
Гипотеза: Вещество черного цвета содержит медь и, возможно, серу, как вариант сульфид меди (II) CuS.
Осадок, полученный в опыте 1, фильтруем, тщательно промываем водой до полного отсутствия сульфат – ионов. Пробуем растворить его в соляной и азотной кислотах. Наблюдаем, что осадок растворяется только при нагревании в концентрированной азотной кислоте, при этом раствор приобретает синюю окраску, характерную для гидратированных ионов меди. При разбавлении синяя окраска переходит в голубую. В процессе реакций выделяется бурый газ – оксид азота (IV), следовательно, в состав исследуемых веществ входит восстановитель, в роли которого могут выступать ионы S 2- и Cu 2+
CuS + 8HNO3 (конц.) = CuSO4 + 8 NO2 + 4H2O Вывод: Чтобы окончательно подтвердить гипотезу о том, что при взаимодействии меди с концентрированной серной кислотой образуется сульфид меди (II), мы исследовали продукт окисления осадка. Если осадок представляет собой сульфид меди (II), то при его окислении азотной кислотой в полученном растворе должен обнаружиться сульфат – ион. При добавлении в исследуемую смесь раствора хлорида бария наблюдается выпадение осадка белого цвета, который не растворяется при подкислении.
ЗАКЛЮЧЕНИЕ
Таким образом, мы доказали, что при взаимодействии концентрированной серной кислоты с медью протекают по меньшей мере две реакции: основная (1), в результате которой образуются как в большинстве реакций, связанных с концентрированными кислотами – соль, сульфат меди (II), газ – оксид серы (IV) и вода; и побочная (2), входе которой образуется сульфид меди (II), соль и вода. Сведения о параллельной реакции практически отсутствуют в учебниках и большинстве пособий.
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 (1)
4 Cu + 4 H2SO4 = 3 CuSO4 + 4 H2O + CuS (2)
5 Cu + 4 H2SO4 = 3 CuSO4 + 4 H2O + Cu2S (3)
Полученное вещество, сульфид меди, можно использовать на уроках химии для реакций, проводимых при изучении темы: «Сульфиды»
СПИСОК ЛИТЕРАТУРЫ
2. . Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. –М.: издательство Экзамен; 2010.-С.374
3 Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ.- М.: Химия, 2000.-С.286
4. О.С.Габриелян. Химия: учебник для 9 класса общеобразовательных учреждений- Москва: Дрофа, 2010
5.- С. 138Реми Г. Курс неорганической химии. Т.2. –М,: Мир, 1966. – С.
6. 400Химия . Пособие-репетитор для поступающих в вузы. Под ред. Егорова А.С. 5-е изд. — Ростов н/Д.: 2003. — 768с.
💡 Видео
Разбавление серной кислотыСкачать

СЕРНАЯ КИСЛОТА | H2SO4 | Химические свойства разбавленной и концентрированной СЕРНОЙ КИСЛОТЫ | ХимияСкачать

Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Взаимодействие сахара с концентрированной серной кислотой - 9 - 11 классСкачать

Правило разбавления концентрированной серной кислоты водойСкачать

ОВР с серной и азотной кислотами.Скачать