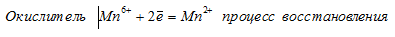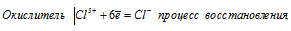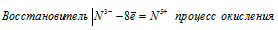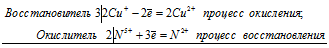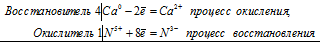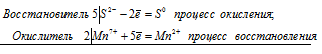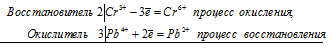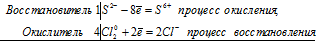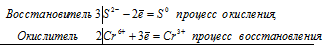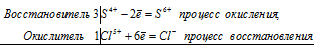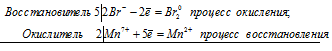Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Ваш ответ
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

решение вопроса
Видео:Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

Похожие вопросы
- Все категории
- экономические 43,405
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,990
- разное 16,855
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Окислительно-восстановительные реакции
К окислительно-восстановительным относится реакция, схема которой имеет вид …
Схема, которая соответствует процессу окисления, имеет вид …
1) P 0 →P +5
Схема процесса, в котором происходит восстановление серы, имеет вид …
2)
3)
4)
К окислительно-восстановительным не относится реакция, схема которой имеет вид …
1)
2)
3)
4)
Сумма коэффициентов в уравнении окислительно-восстановительной реакции KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O равна …
2) 21
Коэффициент перед формулой окислителя в уравнении окислительно-восстановительной реакции NaClO3 + HCl →NaCl + Cl2 + H2O равен …
1) 2 2) 3 3) 14) 6
1) 32) 1 3) 5 4) 6
1) 102 2) 294 3) 98 4) 34
Значение ЭДС гальванического элемента 

1) 1,25 2) – 1,25 3) 0,45 4) – 0,45
Значение ЭДС гальванического элемента, состоящего из медного и магниевого электродов, погруженных в 0,1М растворы их нитратов, равно ___ В ( 

2) 2,70
При работе гальванического элемента, состоящего из цинкового и никелевого электродов, погруженных в 0,1М растворы их сульфатов, на катоде протекает реакция, уравнение которой имеет вид …
1) Zn 2+ + 2e = Zn 0
2) Ni 2+ + 2e = Ni 0
3) Ni 0 — 2e = Ni 2+
4) Zn 0 — 2e = Zn 2+
Значение ЭДС гальванического элемента, состоящего из медного и кадмиевого электродов, погруженных в 0,1М растворы их нитратов, можно увеличить, если …
1) увеличить концентрацию нитрат-ионов
2) уменьшить концентрацию нитрата меди (II)
3) уменьшить концентрацию нитрата кадмия
4) увеличить концентрацию нитрата кадмия
При добавлении щелочи в раствор, содержащий ионы железа (II), значение ЭДС гальванического элемента Fe 0 | Fe 2+ | Ni 2+ |Ni 0 …
1) увеличится
3) станет равным нулю
Объем хлора, который образуется на инертном аноде при пропускании тока силой 10,8 А в течение 4 часов через раствор хлорида натрия, составляет ____ л (н. у.) (Выход по току 100%; F = 96500 Кл/моль).
1) 18 2) 36 3) 45 4) 54
Масса серебра, выделившегося на катоде при пропускании тока силой 19,3 А в течение 50 минут через раствор нитрата серебра с выходом по току 100 %, составляет ____ г (F = 96500 Кл/моль).
Ответ: 64,8 г
Наиболее технологичным и эффективным способом выделения металлов из растворов является электролиз. Если годовой объем очищаемой воды равен 1000 м 3 , а содержание в нем ионов Pt 4+ в виде анионных комплексов составляет 7,8 мг/дм 3 , то время, необходимое для выделения всей платины электролизом при силе тока 11,9 А и выходе по току 100 %, составит ______ суток. (Ответ привести с точностью до целых; Ar(Pt) = 195; F = 96500 Кл/моль.)
Ответ: 15 суток
При электролизе водного раствора нитрата серебра с инертными электродами на катоде происходит выделение вещества, формула которого имеет вид …
При электролизе 200 г расплава гидроксида натрия (выход по току составляет 100%) на инертном аноде образуется ____ л кислорода (н.у.).
1) 56 2) 28 3) 7 4) 112
Сточные воды некоторого промышленного предприятия содержат соли тяжелых металлов, неорганические кислоты, поверхностно-активные вещества (ПАВ) и другие загрязнители окружающей среды. Наиболее технологичным и эффективным способом выделения металлов из растворов является электролиз. Если годовой объем очищаемой воды равен 1000 м 3 , а содержание в нем ионов в виде анионных комплексов составляет 8,7 мг/дм 3 , то время, необходимое для выделения всего золота электролизом при силе тока 14,79 А и выходе по току 100 %, составит ______ суток. (Ответ привести с точностью до целых; Ar(Au) = 197; F = 96500 Кл/моль.)
Ответ: 10 суток
Сточные воды некоторого промышленного предприятия содержат соли тяжелых металлов, неорганические кислоты, поверхностно-активные вещества (ПАВ) и другие загрязнители окружающей среды. Они в виде взвеси поступают на очистные сооружения.
Наиболее технологичным и эффективным способом выделения металлов из растворов является электролиз. Если годовой объем очищаемой воды равен 1000 м 3 , а содержание в ней ионов Cr 3+ составляет 12,6 мг/дм 3 , то время, необходимое для выделения всего хрома электролизом при силе тока 22,3 А и выходе по току 80 %, составит ______ суток.
(Ответ привести с точностью до целых; Ar(Cr) = 52; F = 96500 Кл/моль.)
Ответ: 45 суток
Сточные воды некоторого промышленного предприятия содержат соли тяжелых металлов, неорганические кислоты, поверхностно-активные вещества (ПАВ) и другие загрязнители окружающей среды. Они в виде взвеси поступают на очистные сооружения. Наиболее технологичным и эффективным способом выделения ценных металлов из растворов является электролиз. Если годовой объем очищаемой воды равен 1000 м 3 , а содержание в ней ионов Ru 4+ в виде анионных комплексов составляет 0,05 мг/дм 3 , то время, необходимое для выделения всего рутения электролизом при силе тока 13,25 А и выходе по току 80 %, составит ______5 часов.
(Ответ привести с точностью до целых; Ar(Ru) = 101; F = 96500 Кл/моль.)
Ответ: 5 часов
Сточные воды некоторого промышленного предприятия содержат соли тяжелых металлов, неорганические кислоты, поверхностно-активные вещества (ПАВ) и другие загрязнители окружающей среды.
Наиболее технологичным и эффективным способом выделения металлов из растворов является электролиз. Если годовой объем очищаемой воды равен 1000 м 3 , а содержание в нем ионов Co 2+ составляет 15,8 мг/дм 3 , то время, необходимое для выделения всего кобальта электролизом при силе тока 18,69 А и выходе по току 80 %, составит ______ 40 суток. (Ответ привести с точностью до целых; Ar(Co) = 59; F = 96500 Кл/моль.)
Ответ: 40 суток
При работе гальванического элемента, состоящего из цинкового и никелевого электродов, погруженных в 0,1М растворы их сульфатов, на катоде протекает реакция, уравнение которой имеет вид …
1) Ni 2+ + 2e = Ni 0
2) Ni 0 — 2e = Ni 2+
3) Zn 2+ + 2e = Zn 0
4) Zn 0 — 2e = Zn 2+
При работе гальванического элемента, состоящего из железного и никелевого электродов, погруженных в 0,5М растворы их сульфатов, на аноде протекает реакция, уравнение которой имеет вид …
1) Ni 2+ + 2e = Ni 0
2) Ni 0 — 2e = Ni 2+
3) Fe 2+ + 2e = Fe 0
4) Fe 0 — 2e = Fe 2+
Масса серебра, выделившегося на катоде при пропускании тока силой 19,3 А в течение 50 минут через раствор нитрата серебра с выходом по току 100 %, составляет ____ г
1) 64,8
Сила тока, которую необходимо поддерживать для получения 16,2 г серебра путем электролиза раствора нитрата серебра за 30 минут, составляет ____ А (выход по току 100%, 
1) 4 2) 8 3) 16 4)12
В результате полного электролиза водного раствора нитрата серебра с инертными электродами образуется раствор, значение рН которого …
3) — — 2e = Cl2
Сумма коэффициентов в общем уравнении электролиза раствора хлорида меди (II) с инертными электродами равна …
Сумма коэффициентов в общем уравнении электролиза водного раствора йодида калия с инертными электродами равна …
1) 8
При нарушении никелевого покрытия на железном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид …
1)
2) Ni 2+ + 2e = Ni 0
3) Fe 0 — 2e = Fe 2+
4) Ni 0 — 2e = Ni 2+
При нарушении оловянного покрытия на железном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид …
1) Sn 0 — 2e = Sn 2+
2)
3) Fe 2+ + 2e = Fe 0
4) Fe 0 — 2e = Fe 2+
При нарушении серебряного покрытия на никелевом изделии в кислой среде на катоде будет протекать реакция, уравнение которой имеет вид …
1)
2) Ni 2+ + 2e = Ni 0
3) Ni 0 — 2e = Ni 2+
Время, необходимое для получения 9,6 г меди путем электролиза раствора сульфата меди (II) при силе тока 25 А, составляет ____ минуты (выход по току составляет 100%, F = 96500 Кл/моль).
2) 19,3
Формула вещества, которое способно проявлять и окислительные, и восстановительные свойства, имеет вид …
Формула вещества, которое способно проявлять свойства как окислителя, так и восстановителя, имеет вид …
Металлом, который нельзя получить электролизом водного раствора его соединения, является…
1) Ba
В окислительно-восстановительной реакции 
1) является только окислителем
2) является и окислителем, и восстановителем
3) является только восстановителем
4) не проявляет окислительно-восстановительных свойств
Одинаковые продукты образуются на инертных электродах при электролизе расплава и водного раствора соединения, формула которого …
1) CuBr2 2) CuSO4 3) AgF 4)AgBr
Формула вещества, которое способно проявлять только восстановительные свойства, имеет вид …
1) NaI
Формула соли, раствор которой после электролиза с инертными электродами обладает рН 2+ , Cu 2+ , Zn 2+ , последовательность выделения металлов на инертном катоде имеет вид …
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Методы составления уравнений окислительно-восстановительных реакций
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Решение задач по химии на определение коэффициентов в уравнении реакции методом электронного баланса
Задание 226.
Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях:
Мn 6+ ⇔ Мn 2+ ; С1 5+ ⇔ С l- ; N 3- ⇔ N 5+ . На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
Сu2O + HNO3 ⇔ Cu(NO3)2 + NO + H2O.
Решение:
При превращении Мn 6+ ⇔ Мn 2+ происходит процесс восстановления (присоединение электронов).
При превращении С1 5+ ⇔ С l- происходит процесс восстановления (присоединение электронов).
При превращении N 3- ⇔ N 5+ происходит процесс окисления (отдача электронов).
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
6Сu + + 2N 5+ = 6Cu 2+ + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Молекулярное уравнение реакции:
Задание 227.
Реакции выражаются схемами:
HNO3 + Ca ⇔ NH4NO3 + Ca(NO3)2 + H2O;
K2S + KMnO4 +Н2SO4 ⇔ S + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Са 0 + N 5+ = 4Са 2+ + N 3-
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 8, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Са – восстановитель, HNO3 – окислитель; Са окисляется до Ca(NO3)2, HNO3 – восстанавливается до NH4NO3.
5S 2- + 2Mn 7+ ⇔ 5S 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: К2S – восстановитель, KMnO4 – окислитель; К2S окисляется до К2SO4, KMnO4 – восстанавливается до MnSO4.
Задание 228.
Исходя из степени окисления хрома, йода и серы в соединениях К2Cr2O7, КI и Н2SO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Решение:
а) Степень окисления хрома, йода и серы в указанных соединениях соответственно равна +6 (высшая), -1 (низшая) и +6 (высшая). Отсюда: К2Cr2O7 только окислитель; КI — только восстановитель; Н2SO4 — только окислитель.
б) NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Сr 3+ + 3Pb 4+ ⇔ 2Сr 6+ + Pb 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 229.
Реакции выражаются схемами:
H2S + Cl2 + H2O ⇔ H2SO4 + HCl
K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнения электронного баланса:
S -2 + 4Cl2 0 ⇔ S +6 + 8Cl -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 2, получаем коэффициент 4 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Н2S – восстановитель, Cl2 – окислитель; Н2S окисляется до Н2SO4, Cl2 – восстанавливается до HCl.
б) K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
3S 2- + 2Cr 6+ ⇔3S 0 + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 230.
Реакции выражаются схемами:
KClO3 + Na2SO3 ⇔ KCl + Na2SO4;
KMnO4 + HBr ⇔ Br2 + KBr + MnBr2 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Na2SO3 – восстановитель, KClO3 – окислитель; Na2SO3 окисляется до Na2SO4, KClO3 – восстанавливается до KCl.
10Br — + 2Mn 7+ ⇔ 5Br2 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HBr – восстановитель, KMnO4 – окислитель; HBr окисляется до Br2, KMnO4 – восстанавливается до MnBr2.
📸 Видео
FeSO4+KMnO4+H2SO4=Fe2(SO4)3+MnSO4+K2SO4+H2O расстановка коэффициентов методом электронного балансаСкачать
ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Учимся составлять электронный баланс/овр/8классСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

KBr+KMnO4+H2SO4=Br2+MnSO4+K2SO4+H2O расстановка коэффициентов методом электронного баланса 10.47вСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

СУММА КОЭФФИЦИЕНТОВ: Как решать Квадратные Уравнения по МАТЕМАТИКЕ 8 классСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

КАК НАПИСАТЬ РЕАКЦИЮ KMnO4 + MnSO4 + H2O и УРАВНЯТЬ ЕЁ / Реакция перманганата и сульфата марганцаСкачать

Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O ХИМИЯ ЕГЭ Окислительно-восстановительные реакции УрокСкачать

KMnO4+Na2SO3+H2SO4.aviСкачать

Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать